同位素内标-液相色谱-串联质谱法同时测定粮食及其制品中的5种真菌毒素
2017-06-15姜德铭杨永坛
高 蓓, 姜德铭, 杨永坛
(中粮营养健康研究院, 营养健康与食品安全北京市重点实验室, 北京 102209)
研究论文
同位素内标-液相色谱-串联质谱法同时测定粮食及其制品中的5种真菌毒素
高 蓓, 姜德铭, 杨永坛*
(中粮营养健康研究院, 营养健康与食品安全北京市重点实验室, 北京 102209)
建立了同位素内标-液相色谱-串联质谱快速测定粮食及其制品中玉米赤霉烯酮(ZON)、雪腐镰刀菌烯醇(NIV)、脱氧雪腐镰刀菌烯醇(DON)及其衍生物3-乙酰基脱氧雪腐镰刀菌烯醇(3-ACDON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-ACDON)5种真菌毒素的分析方法。以乙腈-水(84∶16, v/v)为提取液,采用多功能净化柱净化,同位素内标法定量。5种真菌毒素在各自的线性范围内线性关系良好,相关系数(r2)均大于0.99,检出限(LOD,S/N=3)为5~20 μg/kg。大麦、小麦、燕麦、玉米等9种代表性粮食及其制品在3个不同添加水平下的加标回收率为84.2%~114.5%,相对标准偏差(RSD)为0.4%~9.9%(n=6)。该法操作简单,成本低,准确可靠,灵敏度高,可同时检测粮食及其制品中的5种真菌毒素。
液相色谱-串联质谱法;同位素内标;真菌毒素;粮食及其制品
真菌毒素(mycotoxins)是由真菌侵染食品、饲料及农产品产生的有毒次级代谢产物,对人和动物危害极大[1]。全球每年约有25%的粮食会受到真菌毒素的污染,导致数千亿美元的经济损失[2,3]。其中,玉米赤霉烯酮(zearalenone, ZON)、雪腐镰刀菌烯醇(nivalenol, NIV)、脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)及其衍生物3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynivalenol, 3-ACDON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl-deoxynivalenol, 15-ACDON)均由某些镰刀属真菌产生。
ZON主要污染玉米、小麦、大米、大麦、小米和燕麦等谷物[4],具有雌激素作用,主要作用于生殖系统,可使家畜、家禽和实验小鼠产生雌性激素亢进症[5]。DON主要污染小麦、大麦、燕麦、玉米等谷类作物[6],也可污染如面包、饼干、麦制点心等粮食制品[7,8],在牛奶和鸡蛋中亦有发现DON的残留[9,10]。DON对人和动物均有较强毒性,能产生呕吐、腹泻、神经紊乱、流产、死胎等不良现象[11]。NIV具有与DON相似的毒性,但毒副作用较DON低[12]。3-ACDON、15-ACDON为脱氧雪腐镰刀菌烯醇的乙酰化产物,属于隐蔽性真菌毒素,在粮油作物产品中多有发现[13]。我国目前制定的GB 2761-2014标准中规定了食品中ZON和DON的限量值,在GB 13078.2-2006和GB 13078.3-2007标准中规定了饲料中ZON和DON的限量值,但尚未有标准规定NIV、3-ACDON和15-ACDON的限量值。目前NIV没有任何标准检测方法,而涉及3-ACDON和15-ACDON的标准检测方法仅有SN/T 3137-2012 《出口食品中脱氧雪腐镰刀菌烯醇、3-乙酰脱氧雪腐镰刀菌烯醇、15-乙酰脱氧雪腐镰刀菌烯醇及其代谢物的测定 液相色谱-质谱/质谱法》。因此,建立粮食及其制品中ZON、NIV、DON、3-ACDON、15-ACDON的检测方法迫在眉睫。
目前,食品中真菌毒素的检测方法主要有酶联免疫吸附法(ELISA)[14,15]和液相色谱法[16-18]。近年来,液相色谱-串联质谱法(LC-MS/MS)在检测真菌毒素方面的优势逐渐显现[19-21],如采用LC-MS/MS测定真菌毒素时,可避免液相色谱法的在线衍生,方法简单快速。本实验利用多功能净化柱进行前处理,建立了LC-MS/MS测定粮食及其制品中5种真菌毒素的分析方法。该方法简单快速,重复性好,用于阳性对照品的测定,结果令人满意,可为企业和检测机构提供有效的技术支持。
1 实验部分
1.1 仪器、试剂与材料
LC 30A-MS/MS 8040液相色谱-串联质谱仪(日本Shimadzu公司); Osterizer 10 speed均质机(美国Blender公司); TTL-DCⅡ型氮吹仪(北京同泰联科技发展有限公司); Vortex-5涡旋振荡器(德祥基业(北京)科技有限公司); Allegra 64R离心机(美国Beckman公司); ME204电子天平(瑞士Mettler Toledo公司); Mycosep226多功能净化柱(美国Romer公司)。实验室用水均由Milli-Q超纯水仪制备得到。
真菌毒素标准品ZON(100.4 mg/L)、NIV(100.1 mg/L)、DON(100.1 mg/L)、3-ACDON(100.3 mg/L)、15-ACDON(100.6 mg/L)和同位素内标13C15-NIV(25.07 mg/L)、13C15-DON(25.5 mg/L)、13C17-3-ACDON(25.1 mg/L)、13C18-ZON(25.1 mg/L)均购自美国Romer公司。
阳性对照品:玉米粉(ZON: (67±16) μg/kg,批号:M15361Z,有效期至2018年1月9日)、小麦粉(DON: (1 431±256) μg/kg,批号:M14222B,有效期至2017年1月6日)购自美国Romer公司。
实验用9种代表性粮食及其制品样品(大麦、小麦、燕麦、玉米、大米、小米、啤酒、面粉、饼干)均为委托检验样品。
1.2 标准溶液的配制
分别准确量取200 μL 各单标标准溶液,用乙腈-水(15∶85, v/v)定容至10 mL,配制质量浓度为2 mg/L的各单标标准储备液;取适当标准储备液用乙腈-水(15∶85, v/v)逐级稀释。
准确量取200 μL NIV、100 μL DON、200 μL 3-ACDON、200 μL 15-ACDON、10 μL ZON的标准溶液,用乙腈-水(15∶85, v/v)定容至1 mL,涡旋混匀,配制质量浓度分别为20.02 mg/L NIV、10.01 mg/L DON、20.06 mg/L 3-ACDON、20.12 mg/L 15-ACDON, 1.004 mg/L ZON的混合标准溶液。
分别吸取100 μL 4种同位素标准溶液,用乙腈-水(15∶85, v/v)定容至1 mL,混匀,配制质量浓度为2.5 mg/L的混合内标工作液。准确移取适量混合标准溶液和100 μL混合内标工作液,用乙腈-水(15∶85, v/v)配制系列混合标准工作液,具体质量浓度见表1。
1.3 样品前处理
1.3.1 固体样品
分别称取50 g(精确至0.01 g)大麦、小麦、燕麦、玉米、大米、小米、面粉、饼干样品于100 mL萃取杯中,加入100 mL乙腈-水(84∶16, v/v),均质3 min,以5 000 r/min离心15 min,取上清液过滤。准确吸取9.8 mL滤液于25 mL比色管中,加入200 μL质量浓度为2.5 mg/L的混合内标工作液,涡旋30 s,混匀,然后上样至多功能净化柱中净化,收集净化液。移取5.0 mL净化液,置于50 ℃水浴中,用氮气吹干,加入1.0 mL乙腈-水(15∶85, v/v)溶解残渣,涡旋混匀30 s,以15 000 r/min离心10 min,吸取上清液,过0.22 μm滤膜,上机测定。
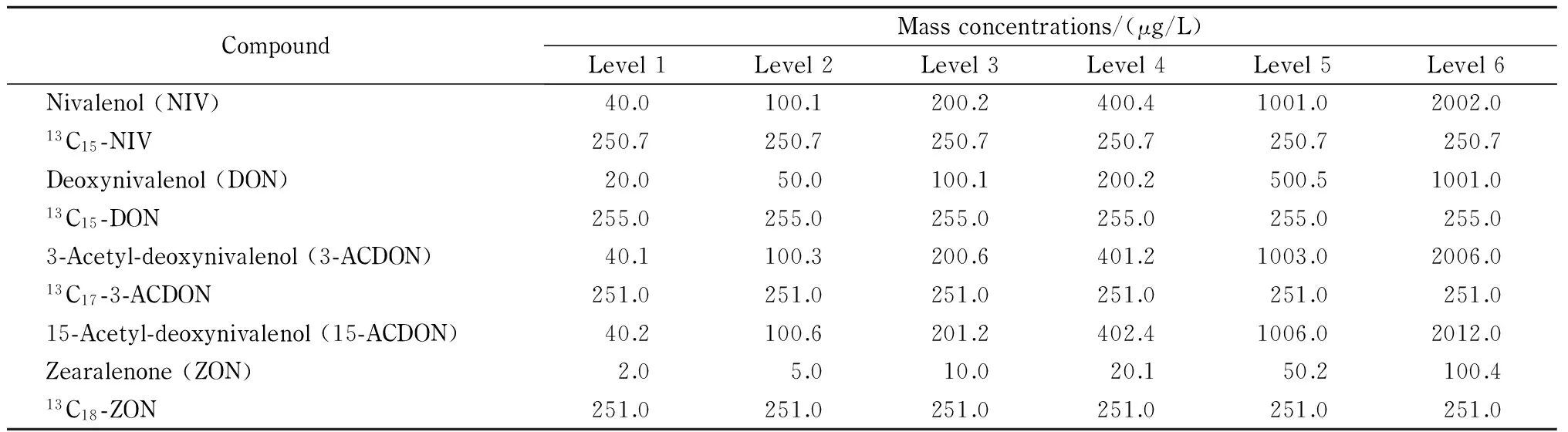
表 1 系列混合标准工作液中5种真菌毒素及对应同位素内标的质量浓度
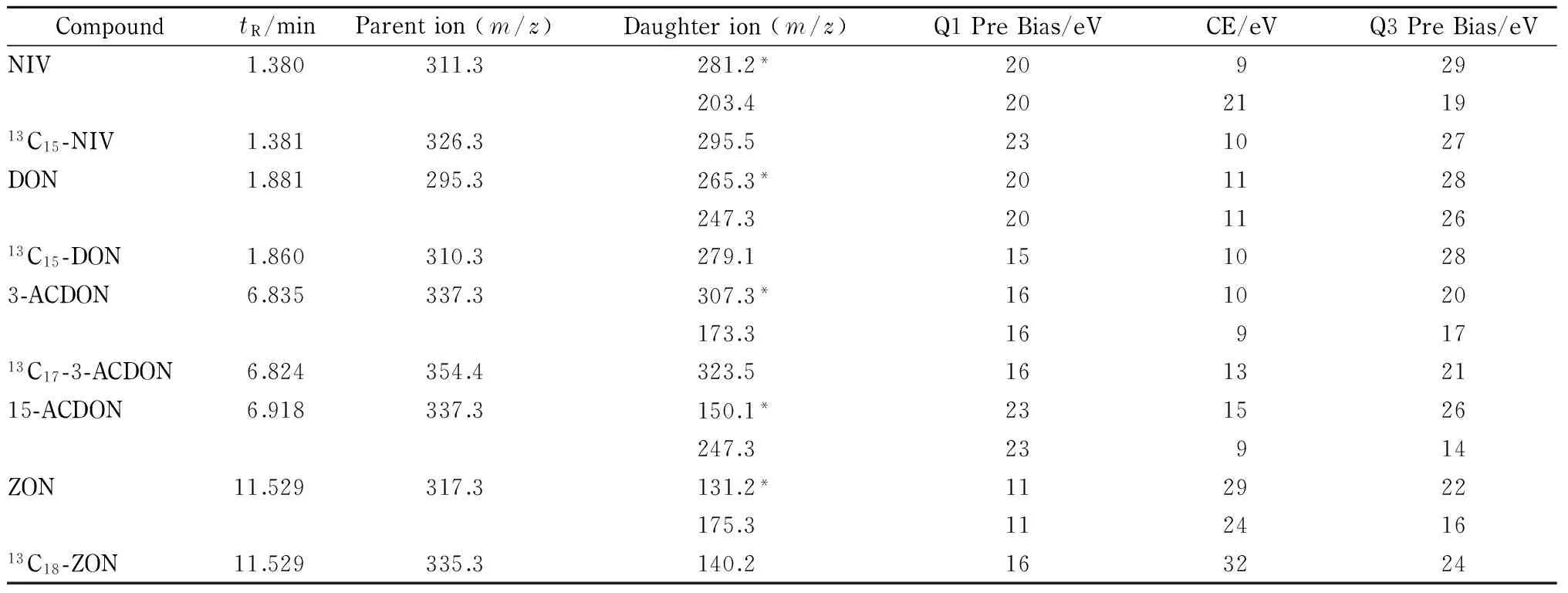
表 2 5种真菌毒素及其内标的保留时间(tR)、母离子、子离子和其他质谱参数
CE: collision energy; * quantitative ion.
1.3.2 啤酒样品
称取5 g(精确至0.001 g)啤酒样品于15 mL离心管中,超声15 min,加入200 μL混合内标工作液,用乙腈定容至10 mL,涡旋30 s,混匀,以5 000 r/min离心10 min,收集上清液至多功能净化柱中净化,收集净化液。移取5.0 mL净化液,于50 ℃氮气吹干,加入1.0 mL乙腈-水(50∶50, v/v)溶解残渣,涡旋混匀30 s,以15 000 r/min离心10 min,吸取上清液,过0.22 μm滤膜,上机测定。
1.3.3 空白样品
量取5 mL去离子水于15 mL离心管中,按1.3.2节所述进行前处理,过0.22 μm滤膜,上机测定。
1.4 LC-MS/MS条件
色谱柱:Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm);柱温:40 ℃;样品室温度:20 ℃;流动相:(A)水和(B)乙腈。梯度洗脱程序:0~9.0 min, 15%B; 9.0~9.3 min, 15%B~100%B; 9.3~11.3 min, 100%B, 11.3~11.4 min, 100%B~15%B; 11.4~14.8 min, 15%B。流速:0.3 mL/min;进样量:10 μL。
离子源:电喷雾离子(ESI)源;负离子模式;离子源电压:3.5 kV;扫描方式:多反应监测(MRM)模式;加热模块温度:400 ℃;脱溶剂管(DL)温度:250 ℃;雾化气流速:3.0 L/min;干燥气流速:15.0 L/min。5种真菌毒素的其他质谱参数见表2。
2 结果与讨论
2.1 前处理条件的优化
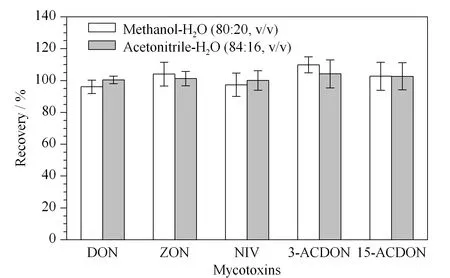
图 1 提取溶剂对空白加标小麦样品中5种真菌毒素回收率的影响(n=6)Fig. 1 Effect of extraction solvents on the recoveries of the five mycotoxins spiked in blank wheat samples (n=6)
粮谷类样品(小麦、大麦、玉米、燕麦等)中的真菌毒素通常使用乙腈、甲醇或二者分别与水混合的二元溶剂进行提取[22]。根据目标化合物的化学性质,本实验以向阴性小麦样品加标的方式考察了乙腈-水(84∶16, v/v)和甲醇-水(80∶20, v/v)对5种真菌毒素回收率的影响(见图1)。结果表明,二者的提取效果相当。但采用乙腈-水(84∶16, v/v)提取时,5种真菌毒素的色谱图中干扰物质更少,色谱峰更尖锐、对称。故实验选取乙腈-水(84∶16, v/v)作为提取溶剂。
根据文献[22]报道,针对真菌毒素的检测,粮谷类样品的净化方式多采用固相萃取柱和多功能净化柱,二者的净化效果相当。虽然固相萃取柱价格较低,但操作复杂、耗时,不适于日常大批量样品的检测。故本实验选择多功能净化柱进行净化。
2.2 LC-MS/MS条件的优化
2.2.1 流动相的选择
在LC-MS/MS分析中,流动相的选择既要考虑液相色谱的分离效果,又要兼顾待测组分的离子化效率,以便获得最佳的分辨率和灵敏度[22]。结合参考文献[23],本文比较了不同流动相体系(①乙腈-0.2%(v/v)氨水、②乙腈-0.1%(v/v)氨水、③甲醇-水和④乙腈-水)的分离效果。结果表明,氨水较易挥发,导致流动相体系不稳定,采用流动相①和②时,目标物的保留时间严重偏移;由于甲醇的黏度大,采用流动相③时,会导致系统内压较高。因此,基于流动相的稳定性、色谱响应强度、色谱体系压力等因素,最终选择乙腈-水作为流动相。在1.4节条件下,除3-ACDON和15-ACDON共流出,分离度未达到1.5外,其他化合物均能达到基线分离。5种真菌毒素及其内标的提取离子色谱图见图2。
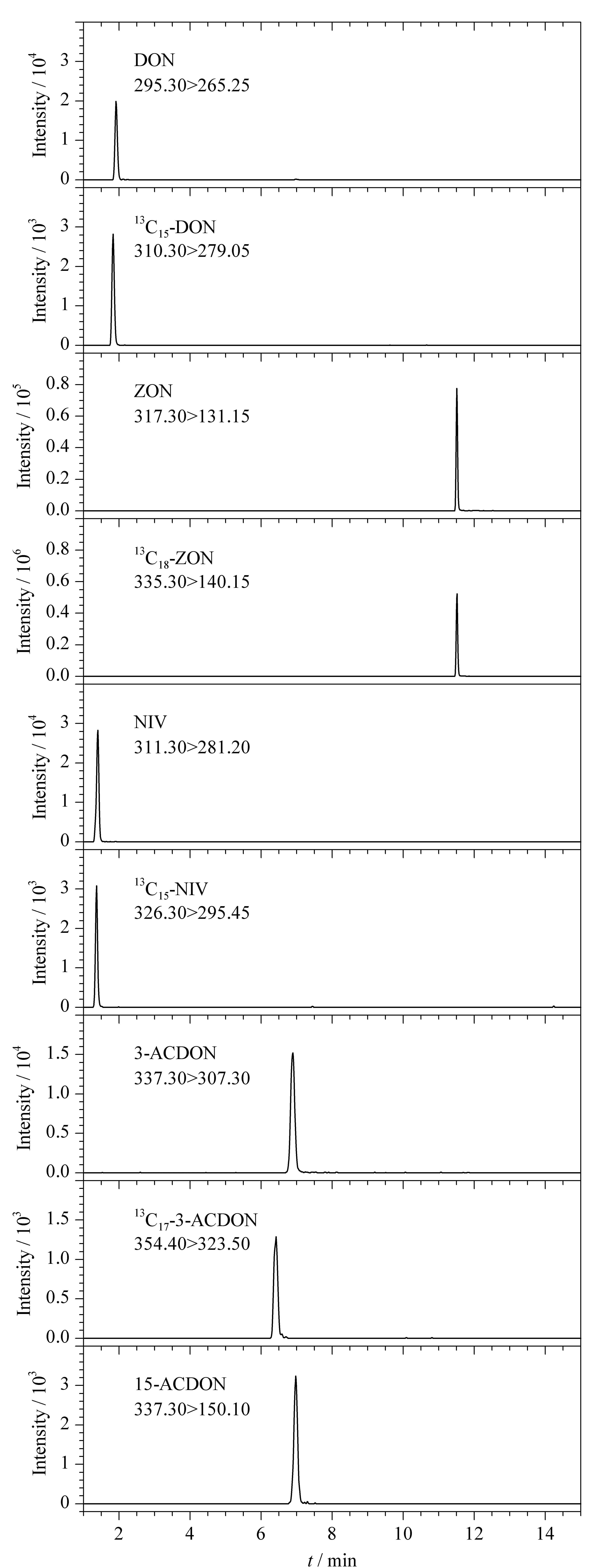
图 2 混合标准工作液中5种真菌毒素(50 μg/L)及其内标(250 μg/L)的选择离子色谱图 Fig. 2 Selected ion chromatograms of the five mycotoxins(50 μg/L) and their internal standards (250 μg/L) in a mixed standard solution Mobile phases: water-acetonitrile; gradient elution: 0-9.0 min, 15%B, 9.0-9.3 min, 15%B-100%B, 9.3-11.3 min, 100%B, 11.3-11.4 min, 100%B-15%B, 11.4-14.8 min, 15%B.
2.2.2 定性、定量离子的选择
同时考察5种真菌毒素在正、负离子模式下的响应强度,发现所有目标物在负离子模式下均有良好响应。在负离子模式下,将各自的标准溶液分别以流动注射的方式进行全扫描,确定目标化合物的准分子离子。然后分别以各自的分子离子作为母离子,进行二级质谱全扫描,选择干扰小、特征性强的子离子作为定性离子,选择相对丰度高、稳定性强的子离子作为定量离子。
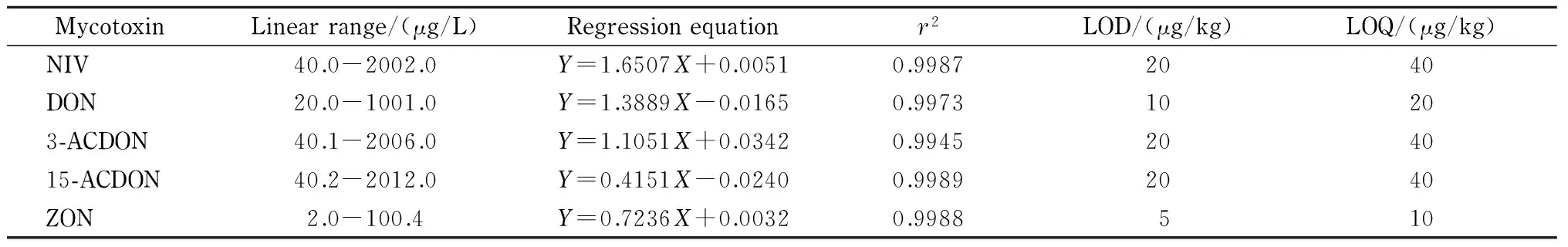
表 4 5种真菌毒素的线性范围、回归方程、相关系数、检出限及定量限
Y: peak area;X: mass concentration, μg/L.
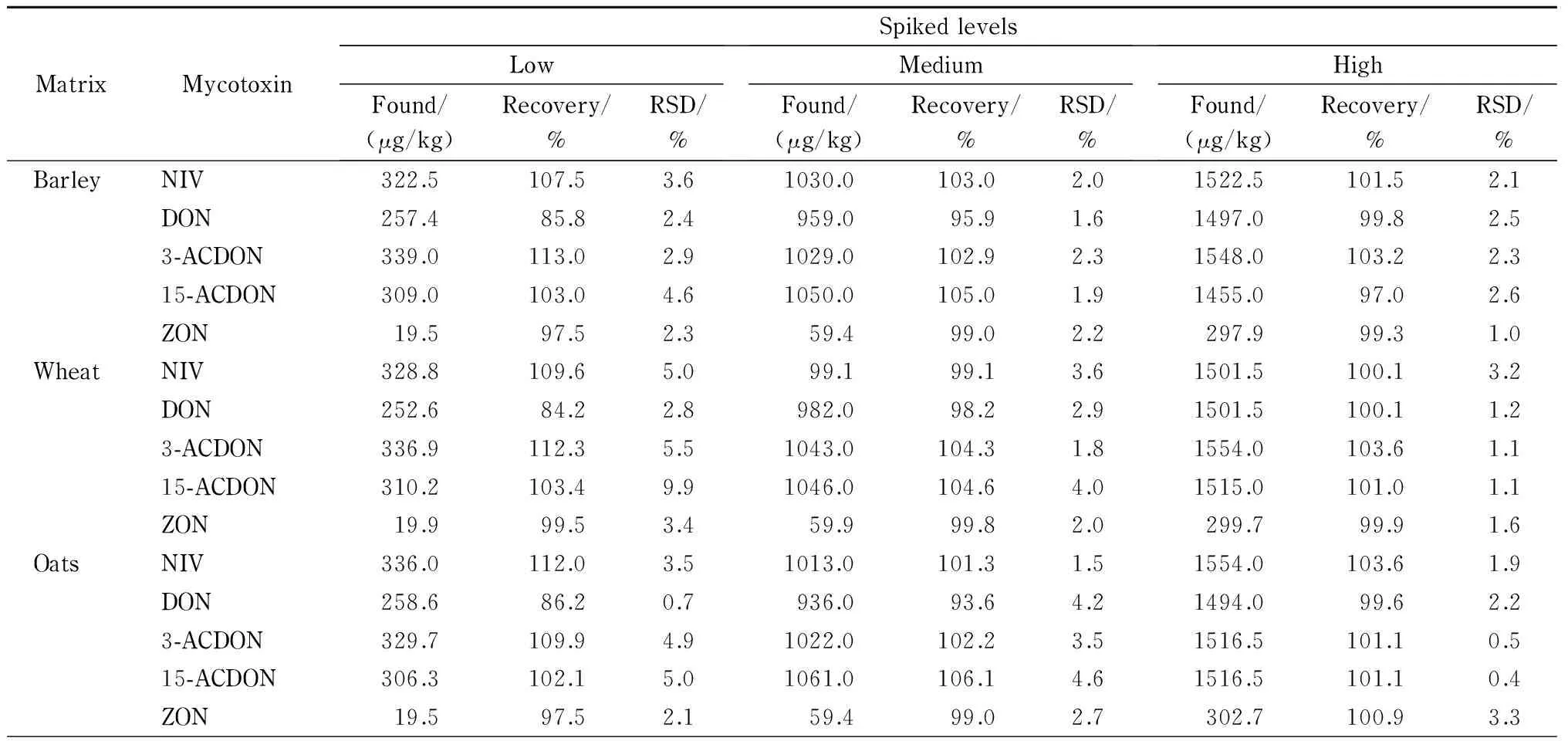
表 5 5种真菌毒素在9种空白粮食及其制品中的加标回收率和相对标准偏差(n=6)
2.3 方法学验证
2.3.1 定性分析
采用同位素内标-液相色谱-串联质谱法对样品进行定性分析。在相同的实验条件下,样品中应呈现定量离子对和定性离子对的色谱峰,且被测物质与标准物质的保留时间一致;所选择监测离子对与含量相当的标准溶液中离子对的相对丰度比的偏差不超过GB 5009.240-2016中规定的范围(见表3),则可判断样品中存在对应的目标物质。

表 3 定性分析时相对离子丰度的最大允许偏差
2.3.2 线性范围、检出限与定量限
对1.2节配制的系列混合标准工作液进行分析,以目标分析物峰面积与对应内标峰面积的比值为纵坐标(Y)、相应目标分析物的质量浓度为横坐标(X, μg/L)绘制标准曲线,其线性范围、回归方程和相关系数(r2)见表4。结果表明,5种真菌毒素在各自的线性范围内呈良好的线性关系,r2均大于0.99。因市面暂无15-ACDON的同位素内标,故本实验采用13C17-3-ACDON作为15-ACDON的同位素内标进行定量。
以定性离子通道中信噪比(S/N)为3和定量离子通道中S/N为10计算各真菌毒素的检出限(LOD)和定量限(LOQ),结果见表4。DON、ZON、3-ACDON和15-ACDON均符合国家标准及行业标准[14-18,24]对真菌毒素限量检测的要求,NIV亦有较低的定量限,可满足日常检测需求。
2.3.3 回收率和精密度
分别取9种代表性粮食及其制品样品适量,添加20、60、300 μg/kg水平的ZON标准溶液和300、1 000、1 500 μg/kg水平的其余4种真菌毒素的标准溶液,每个水平进行6次平行测定,得到的加标回收率见表5。结果表明,5种真菌毒素的平均加标回收率为84.2%~114.5%,RSD为0.4%~9.9%。
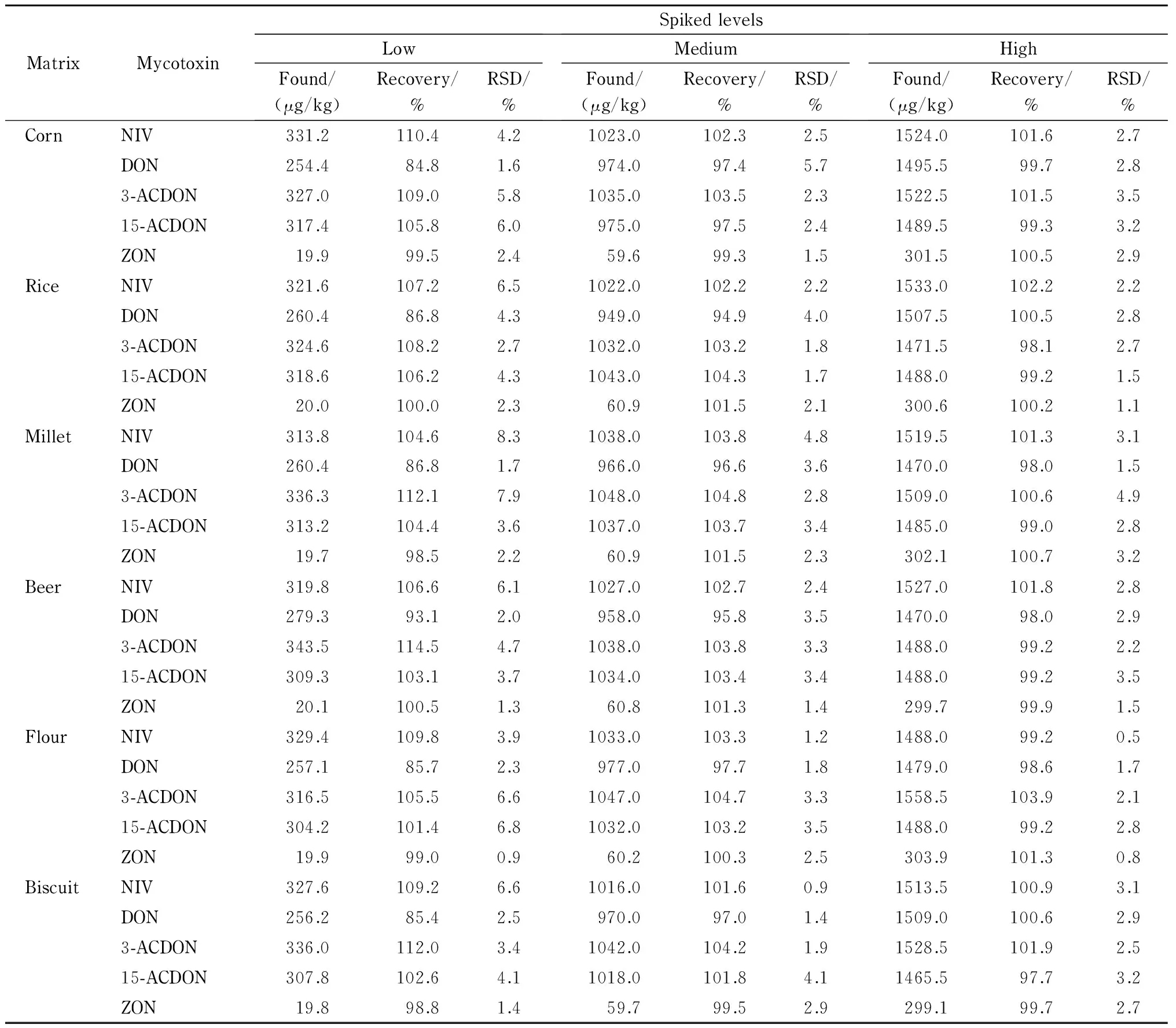
表 5 (续)
The low, medium, high spiked levels for NIV, DON, 3-ACDON, 15-ACDON were 300, 1000, 1500 μg/kg, respectively. The low, medium, high spiked levels for ZON were 20, 60, 300 μg/kg, respectively.
2.4 与其他方法比较
除NIV外(暂无检测标准), 通过测定已知含量的阳性对照品(DON、ZON)或采用现有的标准方法(3-ACDON和15-ACDON)与本方法的实验结果进行比较,具体结果见表6。可以看出,本方法的测定结果与标准值接近,验证结果令人满意。
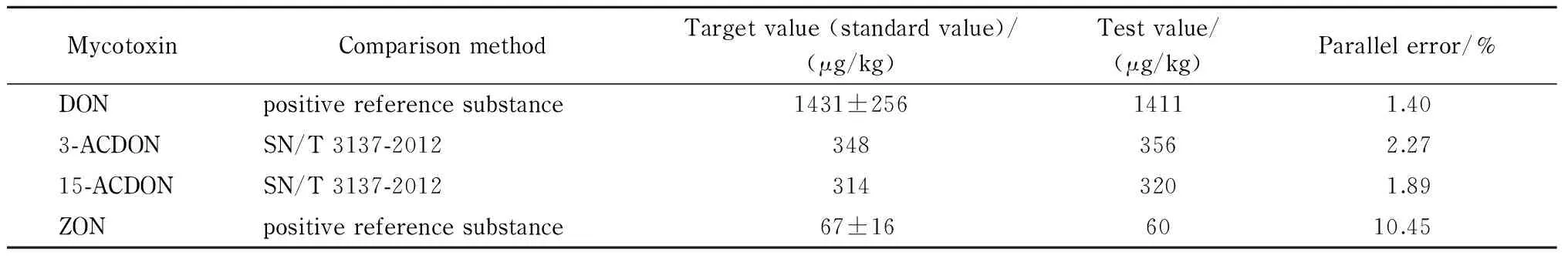
表 6 本方法与其他方法测定结果的比较
3 结论
本文采用快速便捷的多功能净化柱对样品进行前处理,同时建立了同位素内标-液相色谱-串联质谱同时测定粮食及其制品中5种常见真菌毒素的分析方法。该方法前处理操作简单快速,灵敏度高,准确性高,检出限低,能够满足实验室日常大批量样品的检测需求。
[1] Yu L, Li P W, Zhang Q, et al. Journal of Instrumental Analysis, 2015, 34(10): 1204
喻理, 李培武, 张奇, 等. 分析测试学报, 2015, 34(10): 1204
[2] Dong M J, Yang Q Y, Sun W, et al. Food Science, 2016, 37(1): 230
董曼佳, 杨其亚, 孙伟, 等. 食品科学, 2016, 37(1): 230
[3] Zhou Y T, Ren J L, Zhang Z Y, et al. Journal of Food Safety and Quality, 2016, 7(1): 244
周玉庭, 任佳丽, 张紫莺, 等. 食品安全质量检测学报, 2016, 7(1): 244
[4] Zhang Y B, Bao L, Chu Q H. Beijing: Chemical Industry Press, 2006: 13
张艺兵, 鲍蕾, 褚庆华. 北京: 化学工业出版社, 2006: 13
[5] Pitt J I. Brit Med Bull, 2000, 56(1): 184
[6] Kotal F, Radova Z. Czech J Food Sci, 2002, 20(2): 63
[7] Gao F, Du Y Z, Lu J. Beer Science and Technology, 2012(10): 57
高飞, 杜元正, 陆健. 啤酒科技, 2012(10): 57
[8] Scudamore K A, Hazel C M, Patel S, et al. Food Addit Contam A, 2009, 26(8): 1191
[9] Flores-Flores M E, Lizarraga E, de Cerain A L, et al. Food Control, 2015, 53: 163
[10] Sypecka Z, Kelly M, Brereton P. J Agric Food Chem, 2004, 52(17): 5463
[11] Pierron A, Mimoun S, Murate L S, et al. Arch Toxicol, 2016, 90(8): 2037
[12] Le Hegarat L, Takakura N, Simar S, et al. Efsa Supporting Publication, 2014, 11(11): EN-697
[13] Bai Y Z, Li P W, Ding X X, et al. Quality and Safety of Agro-Products, 2015(5): 54
白艺珍, 李培武, 丁小霞, 等. 农产品质量与安全, 2015(5): 54
[14] GB/T 5009.111-2003
[15] GB/T 19540-2004
[16] GB/T 23503-2009
[17] GB/T 23504-2009
[18] GB/T 28716-2012
[19] Ge B K, Zhao K X, Wang W, et al. Chinese Journal of Chromatography, 2011, 29(6): 495
葛宝坤, 赵孔祥, 王伟, 等. 色谱, 2011, 29(6): 495
[20] Hu W Y, Xu L, Yang J, et al. Chinese Journal of Chromatography, 2014, 32(2): 133
胡文彦, 许磊, 杨军, 等. 色谱, 2014, 32(2): 133
[21] SN/T 2534-2010
[22] Huang J, Chen G S, Zhang X Y, et al. Chinese Journal of Chromatography, 2012, 30(11): 1203
黄娟, 陈国松, 张晓燕, 等. 色谱, 2012, 30(11): 1203
[23] Cui Y, Li Q, Liu S J, et al. Chinese Journal of Public Health Engineering, 2014, 13(1): 46
崔勇, 李青, 刘思洁, 等. 中国卫生工程学, 2014, 13(1): 46
[24] SN/T 1571-2005
Simultaneous determination of five mycotoxins in various grains and their products by liquid chromatography-tandem mass spectrometry with isotope internal standard
GAO Bei, JIANG Deming, YANG Yongtan*
(ChineseOil&FoodstuffsCorporation(COFCO)NutritionandHealthResearchInstitute,BeijingKeyLaboratoryofNutritionHealthandFoodSafety,Beijing102209,China)
A rapid method was established for the determination of zearalenone (ZON), nivalenol (NIV), deoxynivalenol (DON), 3-acetyl-deoxynivalenol (3-ACDON) and 15-acetyl-deoxynivalenol (15-ACDON) in various grains and their products by liquid chromatography-tandem mass spectrometry (LC-MS/MS). The samples were extracted by acetonitrile-water (84∶16, v/v), and cleaned-up by multifunctional column without any further step. The separation was carried out on an Acquity UPLC®BEH C18 column (100 mm×2.1 mm, 1.7 μm) with gradient elution using acetonitrile-water as mobile phases. The analytes were quantified by isotope internal standard method. The correlation coefficients (r2) were all above 0.99. The limits of detection (LODs,S/N=3) ranged from 5 μg/kg to 20 μg/kg. The recoveries of the five mycotoxins spiked in blank grain and its product samples varied from 84.2% to 114.5%, with the relative standard deviations (RSDs) of 0.4%-9.9% (n=6). The method is accurate, efficient, sensitive and practical.
liquid chromatography-tandem mass spectrometry (LC-MS/MS); isotope internal standard; mycotoxins; grains and their products
10.3724/SP.J.1123.2016.12028
2016-12-23
O658
A
1000-8713(2017)06-0601-07
* 通讯联系人.E-mail:yangyongtan@cofco.com.
