模板法制备大孔硅胶微球及其在高效液相色谱蛋白质分离中的应用
2017-06-15牛梦娜马红彦王世革常海洲黄明贤
牛梦娜, 马红彦, 胡 飞, 王世革, 刘 璐, 常海洲, 黄明贤
(上海理工大学理学院化学系, 上海 200093)
研究论文
模板法制备大孔硅胶微球及其在高效液相色谱蛋白质分离中的应用
牛梦娜, 马红彦, 胡 飞, 王世革, 刘 璐, 常海洲, 黄明贤*
(上海理工大学理学院化学系, 上海 200093)
以弱阳离子交换聚合物微球(WCX)为模板、N-三甲氧基硅基丙基-N,N,N-三甲基氯化铵(TMSPTMA)为结构导向剂、四乙氧基硅烷(TEOS)为硅胶前驱体,在三乙醇胺弱碱催化作用下,水解缩合形成有机聚合物与二氧化硅复合微球,将此复合微球煅烧后得到大孔二氧化硅微球。探索了不同反应条件对二氧化硅微球的形貌、表面结构和分散性的影响;当TMSPTMA、TEOS与三乙醇胺的体积比为1∶2∶2时可以得到孔径在50~150 nm之间、粒径在2 μm左右的硅胶微球。对所制备的大孔硅胶微球表面进行C18(十八烷基二甲基氯硅烷)键合修饰,然后将键合的填料装填到50 mm×4.6 mm的色谱柱中,考察了其对常见的几种标准蛋白质和市售大豆分离蛋白质的分离效果,结果显示这种填料在高效液相色谱蛋白质分离中具有一定的潜力。
模板法;结构导向剂;大孔二氧化硅微球;高效液相色谱;蛋白质分离
高效液相色谱(HPLC)已发展成为生物医学、化学化工、食品卫生、环境保护等领域中最常用的分离分析手段之一。色谱柱和色谱柱填料常常被认为是HPLC的核心,它决定着色谱分析分离的最终效果。以硅胶为基质的固定相是目前应用最为广泛的高效液相色谱填料[1-3]。这主要是因为硅胶具有良好的机械强度,稳定的形貌、孔结构和比表面积,以及其表面含有丰富的硅羟基可以很容易地进行表面化学键合和修饰等特点。硅胶的粒径大小、孔径分布、比表面积等是影响HPLC分离效果的重要因素;色谱填料的孔径尤其会影响色谱填料对不同大小分子的分离性能。近年来,高压液相色谱填料的发展主要集中在5 μm以下甚至亚微米(1.5~2 μm)级多孔[4-8]和核壳结构硅胶微球[9-11]以及毛细管整体柱[12,13]等方面,这些色谱填料在生物大分子的分离分析方面由于其快速和高效的特点而受到青睐。使用小粒径填料和较长的毛细管柱可以极大地提高色谱柱对多肽分子和蛋白质的峰容量[14,15]。整体柱由于其通透性好以及传质速率快等优点而在蛋白质组学中的应用备受关注[16,17]。大孔核壳结构硅胶微球用于蛋白质分离既有传质速率快的优点又避免了小粒径填料柱压过大的问题[18]。粒度为1~3 μm的无孔硅胶填料可用于快速分析生物大分子[19-22];这类固定相由于表面无孔,消除了溶质在固定相上的滞留流动,因而分离速率明显加快;但它的不足之处在于柱容量较小。一般来讲,针对蛋白质、核酸等生物大分子的分离,在填料设计上除了采用上述最新发展的某些策略外,还应该使其具有较大的孔径[23,24],使这些生物大分子容易扩散到孔内与其中的固定相发生作用,达到较高的分离度。另外,目前常用的用于蛋白质分析的高效凝胶渗透色谱(SEC)填料主要是基于大孔硅胶[25,26]。鉴于此,本研究着力探索制备2 μm左右大孔二氧化硅(SiO2)微球的有效方法,以满足日益增长的生物医药大分子高效液相色谱分离分析的需求。
模板法在合成形貌可控的无机材料方面具有非常广泛的应用。在合成介孔二氧化硅材料领域,使用的模板主要有离子型表面活性剂[27-30]、非离子型表面活性剂[31,32]、有机聚合物微球[33,34]等。模板法结合不同的结构导向剂,将无机氧化物前驱体引入模板内进行水解聚合等反应可以形成结构可控的无机材料。用模板法制备的有机无机复合材料通过不同的方法除去模板剂,保留无机骨架,可得到不同孔结构的无机材料。Meyer等[35]用经过亲水改性的多孔聚苯乙烯-二乙烯苯微球做模板合成了二氧化钛和二氧化硅微球。He等[36]以乙二胺修饰的聚甲基丙烯酸酯微球[poly(glycidyl methacrylate-ethylene glycol dimethacrylate) (PGMA-EDMA)]作模板,利用在四正丁基溴化铵作用下产生的硅溶胶反应,制备了直径为6~7 μm的单分散多孔硅胶微球,所得硅胶微球基本保持了原来聚合物微球的尺寸。最近,Xia等[37]对He等[36]的方法进行了一些修改,他们用四乙烯五胺代替乙二胺,得到较大孔(52 nm)硅胶微球,并且在十八烷基二甲基氯硅烷 (C18)键合修饰后得到了较好的蛋白质分离效果。
上述工作所采用的模板微球都是大孔微球,这样形成的硅胶微球反而具有较小的孔径和较大的粒径。在本工作中,我们采用了高交联度的弱阳离子交换聚甲基丙烯酸酯类微球,这种微球几乎是无孔的,但是仍然可以溶解有机物并存在一定程度的溶胀。同时,这种微球含大量羧基基团,可以利用带正电的硅烷与模板微球中羧基的静电吸附,从而使其更容易渗透到模板微球内部,同时有助于引入四乙氧基硅烷,通过水解和缩合等硅溶胶反应制备聚合物与硅胶的复合微球。在这些复合微球的煅烧过程中由于硅胶骨架网络的塌陷和缩聚,会形成比原来聚合物模板粒径小很多的大孔硅胶微球。在新制备的硅胶微球表面键合C18后,通过考察其对蛋白质的分离效果来评价其在高效液相色谱上的适用性。
1 实验部分
1.1 材料与设备
弱阳离子交换聚合物微球(WCX)购自郑州英诺生物科技有限公司。甲基三乙氧基硅烷(99%)和Pluronic F127(美国Sigma-Aldrich公司);四乙氧基硅烷(TEOS, 纯度>99%)、三乙醇胺(分析纯)和异丙醇(分析纯)购自上海阿拉丁生化科技股份有限公司;甲苯、盐酸、咪唑、三氯甲烷、乙醇、氨水、十二烷基三甲基溴化铵、四甲基氯化铵、三乙胺(以上均为分析纯)、四甲基氢氧化铵(25%,质量分数)和十六烷基三甲基氯化铵(化学纯)购自国药集团化学试剂有限公司;N-三甲氧基硅基丙基-N,N,N-三甲基氯化铵(TMSPTMA, 50%,甲醇溶液)和C18购自美国Gelest公司。
P230II高压恒流泵,UV230II紫外-可见检测器,EC2006色谱数据处理工作站(大连依利特分析仪器有限公司);VEGA3扫描电子显微镜(SEM) (泰思肯贸易上海有限公司), SBC-12离子溅射仪(北京中科仪器股份有限公司), TGA-50热重分析仪(日本岛津公司), ASAP 2460孔径分析仪(上海麦克默瑞提克仪器有限公司), 50 mm×4.6 mm色谱柱管和液相色谱装柱机(深圳正大流体机电设备有限公司), KSL箱式高温烧结炉(合肥科晶材料技术有限公司), KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司),高速台式离心机(德国NUAIRE公司)。
1.2 实验方法
1.2.1 大孔二氧化硅微球的制备
在500 mL三角瓶中,加入15 g WCX、12.5 mL TMSPTMA、25 mL三乙醇胺、200 mL去离子水和125 mL乙醇,超声1 h;然后放入恒温水浴锅中于30 ℃磁力搅拌10 min,之后,在搅拌状态下用滴液漏斗逐滴加入25 mL TEOS和75 mL乙醇的混合溶液,控制滴加速度,于30 min内滴加完毕,继续搅拌24 h;反应完毕后,取出三角瓶,静置,待颗粒自然沉降后,过滤除去清液,并用乙醇离心洗涤固体颗粒3次,80 ℃干燥12 h后在空气气氛中以1 ℃/min的升温速率升温到600 ℃,并维持在600 ℃煅烧10 h。
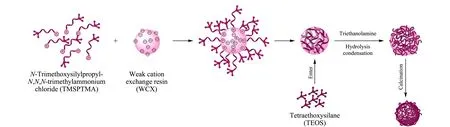
图 1 大孔二氧化硅微球的制备过程示意图Fig. 1 Schematic diagram of the synthesis of large-pore silica microspheres
1.2.2 表面键合
取2 g所得SiO2微球,用1 mol/L盐酸浸泡搅拌2 h,并分别用水和乙醇离心洗去盐酸,于80 ℃干燥;称取酸化并干燥的SiO2微球1.5 g,研磨后置于250 mL三颈圆底烧瓶中,并加入100 mL干燥甲苯,于油浴锅中磁力搅拌,升温至120 ℃使甲苯回流10 min除水,然后加入0.6 g咪唑,搅拌10 min后用滴液漏斗在15 min内加入1.3 g C18和50 mL甲苯的混合溶液,继续回流搅拌悬浮液8 h。冷却至室温,待沉降后,过滤除去清液,加入150 mL新鲜甲苯洗涤固体颗粒,再用甲醇,甲醇/水混合液和乙醇分别离心洗涤。最后,于60 ℃真空干燥12 h,得到键合C18的硅胶固定相。
1.2.3 装柱及测试
配制体积比为1∶1的异丙醇和三氯甲烷的混合液200 mL,作为匀浆液备用;取上述键合好的硅胶1.2 g,加入适量匀浆液,超声3 min,然后在液压为3.45×107Pa下装入50 mm×4.6 mm色谱柱中,并进行蛋白质的分离测试。
标准蛋白质的色谱分离条件:流动相A相为90%水-10%乙腈-0.1%三氟乙酸(均为体积分数);B相为90%乙腈-10%水-0.1%三氟乙酸(均为体积分数);流速为0.8 mL/min;检测波长为220 nm;梯度洗脱程序:0~15.0 min, 5%B~65%B; 15.0~30.0 min,65%B。
大豆分离蛋白的色谱分离条件:流动相A相为90%水-10%乙腈-0.1%三氟乙酸(均为体积分数);B相为90%乙腈-10%水-0.1%三氟乙酸(均为体积分数);流速为0.6 mL/min;检测波长为280 nm;梯度洗脱程序:0~20.0 min, 0~70%B; 20.0~30.0 min,70%B。把市售大豆蛋白粉与流动相A按1∶1(质量比)混合,超声5 min,用0.45 μm亲水过滤膜(针头注射器)滤出清液,进样分析。
2 结果与讨论
2.1 大孔硅胶微球的制备过程和反应机理
本研究制备的大孔二氧化硅微球的形成过程见图1。以弱阳离子交换聚合物微球为模板,TMSPTMA为结构导向剂,TEOS为硅胶前驱体,在三乙醇胺弱碱催化作用下,水解缩合形成有机聚合物与二氧化硅的复合微球,然后通过煅烧得到大孔二氧化硅微球。

图 2 微球的扫描电子显微镜(SEM)照片Fig. 2 Scanning electron microscopy (SEM) images of microspheres a. templating polymer microspheres (WCX); b. polymer/silica hybrid microspheres before calcination; c. calcination under N2 at 400 ℃; d. calcination under air at 600 ℃.
本文所使用的WCX模板的形貌如图2a所示,可以看出,这些模板微球虽然表面有些塌陷,但基本是无孔的。所形成的聚合物-二氧化硅杂化微球煅烧之前的形貌如图2b所示,与原来WCX微球比较,复合微球体积增大并且表面变得粗糙。图2c是复合微球在氮气保护下400 ℃煅烧后的结果,此时有机聚合物经过碳化和硅胶骨架塌陷,颗粒粒径缩小,表面出现皱褶结构,微球呈现黑色。当在空气气氛中煅烧温度为600 ℃时(见图2d),微球进一步缩小,并呈现白色,说明有机聚合物都已经去除。
以TMSPTMA作为结构导向剂,分子一端带正电,可以与聚合微球中的羧基阴离子通过静电引力结合,进入有机聚合物内部;另一端有三甲氧基硅基,水解后形成硅羟基,可以与进入微球内的TEOS在水解后产生相互缩聚反应,形成聚合物与二氧化硅的复合微球。图3为所涉及的化学反应方程。
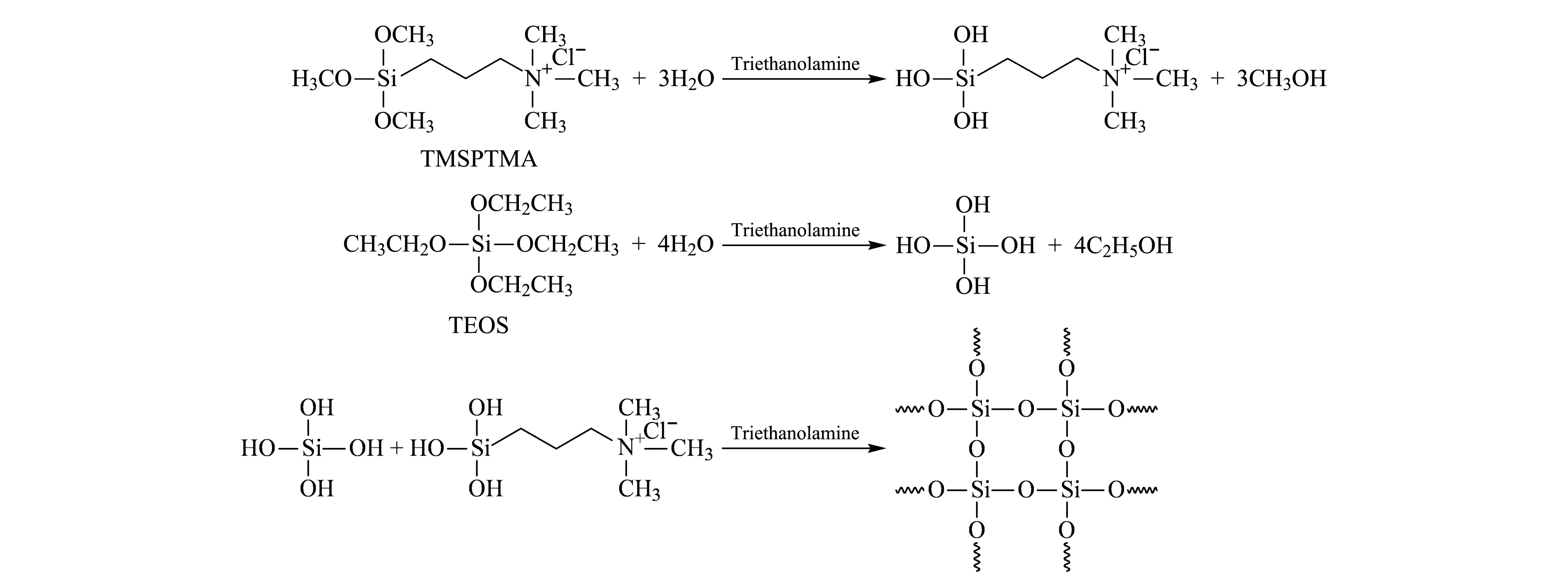
图 3 制备中所涉及的反应方程Fig. 3 Chemical equations in the synthesis
2.2 大孔硅胶微球的制备及条件优化
首先,我们考察了不同碱性催化剂的影响,图4为所得到的硅胶产物的SEM照片,各硅胶产物所对应的碱性催化剂如下:A1,三乙胺;A2,四甲基氢氧化铵;A3,氨水;其他(B1、B2、B3、C1和C2),三乙醇胺。从图4可以看出,只有三乙醇胺作催化剂才能形成均匀的硅胶微球。使用其他几种催化剂时均生成多种纳米级的细小颗粒,这些纳米颗粒的一部分附着于已经形成的相对较大的颗粒上,使得样品黏结在一起,不利于微米级二氧化硅成球。据文献[38,39]报道,三乙醇胺会与硅羟基作用,限制硅羟基之间的缩合反应,降低其反应速率,有利于均匀球形结构的形成。
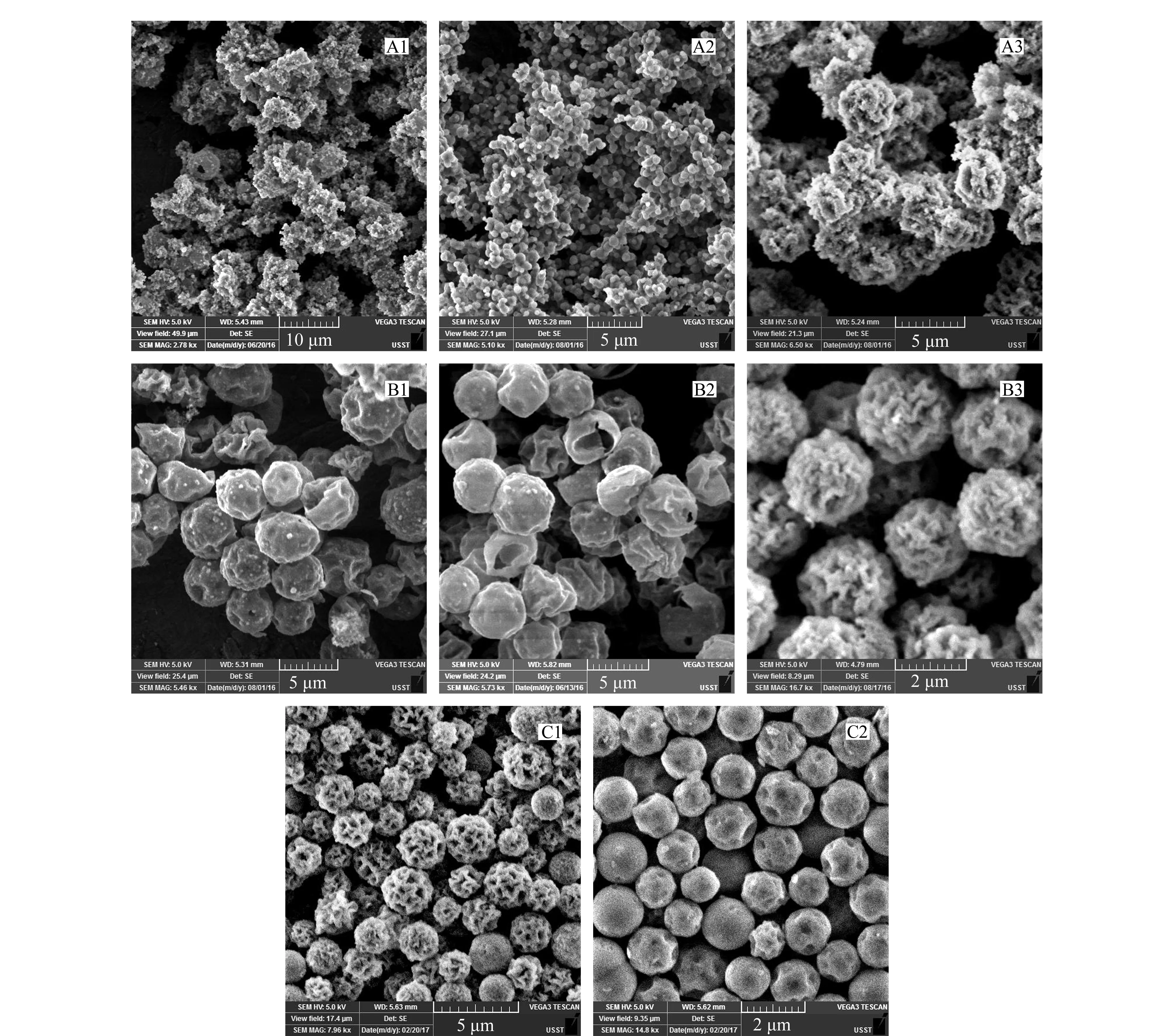
图 4 合成的硅胶产物的SEM照片Fig. 4 SEM images of the products of synthesis Base catalysts: A1, trimethylamine; A2, tetramethylammonium hydroxide; A3, NH35H2O; B1, B2, B3, C1 and C2, triethanolamine. Structure directing agents: A1, A2, A3, C1, C2 and B3, TMSPTMA; B1, TMAC and DTAB; B2, F127 and CTAC. Silica precursors: A1, A2, A3, B1, B2, B3 and C1, TEOS; C2, methyltriethoxysilane (MTEOS).
其次,我们考察了不同结构导向剂的影响。B1所用的结构导向剂为四甲基氯化铵(TMAC)和十二烷基三甲基溴化铵(DTAB)的混合表面活性剂,B2是F127和十六烷基三甲基氯化铵(CTAC)的混合表面活性剂;B3为TMSPTMA。B1、B2使用了体积较大的阳离子表面活性剂分子,其结果都是产生壳层结构。可能有两种解释:一种是由于F127、 DTAB和CTAC等分子疏水链较长,不容易进入聚合物内部,导致其在聚合物表面形成硅胶涂覆层;另一种是阳离子表面活性剂在溶液里形成胶束,TEOS水解产物在胶束中共同缩聚,然后吸附到WCX表面,因此只能在表面形成壳层结构的硅球。而TMSPTMA本身带正电且分子较小,可以进入WCX内部,与其中的羧基作用的同时,形成二氧化硅骨架;这样更有利于TEOS及其水解产物进入到聚合物微球内部,进一步在其内部和表面缩聚形成聚合物-硅胶复合微球。
最后,我们考察了不同硅胶前驱体的影响。C1为TEOS, C2为甲基三乙氧基硅烷(MTEOS)。从图4可以看出,使用MTEOS得到的硅胶微球分散性好,所得颗粒表面较光滑;而使用TEOS所得的硅胶微球有较深的表面皱褶和大孔结构。我们推测四乙氧基硅烷形成刚性硅胶骨架,煅烧时原位塌陷使其表面出现皱褶结构。甲基三乙氧基硅烷形成较柔性骨架,加热过程中不断收缩,最终形成比较致密的结构而使其表面比较光滑。我们通过孔径分析仪测定C1硅胶的孔径,没有发现明显的孔径峰值,只是在50~150nm区间有一个鼓包,说明其孔径分布不规则。另外,测得的BET比表面积为230 m2/g。
对实验条件进行进一步的优化后发现:当TMSPTMA作为结构导向剂,TEOS作为硅胶前驱体,三乙醇胺作为催化剂,并且控制他们之间的体积比为1∶2∶2时,可以重复得到均匀、大孔、2 μm左右的硅胶微球。
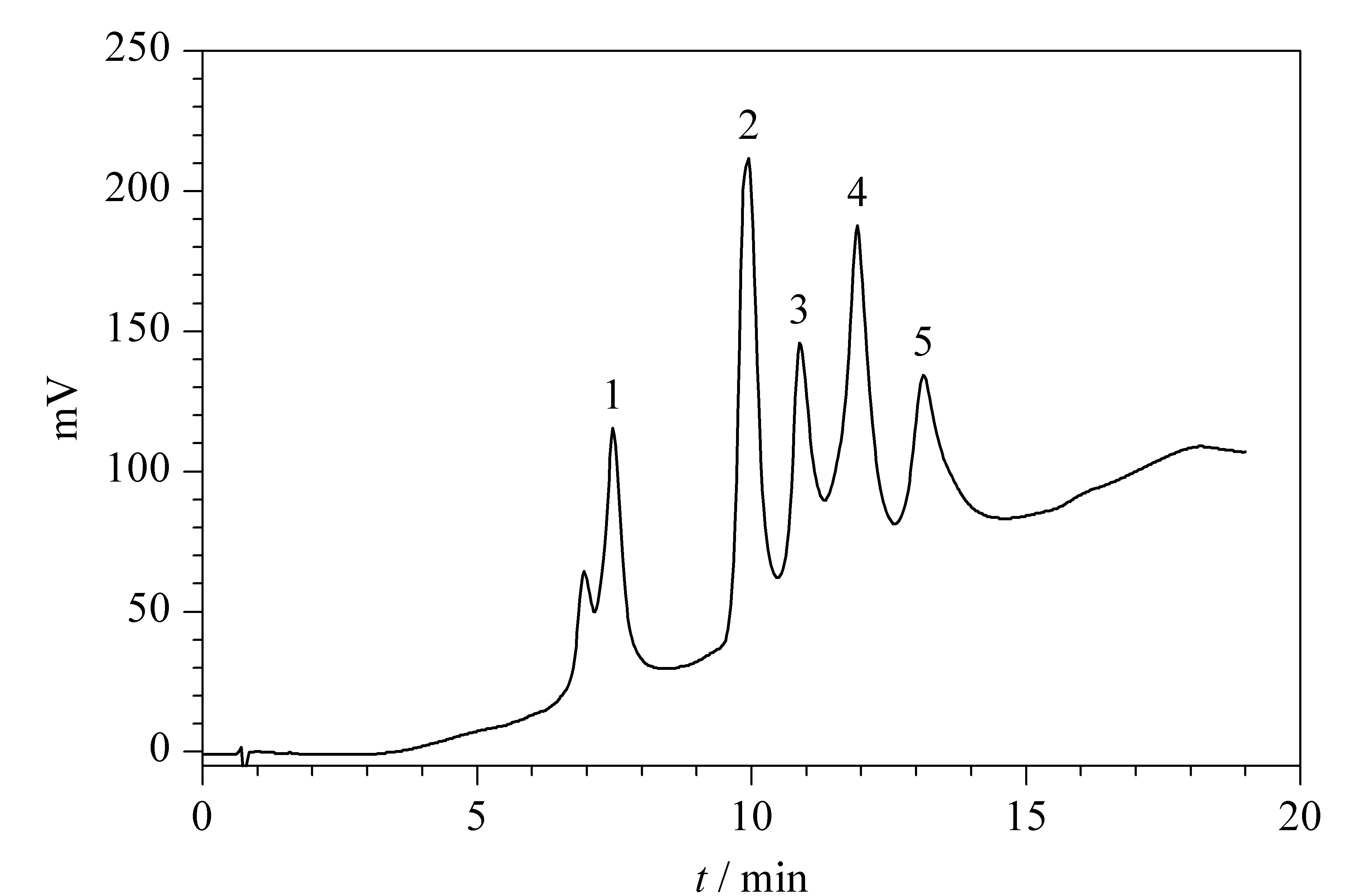
图 5 标准蛋白质的色谱图Fig. 5 Chromatogram of a standard protein mixture 1. trypsin inhibitor; 2. insulin; 3. cytochrome c; 4. lysozyme; 5. α-lactalbumin.
2.3 大孔硅胶微球的色谱性能评价
本研究的目标是制备2 μm左右的大孔硅胶微球,用于高效液相色谱蛋白质的分离。图5是几种标准蛋白质的色谱图,可以看出所合成的硅胶微球经C18表面键合修饰后,可以高效分离蛋白质。需要指出的是本方法所制备的液相色谱填料为表面多皱褶,属于大孔深孔型,并且孔径分布不规则,这些孔在一定程度上会产生涡流扩散项和溶质的滞留效应,对色谱柱的柱效产生不利影响;但对于大分子化合物的分离,这些效应有所减缓,并且大孔对大分子化合物的渗透具有一定的优势。
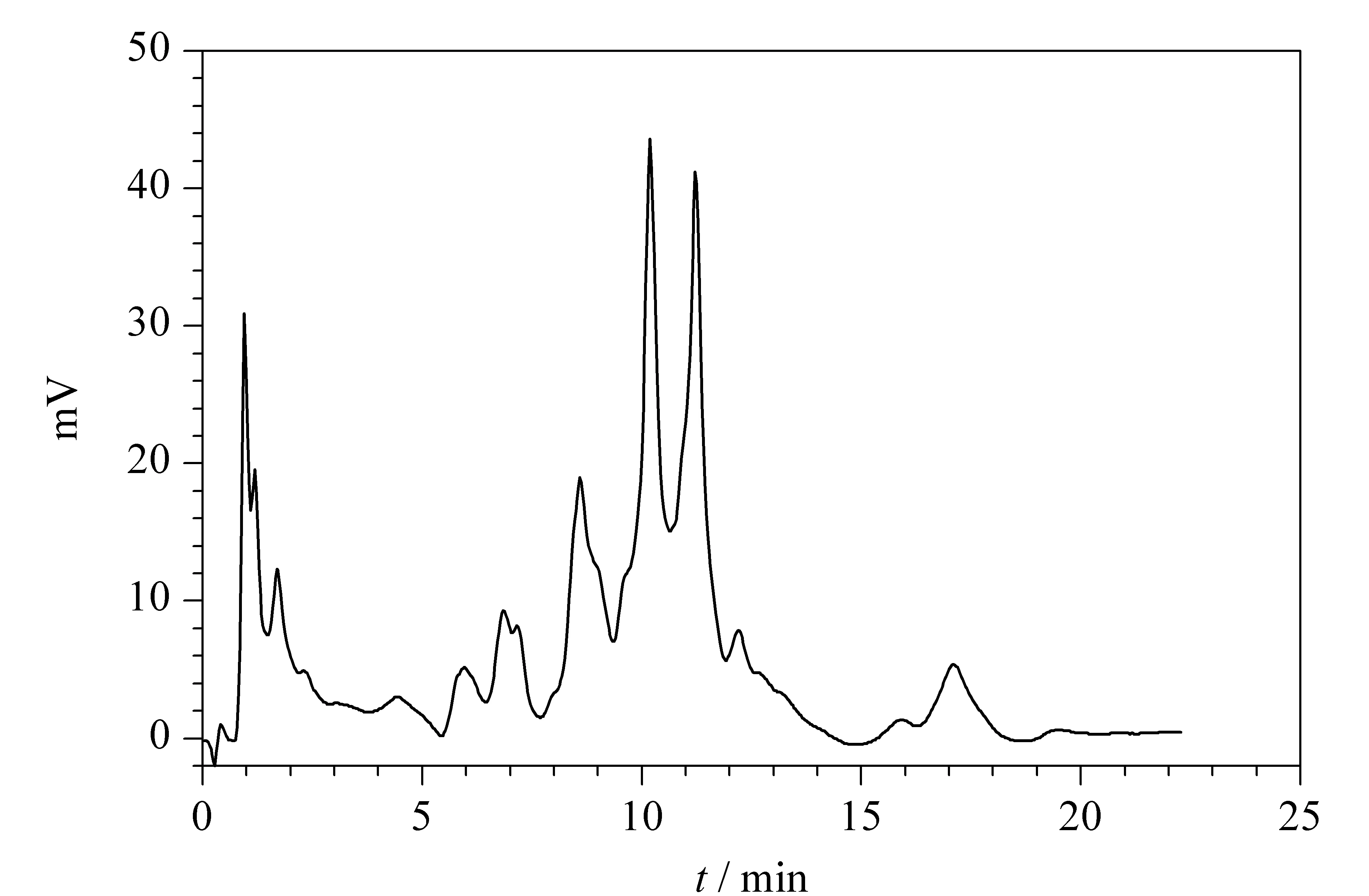
图 6 大豆分离蛋白样品的色谱图Fig. 6 Chromatogram of a soybean protein isolation sample
大豆分离蛋白(soybean protein isolation, SPI)是将大豆除去大豆油和水溶性非蛋白质成分后得到的一种高蛋白质含量的混合物[40];它既可作为营养食品,又可以用来制备环境友好的天然高分子材料[41]。由于其组分复杂,加上不同的原料来源以及不同的加工过程,导致大豆原蛋白降解的程度不同,大豆分离蛋白的组成也不尽相同。图6为市面上一种大豆分离蛋白的色谱分离结果。这种分离虽然不能给出完全的分离和各组分的定性分析,但是可以给出部分组成和含量分布信息,从而对其质量控制有一定的参考意义。
3 结论
本研究发展了一种利用模板法制备均匀、大孔和粒径为2 μm左右硅胶微球的方法。以扫描电子显微镜为表征方法对所制备的新型硅胶微球进行了测试表征和制备条件的优化,提出了硅胶微球形成的机理。并对所制备的硅胶微球进行了C18键合修饰和高效液相色谱蛋白质分离评价。本工作的意义在于揭示了可以采用高度交联的聚合物微球模板来合成亚微米级大孔硅胶微球。可以设想,通过对聚合物模板进行质量控制和使用更均匀的聚合物模板,以及对所制备的大孔硅胶微球进行筛分精制和水热后处理,完全可以制备出高质量的高效液相色谱用硅胶微球;使用不同尺寸、不同交联度和含不同官能团的聚合物微球可以制备出不同粒径、不同孔径和不同形貌的硅胶基质微球以及相应的色谱固定相,从而满足不同高效液相色谱分离分析应用的需要和促进高效液相色谱固定相的发展。
[1] Kohler J, Kirkland J J. J Chromatogr A, 1987, 385: 125
[2] Yang X L, Wang J D, Xiong B H. Chinese Journal of Chromatography, 2000, 18(4): 308
杨新立, 王俊德, 熊博晖. 色谱, 2000, 18(4): 308
[3] Zhao B B, Zhang Y, Tang T, et al. Progress in Chemistry, 2012, 24(1): 122
赵贝贝, 张艳, 唐涛, 等. 化学进展, 2012, 24(1): 122
[4] Gallis K W, Araujo J T, Duff K J, et al. Adv Mater, 1999, 11: 1452
[5] Unger K K, Kumar D, Grün M, et al. J Chromatogr A, 2000, 892: 47
[6] Fekete S, Olah E, Fekete J. J Chromatogr A, 2012, 1228: 57
[7] Guiochon G, Gritti F. J Chromatogr A, 2011, 1218: 1915
[8] Wang Y, Ai F, Ng S, et al. J Chromatogr A, 2012, 1228: 99
[9] Dong H J, Brennan J D. J Mater Chem, 2012, 22: 13197
[10] Hayes R, Ahmed A, Edge T, et al. J Chromatogr A, 2014, 1357: 36
[11] Sun Y S, Qu Q S, Yu S X, et al. Chinese Journal of Chromatography, 2016, 34(12): 1250
孙元社, 瞿其曙, 于淑新, 等. 色谱, 2016, 34(12): 1250
[12] Svec F, Peters E C, Sykora D, et al. J Chromatogr A, 2000, 887: 3
[13] Tanaka N, Kobayashi H, Ishizuka N, et al. J Chromatogr A, 2002, 965: 35
[14] MacNair J E, Patel K D, Jorgenson J W. Anal Chem, 1999, 71: 700
[15] Shen Y, Zhang R, Moore R J, et al. Anal Chem, 2005, 77: 3090
[16] Zou H F, Wu M H, Wang F J, et al. Chinese Journal of Chromatography, 2009, 27(5): 526
邹汉法, 吴明火, 王方军, 等. 色谱, 2009, 27(5): 526
[17] Wienkoop S, Glinski M, Tanaka N, et al. Rapid Commun Mass Spectrom, 2004, 18: 643
[18] Chen W, Jiang K, Mack A, et al. J Chromatogr A, 2015, 1414: 147
[19] Unger K K, Jilge G, Janzen R, et al. Chromatographia, 1986, 22(7): 379
[20] Nimura N, Itoh H, Kinoshita T. J Chromatogr, 1991, 585: 207
[21] Chong B E, Lubman D M, Miller F R, et al. Rapid Commun Mass Spectrom, 1999, 13: 1808
[22] Wu N, Liu Y, Lee M L. J Chromatogr A, 2006, 1131: 142
[23] Li Y Y, Cheng S Y, Dai P C, et al. Chem Commun, 2009, 1085
[24] Ma Y R, Qi L M, Ma J M, et al. Colloids Surf A Physicochem Eng Asp, 2003, 229: 1
[25] Edouard S P, Bouvier E S P, Koza S M. TrAC-Trends Anal Chem, 2014, 63: 85
[26] Fekete S, Beck A, Veuthey J L, et al. J Pharm Biomed Anal, 2014, 101: 161
[27] Huo Q, Margolese D I, Stucky G D. Chem Mater, 1996, 8: 1147
[28] Lin H P, Mou C Y. Acc Chem Res, 2002, 35: 927
[29] Kim T W, Chung P W, Lin V S Y. Chem Mater, 2010, 22: 5093
[30] Qiao Z A, Zhang L, Guo M, et al. Chem Mater, 2009, 21: 3823
[31] Zhao D Y, Huo Q S, Feng J L, et al. J Am Chem Soc, 1998, 120: 6024
[32] Boissière C, Kummel M, Persin M. Adv Funct Mater, 2011, 11: 129
[33] Zhang H F, Hardy G C, Rosseinsky M J, et al. Adv Mater, 2003, 15(1): 78
[34] Zhang H F, Hardy G C, Khimyak Y Z, et al. Chem Mater, 2004, 16: 4245
[35] Meyer U, Larsson A, Hentze H, et al. Adv Mater, 2002, 14: 1768
[36] He J, Yang C L, Xiong X H. J Polym Sci, Part A: Polym Chem, 2012, 50(14): 2889
[37] Xia H J, Wan G P, Zhao J L, et al. J Chromatogr A, 2016, 1471: 138
[38] Zhang K, Xu L L, Jiang J G, et al. J Am Chem Soc, 2013, 135: 2427
[39] Huang M X, Liu L, Wang S G, et al. Langmuir, 2017, 33(2): 519
[40] Tian K, Guan J, Shao Z Z, et al. Progress in Chemistry, 2008, 20(4): 565
田琨, 管娟, 邵正中, 等. 化学进展, 2008, 20(4): 565
[41] Huang J, Zhang L N, Chen F G. J Appl Polym Sci, 2003, 88: 3284
Science and Technology Commission of Shanghai Municipality Project (No. 14440502300); Foundation of Hujiang from University of Shanghai for Science and Technology (No. D15011).
Preparation of large-pore silica microspheres using templating method and their applications to protein separation with high performance liquid chromatography
NIU Mengna, MA Hongyan, HU Fei, WANG Shige, LIU Lu,CHANG Haizhou, HUANG Mingxian*
(DepartmentofChemistry,CollegeofScience,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China)
Large-pore silica microspheres were synthesized by utilizing weak cation exchange polymer beads as templates,N-trimethoxysilylpropyl-N,N,N-trimethylammonium chloride (TMSPTMA) as a structure-directing agent, tetraethoxysilane (TEOS) as a silica precursor, and triethanolamine as a weak base catalyst. The hydrolysis and condensation of the silica precursors occurred inside the templating polymer beads yielded polymer/silica composite microspheres. After the organic polymer templates were removed in the calcination step, large-pore silica microspheres were produced. The effects of different reaction conditions on the morphology, structure and dispersibility of the formed silica microspheres were investigated. It has been shown that when the volume ratio of TMSPTMA, TEOS and triethanolamine was 1∶2∶2, silica microspheres with pore size range of 50-150 nm and particle size around 2 μm were obtained. The as-prepared silica microspheres were then bonded with chlorodimethyloctadecylsilane (C18), packed into a 50 mm×4.6 mm column, and evaluated for the separations of some common standard proteins and soybean isolation proteins. The results showed that the large-pore silica spheres from this work have potentials for protein separation in HPLC.
templating method; structure-directing agent; large-pore silica microspheres; high performance liquid chromatography (HPLC); protein separation
10.3724/SP.J.1123.2017.03018
2017-03-17
上海市科委项目(14440502300);上海理工大学沪江基金(D15011).
O658
A
1000-8713(2017)06-0565-07
* 通讯联系人.E-mail:hmx@usst.edu.cn.
