小菜蛾储存蛋白基因的克隆与表达分析
2017-06-15陈伟军尤燕春任娜娜许贤美
陈伟军, 尤燕春, 仲 帆, 任娜娜, 许贤美, 谢 苗
(1.福建农林大学应用生态研究所; 2.福建农林大学生命科学学院; 3.农业部闽台作物有害生物综合治理重点实验室; 4.闽台特色作物病虫生态防控协同创新中心,福建 福州 350002)
小菜蛾储存蛋白基因的克隆与表达分析
陈伟军1,2,3,4, 尤燕春1,2,3,4, 仲 帆2, 任娜娜1,3,4, 许贤美2, 谢 苗1,2,3,4
(1.福建农林大学应用生态研究所; 2.福建农林大学生命科学学院; 3.农业部闽台作物有害生物综合治理重点实验室; 4.闽台特色作物病虫生态防控协同创新中心,福建 福州 350002)
克隆和分析了2个小菜蛾的储存蛋白基因——PxAJSP-1和PxBJHSP-2.其中,PxAJSP-1属于芳基贮存蛋白,而PxBJHSP-2属于富甲硫氨酸储存蛋白.进化树分析表明,它们在同一目昆虫中相对保守.利用实时荧光定量PCR分析其表达模式,发现PxAJSP-1和PxBJHSP-2在4龄幼虫和蛹期高表达,且在脂肪体中的表达量远高于其他组织.
储存蛋白; 小菜蛾; 实时荧光定量PCR; 表达分析
储存蛋白(storage proteins,SPs)因在昆虫变态发育中的重要作用,而受到越来越多的关注.SPs是变态发育昆虫幼虫阶段合成的一类储存性蛋白,经脂肪体合成后储存于体内,并在昆虫变态和繁殖等需要大量能量而又没有外源补充的阶段快速分解为氨基酸,是昆虫变态发育过程中氨基酸的主要来源[1-3].SPs在鳞翅目昆虫卵黄生成过程中,会增加含硫氨基酸的储存,因此在雌性成虫的繁殖和卵发育中起重要作用[4].昆虫SPs可以结合其他有机化合物,如核黄素[5]和某些杀虫剂[6],刺激昆虫体内的干细胞增殖,并且通过胞内作用调节转录作用[7].在整个SPs家族中,酸性保幼激素抑制蛋白1(acidic juvenile hormone-suppressible protein 1,AJSP-1)、碱性保幼激素抑制蛋白1(basic juvenile hormone-suppressible protein 1,BJHSP-1)和碱性保幼激素抑制蛋白2(basic juvenile hormone-suppressible protein 2,BJHSP-2)是最重要的昆虫储存蛋白.
根据氨基酸组成,SPs通常分为3类:(1)芳基储存蛋白,其苯丙氨酸、酪氨酸和色氨酸含量大于15%;(2)富甲硫氨酸储存蛋白,其甲硫氨酸含量为4%~11%,且芳香族氨基酸含量小于15%;(3)适量甲硫氨酸储存蛋白,甲硫氨酸含量小于4%,且芳香族氨基酸含量小于15%[8].目前已从多种鳞翅目昆虫中克隆了编码SPs的cDNA,这些昆虫包括烟草天蛾(Manducasexta)、斜纹夜蛾(Spodopteralitura)、印度谷螟(Plodiainterpunctella)、家蚕(Bombyxmori)和美国白蛾(Hyphantriacunea)等[9-12].
小菜蛾[Plutellaxylostella(L.)]属鳞翅目菜蛾科,是一种世界性迁徙昆虫,也是十字花科蔬菜的主要害虫之一[13].小菜蛾已经对多种杀虫剂产生了抗药性,包括苯基吡唑类、阿维菌素和新烟碱类等化学杀虫剂,以及生物农药苏云金芽孢杆菌(Bacillusthuringiensis,Bt)[14]等.目前,有关小菜蛾储存蛋白的研究较少[15-16].
本实验室前期测得小菜蛾基因组数据,根据注释找到2个储存蛋白基因,分别为酸性保幼激素抑制蛋白1(PxAJSP-1, ID: Px007023)和碱性保幼激素抑制蛋白2(PxBJHSP-2, ID: Px007031).本研究通过克隆验证这2个基因,并分析两者在不同发育阶段和组织中的表达模式,为进一步了解小菜蛾储存蛋白的表达模式和作用机理奠定基础,同时为利用储存蛋白寻求害虫防治方法提供依据.
1 材料与方法
1.1 昆虫样本
小菜蛾敏感品系(SS)于2004年采集于福建省福州市郊区菜地,在室内不接触任何杀虫剂,温度为(25±1) ℃,湿度为65%±5%,光周期为16 h∶8 h,用盆栽萝卜苗[Raphanussativus(L.)]饲养至今.
1.2 RNA提取和第一链cDNA合成
收集小菜蛾卵、1~4龄幼虫、蛹和成虫,将收集的虫样分别放入无RNase的EP管中,液氮速冻后存于-80 ℃.4龄幼虫经75%乙醇表面消毒后,在无RNase的无菌水中解剖,将组织样品(头部、中肠、马氏管、脂肪体和表皮)浸入RNAlaterTMRNA稳定剂中,4 ℃储存并尽快提取RNA.采用RNeasy Plus Micro试剂盒(Qiagen)提取总RNA,用Nanodrop微量分光光度计测定RNA浓度后,使用PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time) (TaKaRa)进行反转录获得cDNA模板.
1.3 cDNA扩增和序列分析
根据本实验室测序所得小菜蛾基因组(DBM-DB, http:∥iae.fafu.edu.cn/DBM/)序列,设计PxAJSP-1和PxBJHSP-2开放阅读框(open reading frame,ORF)的扩增引物(表1).为了减少非特异条带,本实验采用梯度PCR程序:94 ℃预变性5 min;94 ℃变性30 s,60~70 ℃退火30 s,每个循环增加0.3 ℃,72 ℃延伸4 min,共30个循环,最后72 ℃延伸10 min.用1%琼脂糖凝胶电泳分离PCR产物,将目的产物割胶、回收并纯化,再将其与pMD-18T载体连接.用0.1%氨苄青霉素筛选阳性克隆后,用质粒小提取试剂盒提取质粒并送铂尚生物技术(上海)有限公司测序.通过DNAMAN V7软件分析测序结果,得到预测的氨基酸序列.使用SignalP 4.1和NCBI CD-search分别进行信号肽和结构域的预测,蛋白质亲水性或疏水性则根据ExPASy网站(http:∥web.expasy.org/protparam/)判定.使用PuTTY V0.63软件结合基因组数据确定2个基因内含子和外显子的位点.

表1 本实验中所使用的引物序列Table 1 Primer sequences used in the experiments
1.4 系统进化树分析
从NCBI网站(https:∥www.ncbi.nlm.nih.gov)获得13个不同物种的储存蛋白氨基酸序列,与本研究克隆的小菜蛾储存蛋白序列进行进化树分析.其中,鳞翅目包括金凤蝶(Papiliomachaon)、家蚕;双翅目包括达令按蚊(Anophelesdarling)、白纹伊蚊(Aedesalbopictus)和致倦库蚊(Culexquinquefasciatus);鞘翅目包括赤拟谷盗(Triboliumcastaneum)、葬甲(Nicrophorusvespilloides)、光肩星天牛(Anoplophoraglabripennis)和竹虎天牛(Omphisafuscidentalis);膜翅目包括木头寄生黄蜂(Orussusabietinus)和阿根廷蚁(Linepithemahumile);同翅目为云杉蚜虫(Choristoneurafumiferana).选取非昆虫节肢动物黄肥尾蝎(Androctonusaustralis)的储存蛋白作为外群.利用MEGA5.2软件中的邻接法(Neighbor-Joining)构建系统发育树,每个节点通过1000次重复的自展值进行可信度检测.
1.5 实时荧光定量PCR
设计2个基因的实时荧光定量PCR(quantitative real-time PCR,qPCR)引物(表1),按照TaKaRa公司的SYBR Premix Ex Taq试剂盒说明书进行qPCR.扩增反应体系为20 μL,反应条件:95 ℃预变性30 s,95 ℃变性5 s,退火温度60 ℃,30 s,36次循环,添加熔解曲线以验证扩增引物的特异性.每个样品分别进行3次生物学重复和3次技术重复,以PxRPS4为内参基因.采用2-△Ct法[17]处理qPCR的数据,误差以标准误表示,采用SPSS 19.0软件单因素ANOVA方法分析基因表达显著性并进行Turkey′s检验.
2 结果与分析
2.1 PxAJSP-1和PxBJHSP-2序列分析
将PxAJSP-1的测序结果在NCBI中进行BlastX,匹配上昆虫的储存蛋白,证明克隆所得为目的基因.PxAJSP-1的ORF长度为2 136 bp,编码711个氨基酸(图1A),由8个外显子组成(图1B),包含135个氨基酸组成的N-末端(图1C),预测其分子质量为83.43 ku,等电点为6.27.在推导的氨基酸序列中,Leu的含量最高(9.85%),Cys的含量最低(0.281%).预测的亲水性平均系数(grand average of hydropathicity, GRAVY)为-0.282,说明其属于亲水性蛋白质;同时,PxAJSP-1的氨基酸序列中芳香族氨基酸的含量达到15.04%,说明它属于芳基储存蛋白.
PxBJHSP-2的测序结果经NCBI比对,证明其也属于小菜蛾储存蛋白基因.PxBJHSP-2的ORF长度为2 292 bp,编码763个氨基酸(图2A),由5个外显子组成(图2B),包含125个氨基酸组成的N-末端(图2C),预测其分子质量和等电点分别为91.01 ku和8.97.在推导的氨基酸序列中,Leu的含量最高(10.35%),Trp的含量最低(0.118%),其GRAVY值为-0.280,也为亲水性蛋白质.此外,PxBJHSP-2含有31个Mets(4.06%),且芳香族氨基酸含量为12.97%,因此判定其属于富甲硫氨酸储存蛋白.
在构建的系统进化树中,PxAJSP-1与其他序列聚集成2个主要分支(图3A).其中,鳞翅目昆虫聚在同一分支上,表明它们可能具有相似的功能和更接近的遗传关系,且竹虎天牛与鳞翅目聚在一起;而其他目的昆虫也聚在一起,表明同源蛋白质在同一目中相对保守.对于PxBJHSP-2(图3B)而言,其进化树的聚类趋势与PxAJSP-1几乎相同,即鳞翅目昆虫序列聚集在同一分支中,且与外群分离;同时,云杉蚜虫和竹虎天牛的储存蛋白序列聚集到鳞翅目的分支中,说明同翅目与鳞翅目的储存蛋白可能有共同的进化起源或类似的功能.
2.2PxAJSP-1和PxBJHSP-2的表达分析
为了确定PxAJSP-1和PxBJHSP-2在不同发育阶段和组织中的表达情况,利用qPCR对2个基因进行检测.结果表明,这2个基因有类似的表达模式,即在幼虫—蛹期表达量较高.其中,PxAJSP-1在4龄幼虫中表达量最高(图4A),而PxBJHSP-2则在蛹期具有更高的表达量(图4B).PxAJSP-1和PxBJHSP-2在脂肪体中的表达量显著高于其他组织,在表皮和马氏管中的表达量次之,在中肠和头部的表达量最低(图4C、D).
3 讨论
本文克隆所得的2个小菜蛾储存蛋白基因PxAJSP-1和PxBJHSP-2分别属于芳基储存蛋白和富甲硫氨酸储存蛋白,且均为亲水性蛋白质.系统进化树分析的结果显示,PxAJSP-1和PxBJHSP-2分别与其他鳞翅目昆虫聚在一起,且与外群分离,表明这2个基因的功能和遗传关系在鳞翅目中相对稳定和保守.2个蛋白在其他目的昆虫中也存在相似结果,说明储存蛋白在昆虫中的进化模式基本一致,即昆虫纲的储存蛋白具有相同的进化起源[18].
PxAJSP-1和PxBJHSP-2均在幼虫—蛹期具有较高的表达量,前者在4龄幼虫中显著高表达,后者则在蛹期显著高表达.小菜蛾在成虫阶段不再进食(实验室饲养时仅提供少量糖水以补充能量),雌虫必须利用幼虫阶段积累的储存物质来保证卵黄蛋白的合成[16].因此,储存蛋白倾向于在变态发育过程中大量表达.

A.PxAJSP-1的cDNA和氨基酸序列:下划虚线的序列表示预测的信号肽序列,箭头表示成熟蛋白质中的第一个氨基酸残基,星号表示参与储存蛋白盐桥组成的保守残基,倒三角表示储存蛋白中与铜结合的保守组氨酸位置.B.PxAJSP-1基因外显子/内含子结构:线条表示PxAJSP-1的内含子序列,黑色方框表示外显子序列.C.PxAJSP-1蛋白保守结构域分析:蓝色框、淡黄色框和灰色框分别代表PxAJSP-1的N-末端、M区和C-末端.图1 小菜蛾PxAJSP-1的序列分析Fig.1 Sequence analysis of PxAJSP-1 of P.xylostella

A.PxBJHSP-2的cDNA和氨基酸序列:下划虚线的序列表示预测的信号肽序列,箭头表示成熟蛋白质的第一个氨基酸残基,星号表示参与储存蛋白盐桥组成的保守氨基酸残基.B.PxBJHSP-2基因外显子/内含子结构:线条表示PxBJHSP-2的内含子序列,黑色方框表示外显子序列.C.PxBJHSP-2蛋白保守域分析:蓝色框、淡黄色框和灰色框分别代表PxBJHSP-2的N-末端、M区和C-末端.图2 小菜蛾PxBJHSP-2的序列分析Fig.2 Sequence analysis of PxBJHSP-2 of P.xylostella
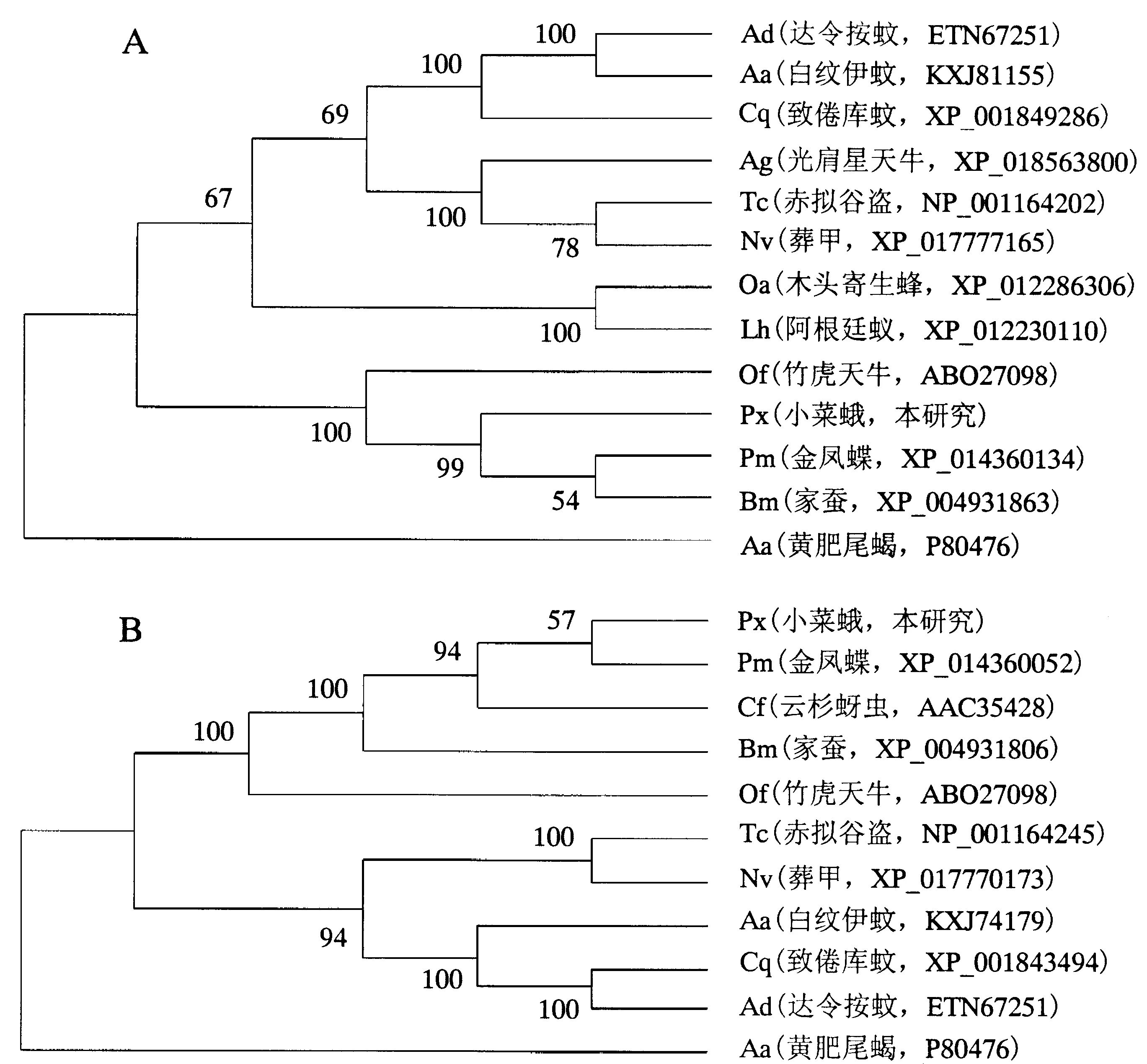
图上显示的是1000次重复自展值检测的可信度.图3 邻接法构建的AJSP-1(A)和BJHSP-2(B)的系统进化树Fig.3 Neighbor-Joining phylogenetic tree of AJSP-1 (A) and BJHSP-2 (B) in different insect species

A.PxAJSP-1在不同发育阶段的mRNA相对表达量;B.PxBJHSP-2在不同发育阶段的mRNA相对表达量;C.PxAJSP-1在不同组织中的mRNA相对表达量;D.PxBJHSP-2在不同组织中的mRNA相对表达量.图中数据为平均值±SD,用单因素方差分析法(Tukey′s test, n=3)分析差异显著性.柱上不同字母表示差异显著(P<0.05).图4 不同发育阶段和组织中PxAJSP-1和PxBJHSP-2的mRNA相对表达水平Fig.4 Expression level of PxAJSP-1 and PxBJHSP-2 at different developmental stages and tissues based on qPCR
组织表达特异性分析发现,PxAJSP-1和PxBJHSP-2均在脂肪体中有较高的表达水平,在马氏管和表皮中的表达次之.脂肪体是昆虫的重要组织之一,其主要功能包括作为糖类物质、脂肪和蛋白质代谢的枢纽以及神经激素、蜕皮激素和保幼激素的靶组织等[19],还涉及能量储存、解毒和其他生理功能[20].储存蛋白会先在幼虫的脂肪体中形成,之后进入血淋巴,并在幼虫化蛹前再次被脂肪体吸收,并存储在蛹的脂肪体内,羽化后储存蛋白会水解以提供成虫所需的氨基酸.这是储存蛋白在脂肪体中的表达量高于其他组织的重要原因.另外,储存蛋白还会参与表皮和马氏管的形成与构建,这在红头丽蝇(Calliphoravicina)、家蝇(Muscadomestica)等昆虫中均已得到证实[21-22].
[1] SPYLIOPOULOS A, GKOUVISASA T, FANTINOUB A, et al. Expression of a cDNA encoding a member of the hexamerin storage proteins from the mothSesamianonagrioides(Lef.) during diapause[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2007,148(1):44-54.
[2] 马彩霞,刘惠霞,沙忠利,等.昆虫体内储存蛋白的研究进展[J].应用昆虫学报,2002,39(6):416-420.
[3] 臧振原,贾宝辉,李涵哲,等.大豆食心虫储存蛋白hexamerin基因的克隆与表达分析[J].应用昆虫学报,2014(3):717-724.
[4] PAN M, TELFER W H. Methionine-rich hexamerin and arylphorin as precursor reservoirs for reproduction and metamorphosis in female luna moths[J]. Archives of Insect Biochemistry and Physiology, 1996,33(2):149-162.
[5] MAGEE J, KRAYNACK N, MASSEY H C, Jr, et al. Properties and significance of a riboflavin-binding hexamerin in the hemolymph ofHyalophoracecropia[J]. Archives of Insect Biochemistry and Physiology, 1994,25(2):137-157.
[6] HAUNERLAND N H, BOWERS W S. Binding of insecticides to lipophorin and arylphorin, two hemolymph proteins ofHeliothiszea[J]. Archives of Insect Biochemistry and Physiology, 1986,3(1):87-96.
[7] HAKIM R S, BLACKBURN M B, CORTI P, et al. Growth and mitogenic effects of arylphorin in vivo and in vitro[J]. Archives of Insect Biochemistry and Physiology, 2007,64(2):63-73.
[8] HAUNERLAND N H. Insect storage proteins: gene families and receptors[J]. Insect Biochemistry and Molecular Biology, 1996,26(8/9):755-765.
[9] CORPUZ L M, CHOI H, MUTHUKRISHNAN S, et al. Sequences of two cDNAs and expression of the genes encoding methionine-rich storage proteins ofManducasexta[J]. Insect Biochemistry, 1991,21(3):265-276.
[10] SEO S J, KANG Y J, CHEON H M, et al. Distribution and accumulation of storage protein-1 in ovary ofHyphantriacuneaDrury[J]. Archives of Insect Biochemistry and Physiology, 1998,37(2):115-128.
[11] ZHENG Y P, YOSHIGA T, TOJO S. cDNA cloning and deduced amino acid sequences of three storage proteins in the common cutworm,Spodopteralitura(Lepidoptera: Noctuidae)[J]. Applied Entomology and Zoology, 2000,35(1):31-39.
[12] 何渐鸣.家蚕储存蛋白Storage protein (SP3)基因克隆及调节黑化作用的研究[D].苏州:苏州大学,2014.
[13] FURLONG M J, WRIGHT D J, DOSDALL L M. Diamondback moth ecology and management: problems, progress, and prospects[J]. Entomology, 2013,58:517-541.
[14] SUN J Y, LIANG P, GAO X W. Cross-resistance patterns and fitness in fufenozide-resistant diamondback moth,Plutellaxylostella(Lepidoptera: Plutellidae)[J]. Pest Management Science, 2012,68(2):285-289.
[15] ASHFAQ M, SONODA S, TSUMUKI H. cDNA characterization and expression analysis of two arylphorin-like hexameric protein genes from the diamondback moth,Plutellaxylostella(L.)[J]. Archives of Insect Biochemistry and Physiology, 2007,64(4):175-185.
[16] WHEELER D E, TUCHINSKAYA I, BUCK N A, et al. Hexameric storage proteins during metamorphosis and egg production in the diamondback moth,Plutellaxylostella(Lepidoptera)[J]. Journal of Insect Physiology, 2000,46(6):951-958.
[17] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001,25(4):402-408.
[18] SASAKI G, ISHIWATA K, MACHIDA R, et al. Molecular phylogenetic analyses support the monophyly of Hexapoda and suggest the paraphyly of Entognatha[J]. BMC Evolutionary Biology, 2013,13:236-245.
[19] 李兆英.意大利蜜蜂工蜂脂肪体胚后发育过程中细胞的增殖和凋亡[J].昆虫学报,2013,56(11):1 252-1 257.
[20] ARRESE E L, SOULAGES J L. Insect fat body: energy, metabolism, and regulation[J]. Entomology, 2010,55(1):207-225.[21] KÖNIG M, AGRAWAL O P, SCHENKEL H, et al. Incorporation of calliphorin into the cuticle of the developing blowfly,Calliphoravicina[J]. Development Genes and Evolution, 1986,195(5):296-301.
[22] KOEPPA J K, GILBERT L I. Immunochemical evidence for the transport of haemolymph protein into the cuticle ofManducasexta[J]. Journal of Insect Physiology, 1973,19(3):615.
(责任编辑:杨郁霞)
Characterization and expression profiling of storage protein genes inPlutellaxylostella(L.)
CHEN Weijun1,2,3,4, YOU Yanchun1,2,3,4, ZHONG Fan2, REN Nana1,3,4, XU Xianmei2, XIE Miao1,2,3,4
(1.Institute of Applied Ecology, Fujian Agriculture and Forestry University; 2.College of Life Science, Fujian Agriculture and Forestry University; 3.Key Laboratory of Integrated Pests Management for Fujian-Taiwan Crops, Ministry of Agriculture; 4.Fujian-Taiwan Joint Centre for Ecological Control Crop Pests, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Two storage protein genes inPlutellaxylostella,PxAJSP-1 andPxBJHSP-2, were cloned and characterized. The results showed that PxAJSP-1 belongs to the arylphorin-like protein and PxBJHSP-2 belongs to the methionine-rich protein. Phylogenetic tree analyses revealed that both genes were relatively conservative among the insects of the same order. The expression pattern analyses by quantitative real-time PCR (qPCR) showed thatPxAJSP-1 andPxBJHSP-2 were highly expressed in the fourth-instar larvae and pupae, respectively. And their expressions predominated in fat body than other tissues.
hexamerins;Plutellaxylostella; qPCR; expression profile
2017-03-03
2017-03-23
国家自然科学基金(31230061,31320103922).
陈伟军(1991-),男,硕士研究生.研究方向:生物化学与分子生物学.Email:411585662@qq.com.通讯作者谢苗(1977-),女,副教授.研究方向:生物化学与分子生物学.Email:xmshelly@163.com.
Q786;Q966
A
1671-5470(2017)03-0311-07
10.13323/j.cnki.j.fafu(nat.sci.).2017.03.013
