分子佐剂鞭毛素对弓形虫SAG1蛋白抗体应答的影响
2017-06-15黄驹辉龚丽贞唐静静黄志坚殷光文
黄驹辉, 龚丽贞, 唐静静, 黄志坚, 殷光文
(福建农林大学动物科学学院/福建省动物药物工程实验室,福建 福州 350002)
分子佐剂鞭毛素对弓形虫SAG1蛋白抗体应答的影响
黄驹辉, 龚丽贞, 唐静静, 黄志坚, 殷光文
(福建农林大学动物科学学院/福建省动物药物工程实验室,福建 福州 350002)
将沙门氏菌鞭毛素和弓形虫免疫优势表面抗原1(SAG1)融合表达,研究其在小鼠上激发的体液免疫应答.首先,采用PCR扩增SAG1片段.其次,将SAG1连接到原核表达载体pET-28a中构建表达质粒pET-28a-SAG1;连接到实验室已有的pET-28a鞭毛素质粒中构建表达质粒pET-28a-F-SAG1;质粒转化至大肠杆菌BL21(DE3)菌株中并进行表达.将纯化后的蛋白免疫小鼠,每隔2周免疫一次,共免疫3次,第3次免疫后15 d取小鼠血清.最后,采用蛋白印迹检测蛋白的大小;用酶联免疫吸附方法检测血清中多克隆抗体的效价.结果表明,诱导出的SAG1蛋白大小为30 ku,F-SAG1大小为70 ku.酶联免疫吸附方法检测的D450 nm均为阴性对照的两倍,表明该多克隆抗体具有较高效价.可见,鞭毛素可以作为分子佐剂促进弓形虫亚单位疫苗的体液免疫应答.
弓形虫; 表面抗原1(SAG1); 鞭毛素; 体液免疫
弓形虫是一种专性细胞内寄生的机会性致病原虫,可以感染包括人类在内的几乎所有的温血动物,是一种严重的人兽共患寄生虫病原[1].弓形虫病的传播与流行不仅给畜牧业生产和发展带来极大的经济损失[2],还会引发严重的公共安全问题[3].孕妇感染弓形虫可导致流产,或新生儿免疫力低下而患先天性疾病[4];弓形虫还是导致免疫抑制及免疫缺陷人群死亡的主要病因;绝大多数免疫功能正常的成年人感染弓形虫病时呈隐性感染[5].临床上常用磺胺和嘧啶类药物治疗弓形虫病,但这些药物对人体和动物的毒副作用较大,且不能完全杀死包囊,容易复发,长期服用抗生素造成药物残留和耐药性等问题[6-7].弓形虫病严重威胁人类和动物的健康甚至生命,但目前尚无有效、实用的疫苗来预防人和动物弓形虫病[8].
目前,已有多种不同生活史阶段弓形虫的重要抗原被用于亚单位疫苗的研究中.其中,表面抗原1(surface antigen 1, SAG1)因其特异性强、在虫体蛋白中所占比例大、具有高度的免疫保护性和免疫原性,是诊断和疫苗开发的主要候选抗原,也是研究最多、应用前景最广泛的抗弓形虫蛋白[9].
要提高疫苗的免疫保护效果,良好的佐剂必不可少.分子佐剂不仅能激发机体的体液免疫应答,在促进机体的细胞免疫应答方面作用独特、效果显著,值得深入研究和利用.鞭毛素是一种应用前景广阔的佐剂,可以与具有免疫原性抗原的蛋白融合表达,制成亚单位疫苗,但该分子佐剂还没有被应用到弓形虫疫苗的研究中.因此,本试验以弓形虫SAG1为模式抗原,构建了原核表达载体pET-28a-F-SAG1,对其进行诱导表达和鉴定,再研究该重组蛋白激发的体液免疫应答,旨在为开发基于分子佐剂的弓形虫亚单位疫苗提供参考.
1 材料与方法
1.1 材料
1.1.1 虫株与试验动物 弓形虫RH株由中国农业大学索勋教授提供;5周龄雌性BALB/C小鼠购自吴氏实验动物,自由采食和饮水.
1.1.2 感受态与载体 pEASY-Blunt Simple克隆载体、BL21(DE3)和Trans1-T1等购自北京全式金生物技术有限公司;pET-28a和pET-28a-F原核表达载体由本实验室保存.
1.1.3 试剂 卡那霉素购自Slarbio公司;小量质粒提取试剂盒、大量质粒提取试剂盒、DNA胶回收试剂盒、镍-氨基三乙酸(Ni-NTA)、抗组氨酸单抗、辣根过氧化物酶标记的山羊抗鼠IgG、PVDF膜和TMB显色液等购自北京全式金生物技术有限公司;限制性核酸酶EcoRⅠ和XhoⅠ、DNA连接酶等购自TaKaRa公司;弗氏佐剂和弗氏不完全佐剂购自美国Sigma公司.
1.2 方法
1.2.1 引物设计 根据SAG1基因片段设计引物,并在上下游引物中分别加入EcoRⅠ和XhoⅠ酶切位点.上游引物(SAG1-EcoRⅠ-5′):GAATTCATGGCAGGGGTGTTTGCCGCGCCC;下游引物(SAG1-XhoⅠ-3′):CTCGAGCCCTGCAGCCCCGGCAAACTCC(划线部分为引入酶切位点),引物由生工生物工程(上海)股份有限公司合成.
1.2.2 目的基因片段的扩增 以本实验室保存的弓形虫基因组为模板扩增弓形虫SAG1基因,用引物SAG1-EcoRⅠ-5′和SAG1-XhoⅠ-3′进行PCR扩增.反应条件为:98 ℃预变性1 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸60 s,30个循环;72 ℃延伸7 min.PCR产物经1%琼脂糖凝胶电泳观察结果,并用DNA胶回收试剂盒将目的片段回收.取回收的SAG1片段与pEASY-Blunt Simple载体构建克隆质粒pEASY-Blunt Simple-SAG1,并转化至Trans1-T1中,用小量提取试剂盒提取质粒pEASY-Blunt Simple-SAG1,产物置-20 ℃保存备用.
1.2.3 原核表达载体的构建及转化 将载体pET-28a、pET-28a-F和pEASY-Blunt Simple-SAG1分别用EcoRⅠ和XhoⅠ于37 ℃双酶切12 h.回收产物pET-28a、pET-28a-F和SAG1,将片段pET-28a与SAG1连接,片段pET-28a-F与SAG1连接,接产物转化至Trans1-T1中.用质粒大量提取试剂盒提取质粒pET-28a-SAG1和pET-28a-F-SAG1,提取的质粒送至生工生物工程(上海)股份有限公司测序.
1.2.4 重组蛋白的表达与检测 取经过测序正确的重组质粒pET-28a-SAG1和pET-28a-F-SAG1转化至BL21(DE3)中,挑取单个PCR鉴定为阳性的菌落用含有卡那霉素的LB培养基扩培,培养至D600 nm为0.4~0.6.取1 mL菌液收集菌体作为空白对照,另取2管(1 mL)加入IPTG分别诱导2和4 h.将菌液离心,弃上清,收集菌体,进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白是否表达.
1.2.5 重组蛋白的纯化 确定蛋白表达后,对菌液进行大量培养,菌液离心收集菌体,超声裂解破碎菌体,取上清和沉淀进行SDS-PAGE检测.将沉淀在包涵体裂解液中搅拌均匀放入透析袋中,将透析袋完全浸没于4.5 mol·L-1尿素溶液中12 h,之后每隔12 h分别按3.5、2.5、1.5、1.0和0.5 mol·L-1梯度替换尿素,最后用1×PBS浸泡24 h.上清液经过0.22 μm滤膜过滤除杂,用ProteinIso Ni-NTA Resin填料的柱子纯化.
1.2.6 特异性检测 将纯化后的蛋白用12% SDS-PAGE进行电泳分离,用半干转法将蛋白移至PVDF膜上,封闭过夜.以抗组氨酸单抗为一抗,辣根过氧化物酶标记的山羊抗鼠IgG为二抗(1∶104),进行蛋白质印迹检测.
1.2.7 动物免疫 小鼠饲养7 d后,随机分为3组:空白对照组、pET-28a-SAG1组和pET-28a-F-SAG1组,每组14只小鼠.其中,pET-28a-SAG1组采用等量抗原和弗氏佐剂乳化后免疫;pET-28a-F-SAG1组不加弗氏佐剂.每只小鼠皮下注射100 μg蛋白,初次免疫后,每隔14 d加强免疫一次,共免疫3次.第3次免疫后的第15天采用断尾取血法收集血液,分离血清并置-20 ℃保存备用.
1.2.8 效价的检测 采用96孔板包被100 μL含量为10 μg·mL-1经过纯化的SAG1,包被液作为空白对照,空白对照组小鼠血清作为阴性对照,制备的多克隆抗体为一抗,按1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400和1∶12 800的梯度稀释,每个样品重复3次.用TMB显色液显色,2 mol·L-1H2SO4终止反应,采用酶标仪测定D450 nm.试验孔的D450 nm为阴性对照孔的两倍时认定为是阳性.
2 结果与分析
2.1SAG1基因的扩增结果
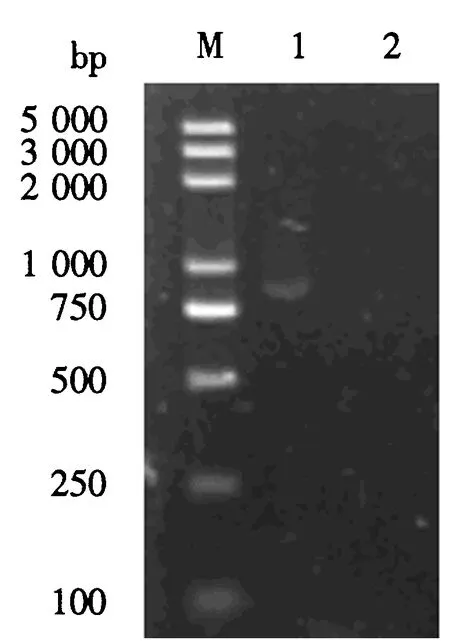
M:DNA标志物;1:SAG1 PCR产物;2:阴性对照.图1 SAG1基因PCR产物的电泳图Fig.1 Identification of SAG1 gene via electrophoresis
用SAG1引物进行PCR扩增,产物经1%琼脂糖凝胶电泳后,可见一条约900 bp的DNA特异性条带,与SAG1预期值(849 bp)大小相符(图1).
2.2 重组质粒的鉴定
用EcoRⅠ和XhoⅠ双酶切重组质粒pET-28a-SAG1和pET-28a-F-SAG1,双酶切下的DNA片段与实际大小相符(图2).质粒测序结果与预设的基因序列完全相同,表明成功构建质粒pET-28a-SAG1和pET-28a-F-SAG1.
2.3 重组质粒的表达与纯化
将两个重组质粒装入BL21进行表达,加入IPTG诱导的菌体表达后,采用12% SDS-PAGE检测.结果(图3)显示,诱导2和4 h都出现目的条带,大小分别在30和70 ku左右,但4 h的目的条带较为清晰;未经诱导的菌体不出现目的条带,表明重组蛋白质粒pET-28a-SAG1和pET-28a-F-SAG1成功表达.

M:DNA标志物;1:EcoRⅠ和XhoⅠ双酶切pET-28a-SAG1;2:EcoRⅠ和XhoⅠ双酶切pET-28a-F-SAG1.图2 重组质粒的双酶切鉴定结果Fig.2 Identification of the recombinant pET-28a-SAG1 and pET-28a-F-SAG1 plasmids by restricting endonuclease digestion
将经过Ni2+层析柱纯化后的pET-28a-F-SAG1和pET-28a-SAG1采用12% SDS-PAGE检测.结果(图4)显示,在70和30 ku处出现目的条带,且纯化效果较好.
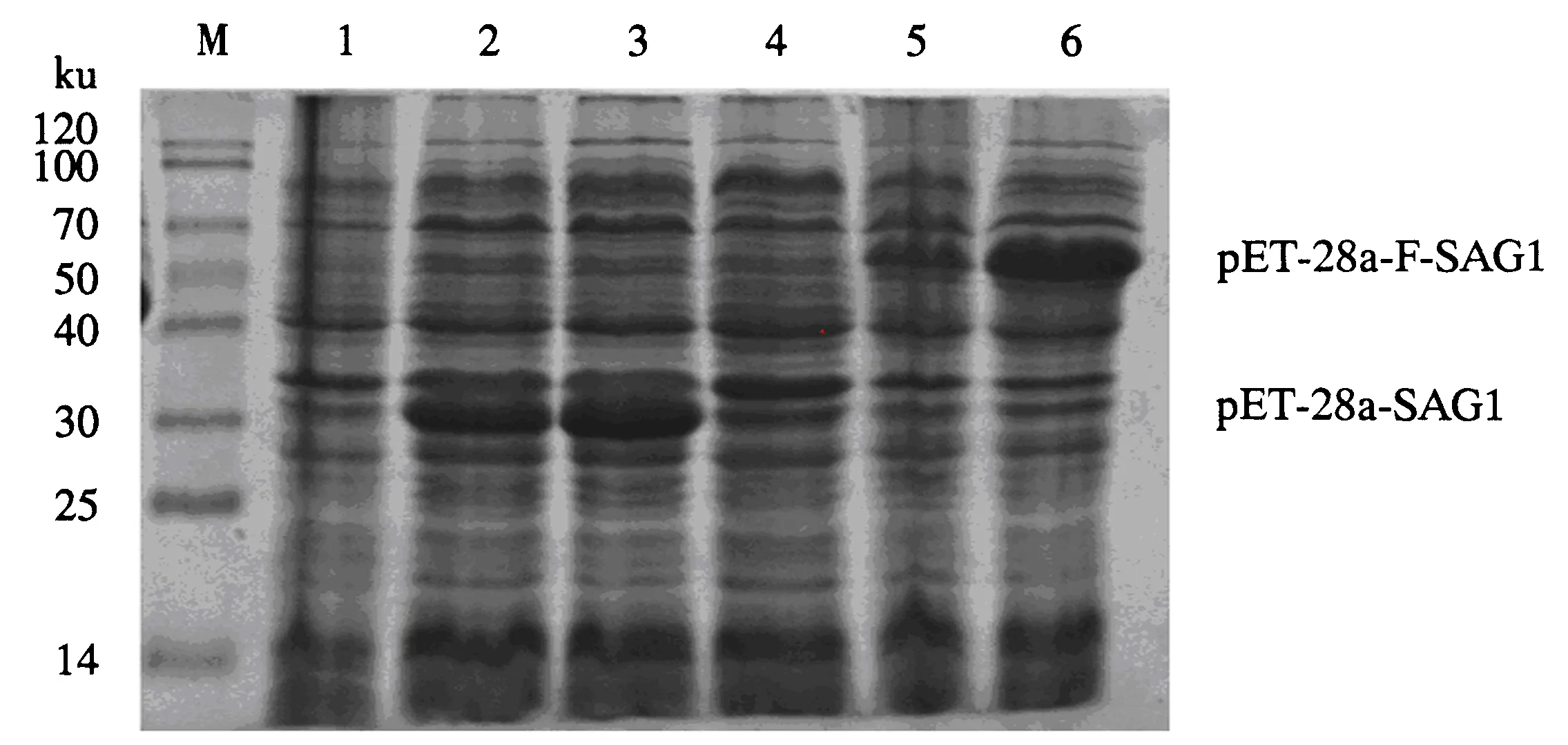
M:蛋白标志物;1~3分别为诱导0、2和4 h的pET-28a-SAG1;4~6分别为诱导0、2和4 h的pET-28a-F-SAG1.图3 重组蛋白表达时间SDS-PAGE电泳结果Fig.3 Expression time of SAG1 and F-SAG1 protein by SDS-PAGE
2.4 蛋白表达的蛋白质印迹检测结果
将表达的蛋白进行蛋白质印迹检测,结果(图5)显示,在70和30 ku处出现特异性目的条带,且其大小与SDS-PAGE电泳结果相符,说明两种蛋白得到了成功表达.
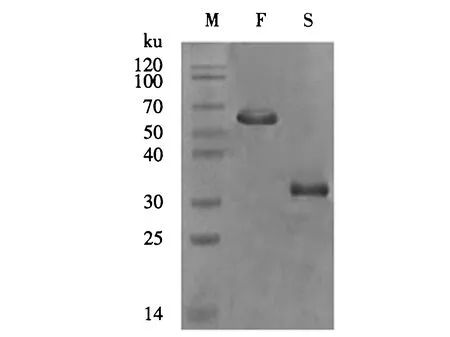
M:蛋白标志物;F:纯化后的F-SAG1蛋白;S:纯化后的SAG1蛋白.图4 纯化后的重组蛋白电泳结果Fig.4 SDS-PAGE of purified recombinant SAG1 and F-SAG1 protein
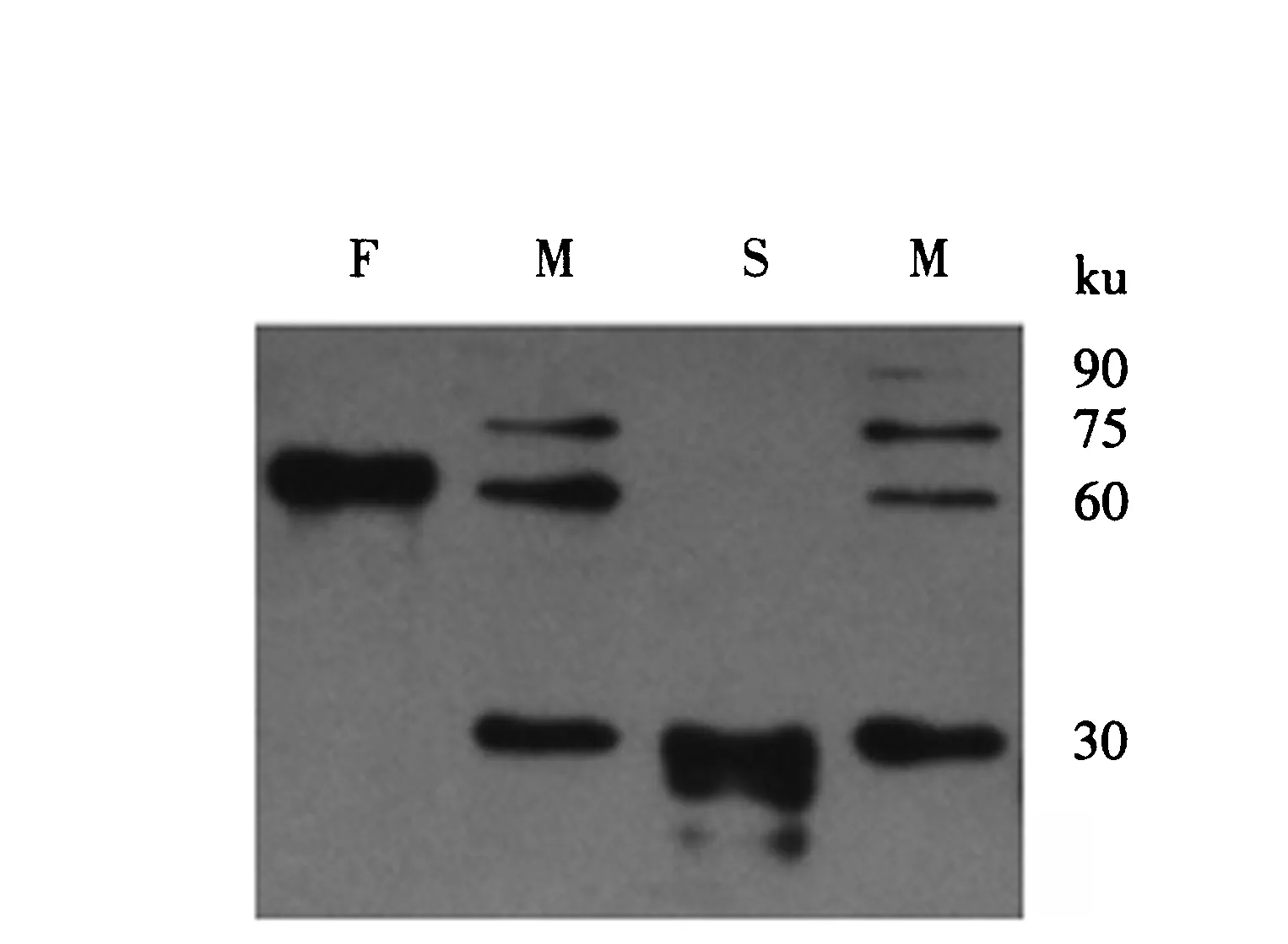
M:蛋白质印迹蛋白标记物;F:纯化后的F-SAG1蛋白;S:纯化后的SAG1蛋白.图5 纯化后的重组蛋白蛋白质印迹结果Fig.5 Western-blot results of purified recombinant SAG1 and F-SAG1 protein
2.5 效价测定结果
采用酶联免疫吸附测定法测定抗体效价,结果(图6)显示,pET-28a-SAG1和pET-28a-F-SAG1组产生的抗体明显高于阴性对照组,阴性对照组的D450 nm小于0.1.当两个免疫组的抗体稀释至1∶12 800时,其D450 nm大于阴性对照组的2倍.表明两个免疫组抗体的效价均大于12 800,但弗氏佐剂pET-28a-SAG1组的效价大于分子佐剂pET-28a-F-SAG1组.

图6 多克隆抗体的效价Fig.6 Titers of polyclonal antibody of SAG1 and F-SAG1 protein
3 讨论
由于弓形虫的生活史和致病机理比较复杂,到目前为止,尚无治疗弓形虫病的理想药物,因此,使用安全有效的疫苗接种被认为可能是弓形虫病的最佳预防措施[10].研究表明,要提高疫苗的免疫保护效果,良好的佐剂必不可少,弓形虫SAG1(P30)具有显著的免疫原性和反应原性[11].鞭毛素可以和具有免疫原性抗原的蛋白融合表达,制成亚单位疫苗,且具有以下优点:低剂量可发挥效应、对宿主不产生超敏反应等[12];也可以和抗原递呈细胞上的TLR5结合,促进抗原递呈细胞的活化,增强抗原递呈细胞对外源抗原的加工递呈作用[13-14].
弗氏佐剂因具有高活性而被广泛应用于疫苗佐剂[15],但因为弗氏佐剂具有一些副作用,不被允许在临床上使用,且黏稠、难乳化、难注射,注射部位容易引起脓肿、坏死等,因此,许多研究人员希望寻找一种低毒甚至无毒的佐剂来代替弗氏佐剂[16].本试验采用原核表达融合蛋白的方法,制备了弓形虫抗原SAG1与分子佐剂鞭毛素的融合蛋白.鞭毛素是一类重要的免疫调节分子,可促进抗原递呈细胞的活化,增强抗原递呈细胞对外源抗原的加工递呈作用[17],使用方便,无需乳化直接使用,不造成注射部位的脓肿、坏死,且不具有毒性.
本试验成功表达出原核表达载体pET-28a-SAG1和pET-28a-F-SAG1,并将这两个载体进行成功转化并纯化,纯化后的蛋白通过特异性检测试验(蛋白质印迹)检测出这两种蛋白都具有较强的特异性.蛋白免疫小鼠后,pET-28a-SAG1组应激反应大于pET-28a-F-SAG1组,且免疫部位脓肿.在效价测定的结果中,pET-28a-SAG1和pET-28a-F-SAG1组抗体的效价均大于12 800,虽然弗氏佐剂pET-28a-SAG1组的效价优于分子佐剂pET-28a-F-SAG1组,但弗氏佐剂pET-28a-SAG1组对小鼠产生了一定的应激反应,且注射部位出现了脓肿.因此,弗氏佐剂不适合动物的临床应用.弗氏佐剂主要激发抗体反应,在细胞免疫方面效果较差.鞭毛素作为TLR5的配体,可以活化机体的先天性免疫系统,进而激发较好的体液免疫应答和细胞免疫应答.鞭毛素是否可以激发弓形虫SAG1蛋白的细胞免疫应答,需要进一步试验研究.本试验中,鞭毛素可以促进与其融合表达的抗原产生高效价的抗体反应,可以应用于弓形虫亚单位疫苗研究.
[1] 杜海娟.弓形虫pVAX1-SAG1和pVAX1-SAG4基因疫苗的构建及动物免疫保护性的研究[D].南宁:广西医科大学,2014.
[2] ZOU F C, SUN X T, XIE Y J, et al. Seroprevalence ofToxoplasmagondiiin pigs in southwestern China [J]. Parasitology International, 2009,58(3):306-307.
[3] 张念章.弓形虫CDPKs核酸疫苗及重组亚单位疫苗的免疫保护性研究[D].北京:中国农业科学院,2014.
[4] DODDS E M. Toxoplasmosis [J]. Current Opinion in Ophthalmology, 2006,17(6):557-561.
[5] PENG Z, CHEN Z, LI H L, et al.Toxoplasmagondii, infection in humans in China [J]. Parasites & Vectors, 2011,4(1):1-9.
[6] SMITH A T, TUCKERSAMARAS S D, FAIRLAMB A H, et al. MYST family histone acetyltransferases in the protozoan parasiteToxoplasmagondii[J]. Eukaryotic Cell, 2005,4(12):2 057-2 065.
[7] 蒲元华,王艳华,王萌,等.抗弓形虫药物及机理研究进展[J].中国人兽共患病学报,2012,28(4):389-392.
[8] ZHANG N Z, CHEN J, WANG M, et al. Vaccines againstToxoplasmagondii: new developments and perspectives [J]. Expert Review of Vaccines, 2013,12(11):1 287-1 299.
[9] 朱思梅,周亚萍,朱荫昌,等.弓形虫表面抗原SAG1的可溶性表达及其免疫学活性分析[J].中国病原生物学杂志,2011,6(11):816-818,812.
[10] JONGERT E, ROBERTS C W, GARGANO N, et al. Vaccines againstToxoplasmagondii: challenges and opportunities [J]. Mem Inst Oswaldo Cruz, 2009,104(2):252-266.
[11] 李瑾,肖婷,黄炳成,等.弓形虫pc DNA3-P30-ROP2-HSP70复合核酸疫苗免疫保护性的研究[J].中国人兽共患病学报,2012,28(1):56-62.
[12] REICHHART J M. TLR5 takes aim at bacterial propeller [J]. Nature Immunology, 2003,4(12):1 159-1 160.
[13] CARON G, DULUC D, FRÉMAUX I, et al. Direct stimulation of human T cells via TLR5 and TLR7/8: Flagellin and R-848 up-regulate proliferation and IFN-γ production by memory CD4+T cells [J]. Journal of Immunology, 2005,175(3):1 551-1 557.
[14] 潘杭君,孙红祥.免疫佐剂的研究进展[J].中国兽药杂志,2004,38(1):32-37.
[15] HUIJBERS E J M, FEMEL J, ANDERSSON K, et al. The non-toxic and biodegradable adjuvant Montanide ISA 720/CpG can replace Freund′s in a cancer vaccine targeting ED-B—a prerequisite for clinical development [J]. Vaccine, 2012,30(2):225-230.
[16] 游猛,潘志明,耿士忠,等.鼠伤寒沙门菌鞭毛蛋白与新城疫病毒F蛋白的融合表达及免疫原性分析[J].动物医学进展,2010,31(2):20-25.
[17] TALLANT T, DEB A, KAR N, et al. Flagellin acting via TLR5 is the major activator of key signaling pathways leading to NF-κB and proinflammatory gene program activation in intestinal epithelial cells [J]. BMC Microbiology, 2004,4(1):33.
(责任编辑:施晓棠)
The effect of molecular adjuvant flagellin on the humoral immunity ofToxoplasmagondiiinduced by subunit vaccine
HUANG Juhui, GONG Lizhen, TANG Jingjing, HUANG Zhijian, YIN Guangwen
(College of Animal Science/Engineering Laboratory of Animal Pharmaceuticals, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Flagellin, a ligand for TLR5, can be an effective adjuvant for vaccine. In this study, we coexpressed the flagellin andToxoplasmagondiiimmune dominant antigen SAG1 (surface antigen 1), the immunogenicity of SAG1 and adjuvant property of flagellin for SAG1 protein in mice were investigated. SAG1 was amplified by PCR, and inserted into prokaryotic expression vector to construct expression plasmid pET-28a-SAG1. Then SAG1 was inserted into pET-28a-F to construct expression plasmid pET-28a-F-SAG1. Subsequently, these 2 plasmids were transformed into BL21 (DE3)E.coliand expressed. Purified proteins were intramuscularly injected with the same amount of adjuvant in mice, and immuned at an interval of 2 weeks. After 3 immunization, the serum was obtained and the titer of the polyclonal antibody was evaluated by ELISA. The results showed that SAG1 protein was 30 ku and F-SAG1 was 70 ku. ELISAD450 nmvalues were twice more than the negative control, indicating a high titer of the polyclonal antibody. In conclusion, flagellin can be an effective adjuvant to promote the humoral immunity of subunit vaccine.
Toxoplasmagondii; surface antigen 1 (SAG1); flagellin; humoral immunity
2016-09-15
2016-10-26
国家自然基金青年项目(31502058);福建省自然科学基金面上项目(2015J01075);福建省中青年教师教育科研项目 (JA15159);大学生创新创业训练计划项目(201610389148、201510389029).
黄驹辉(1990-),男,硕士研究生.研究方向:兽医寄生虫学.Email:237829164@qq.com.通讯作者殷光文(1983-),男,副教授,博士.研究方向:兽医寄生虫与分子生物学.Email:yinguangwen000@sina.com.
S852.4
A
1671-5470(2017)03-0318-05
10.13323/j.cnki.j.fafu(nat.sci.).2017.03.014
