猪流行性腹泻病毒M蛋白的原核表达
2017-06-15刘梦茜李春燕陈仕怡袁晓琴王全溪
刘梦茜, 李春燕, 陈仕怡, 袁晓琴, 星 东, 王全溪
(福建农林大学动物科学学院,福建 福州 350002)
猪流行性腹泻病毒M蛋白的原核表达
刘梦茜, 李春燕, 陈仕怡, 袁晓琴, 星 东, 王全溪
(福建农林大学动物科学学院,福建 福州 350002)
本试验设计了M基因的特异性引物,扩增了M基因,成功构建了重组质粒,并转化至EscherichiacoliBL21 (DE3)感受态细胞中,优化了异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达条件.结果表明,重组表达的融合蛋白Pet-32a-M大小约为43 ku,与预期大小相符.十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测表明,M蛋白为包涵体蛋白,且在IPTG浓度为0.8 mmol·L-1,温度为37 ℃,诱导时间为8 h的条件下,蛋白表达效果最佳.蛋白免疫印迹检测结果进一步显示,重组蛋白Pet-32a-M在体外可以被成功表达.
猪流行性腹泻病毒; M蛋白; 原核表达
猪流行性腹泻是由流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)感染所引起的一种死亡率较高的肠道传染性疾病,以食欲下降、呕吐、腹泻和脱水为主要临床症状[1].临床研究表明,猪流行性腹泻对未断奶仔猪的危害较大,其感染率可达100%[2-3],给我国的养猪业及养殖户带来了很大影响.目前对猪流行性腹泻无有效的药物进行治疗[4],研制并应用基因工程疫苗是预防该病较为重要的途径.
本试验对分离到的PEDV毒株进行测序,并在NCBI数据库中进行遗传进化树分析发现,该PEDV毒株为经典毒株,与经典毒株的同源性达到98%.PEDV属冠状病毒属,有5个开放阅读框(ORF),编码4种主要的结构蛋白.PEDV S蛋白是病毒粒子表面的纤突蛋白,主要参与病毒与宿主细胞的吸附和融合,并能诱导宿主产生中和抗体[5].但近年来的研究发现,S蛋白在受到宿主免疫选择的压力下易发生变异,导致宿主范围和毒力发生改变[6].相关文献表明,2010年在我国已免疫猪群中爆发的猪流行性腹泻是由变异的PEDV毒株引发的,且变异主要集中在S蛋白[7].因此,PEDV-S基因的变异可能是导致猪PEDV疫苗免疫效果不佳的原因.
M蛋白是PEDV另一主要结构蛋白,是冠状病毒外膜最主要的成分,它的一级结构域对于病毒的装配极为重要[8].M蛋白为跨膜蛋白,较为保守,能诱导宿主α-干扰素的表达,并能刺激机体产生相应的抗体[9],在补体存在的条件下可中和病毒[10-11].因此,M蛋白可作为PEDV基因工程疫苗的候选抗原.但大量研究表明,M蛋白在体外较难表达,出现表达量低或不表达的情况.高慎阳等[12]对M蛋白的体外表达进行了尝试,但仅表达出其膜外区;另外,吴凌等[13]构建了Pet-30a原核表达载体,并在不同的宿主细胞中反复尝试诱导表达,但均未获得成功.尽管在很多文献中都有涉及M蛋白原核表达载体的构建,但在诱导表达的过程中缺乏细致的诱导条件的摸索,这可能会导致蛋白表达量低或不表达.可见,M蛋白体外的高度表达还存在一定的问题,为提高M蛋白的体外表达,本试验研究能够有效稳定表达PEDV M蛋白的方法和体系,并通过优化条件提高M蛋白的表达量.
1 材料与方法
1.1 材料
1.1.1 病毒及表达载体 PEDV FJ-Fuzhou毒株由本实验室分离并保存;表达载体为Pet-32a(+)(Promega北京生物技术有限公司);DH-5α和EscherichiacoliBL21(DE3)感受态细胞购自Promega北京生物技术有限公司.
1.1.2 试剂与仪器 病毒RNA提取试剂盒和反转录试剂盒购自普洛麦格北京生物技术有限公司;BamHⅠ和SalⅠ快切限制酶、高纯度质粒小提中量试剂盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒购自博士德生物技术有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白分子质量标准(10~120 ku)和超级ECL发光试剂盒购自赛默飞世尔科技公司.
主要仪器有DL777型PCR仪(北京东林生物技术公司)、DYY16D电泳仪(北京六一生物技术有限公司)、Bio-Rad凝胶成像分析系统(美国Bio-Rad公司).
1.2 病毒RNA的提取
将本实验室保存的病毒液进行病毒RNA的提取,置冰箱(-80 ℃)保存.
1.3 引物设计与合成
参照NCBI数据库中已上传的PEDV M蛋白基因序列(KX253991.1),采用DNAStar软件设计特异性引物(酶切位点为标有下划线的碱基序列):上游引物——CGGGATCCATGTCTAACGGTTCTATTCC(BamHⅠ);下游引物——GCGTCGACTTAGACTAAATGAAGCACT(SalⅠ).将加有酶切位点的引物送至合成,扩增697 bp的M蛋白基因片段.
1.4 目的基因的PCR扩增
将低温保存的病毒RNA反转录成cDNA,再经PCR反应扩增获得目的基因片段.经琼脂糖凝胶电泳后,将697 bp的目的基因片段条带胶回收纯化.
1.5 重组表达质粒的构建与鉴定
纯化的目的片段产物和Pet-32a质粒分别经BamHⅠ和SalⅠ双酶切后于4 ℃连接,转化至DH-5α感受态细胞中,并进行涂板(加有氨苄的LB培养板),第2天挑取阳性菌落进行PCR鉴定,并提取质粒进行双酶切鉴定,将鉴定为阳性的质粒送至测序.
1.6 重组质粒在E.coliBL21(DE3)中的诱导表达
将Pet-32a-M重组质粒转化至E.coliBL21(DE3)中,挑取转化后过夜培养的白色单克隆菌落接种于1 mL的加有氨苄的液体LB培养基中扩大菌量,并用分光光度计检测菌液浓度.当D600 nm=1.0时,取出等量的两份菌液,一份加入终浓度为1 mmol·L-1的IPTG蛋白诱导剂进行处理,另一份则取等量的PBS作为对照,同时设置E.coliBL21(DE3)空白菌诱导组和转入Pet-32a(+)的空载体菌诱导组作为对照.将4组菌液置于相同的诱导条件下进行蛋白诱导,并进行SDS-PAGE检测.
1.7 Pet-32a-M蛋白诱导表达体系的优化
1.7.1 IPTG最佳诱导浓度的优化 保存的阳性克隆菌复苏后,按照1∶100的比例接种于加有氨苄的LB培养基,置250 r·min-1、37 ℃的摇床中,分别加入不同梯度终浓度(0、0.2、0.4、0.6、0.8、1.0、1.2和1.5 mmol·L-1)的诱导剂IPTG进行诱导,各组诱导时间和温度保持一致,并进行SDS-PAGE检测,最终确定最佳的诱导浓度.
1.7.2 IPTG最佳诱导时间的优化 在确定的最佳诱导浓度下,其他培养条件不变,分别在不同诱导时间点(0、2、4、6、8和10 h)取样进行蛋白变性,接着各取20 μL蛋白样品进行SDS-PAGE检测,确定最佳的诱导时间.
1.7.3 IPTG最佳诱导温度的优化 在确定的最佳诱导浓度和时间下对菌液进行诱导,并分别置于不同梯度的温度(25、28、31、34、37和40 ℃)下进行诱导表达,蛋白变性后,取20 μL蛋白样品进行SDS-PAGE检测,以确定最佳的诱导温度.
1.8 重组M蛋白的蛋白免疫印迹检测
变性的重组蛋白32a-M经SDS-PAGE分离后,采用转印槽进行免疫印迹,随后采用一抗和二抗进行免疫杂交,并用ECL显色液进行曝光.
2 结果与分析
2.1 PEDV-M基因的PCR扩增结果
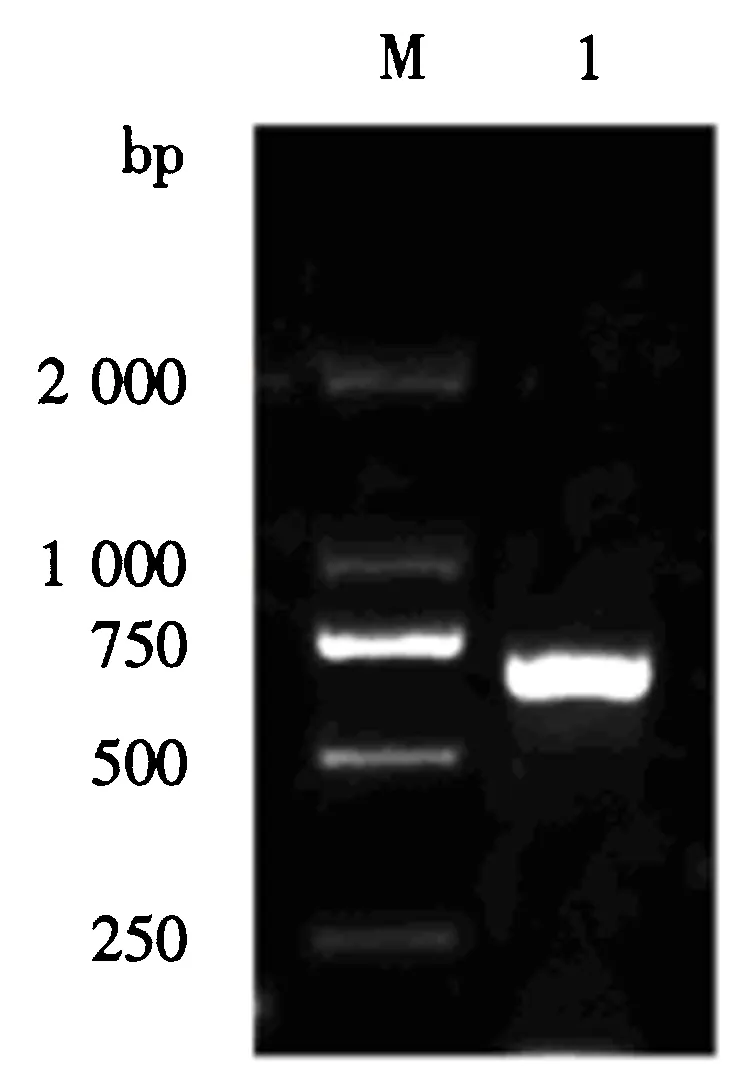
M:DNA分子质量标准;1:M基因扩增产物.图1 M基因的PCR扩增电泳图Fig.1 Electrophoretogram of PCR amplified M gene
将PEDV FJ-Fuzhou毒株的基因组作为模板,以M基因的上、下游引物为扩增引物进行PCR扩增.PCR扩增片段经琼脂糖凝胶电泳,得到一条大小约为697 bp的特异性条带(图1),与预期的片段大小相符.表明该引物对PEDV FJ-Fuzhou毒株M基因片段的扩增具有特异性,并得到PEDV FJ-Fuzhou毒株M基因序列.
2.2 重组表达质粒的鉴定结果
挑选白色单克隆菌为模板,分别用M基因上、下游引物,M基因上游引物和T7下游引物,目的基因下游引物和T7上游引物,T7上、下游引物对阳性克隆菌落进行PCR鉴定.结果(图2)显示,分别在697、805、1 272和1 380 bp处得到相应的目的条带.PCR鉴定后,提取重组质粒进行酶切鉴定.结果(图3)显示,转入目的片段的重组质粒相对于空质粒的位置较高,且双酶切后分离出大小约为697 bp的片段,与预期片段的大小一致.鉴定结果表明,PEDV M蛋白已成功克隆至Pet-32a载体中.测序结果进一步表明,重组质粒(Pet-32a-M)成功构建,无移码错误.

M:2 000 bp DNA分子质量标准;1:M基因上、下游引物的扩增产物;2:M基因上游引物、T7下游引物的扩增产物;3:M基因下游引物、T7上游引物的扩增产物;4:M基因上、下游引物的扩增产物.图2 PCR鉴定电泳图Fig.2 Identification of M gene via electrophoretogram
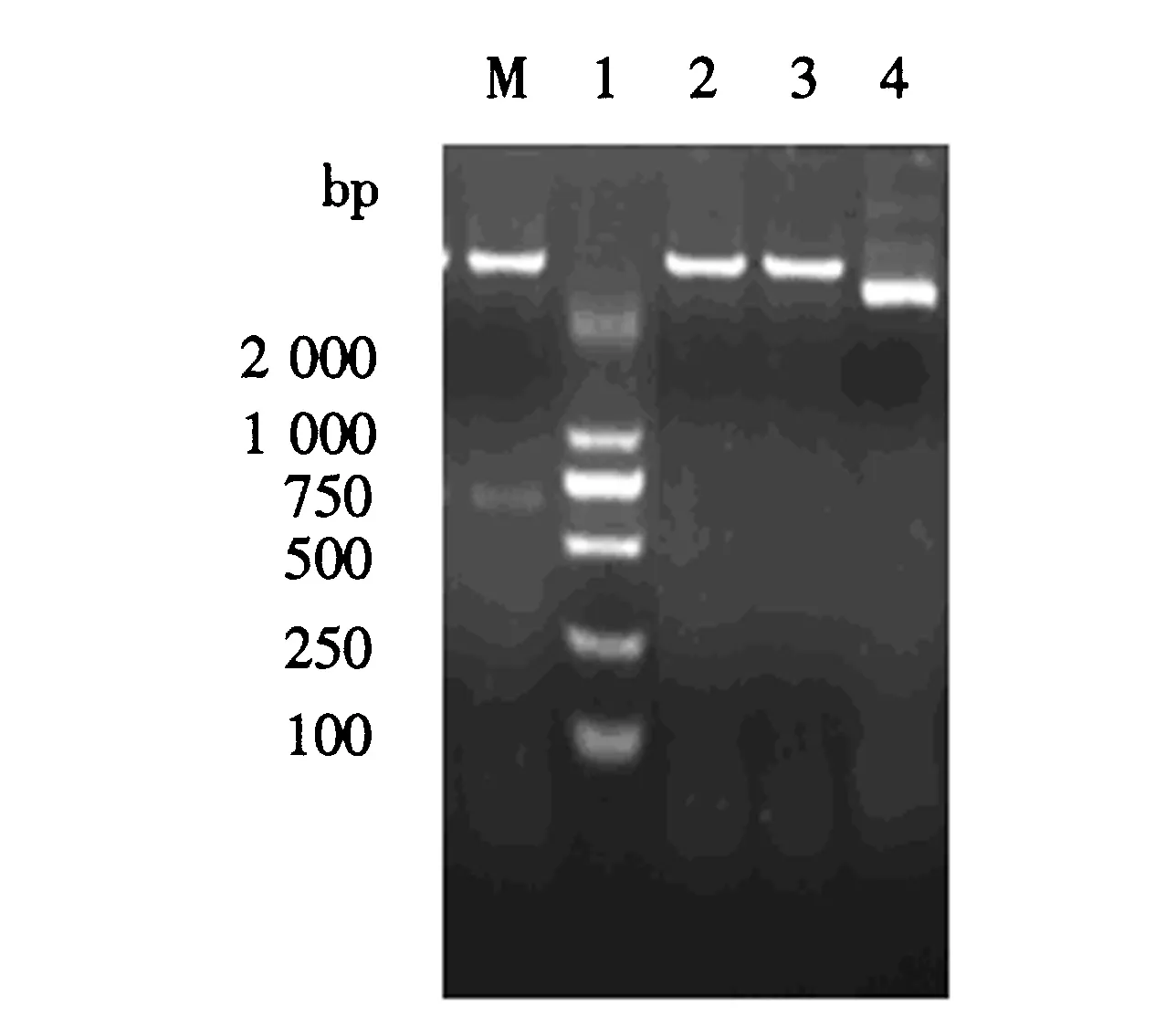
图3 PCR酶切鉴定电泳图Fig.3 Electrophoresis identification of pET-32a-M by restriction enzyme digestion
2.3 诱导的Pet-32a-M蛋白的SDS-PAGE检测结果
由Pet-32a(+)表达载体图谱可见,载体自身可表达多个标签多肽蛋白,整个融合多肽大小约为20 ku.通过DNAMAN软件分析可知,M蛋白的预测分子质量约为23.6 ku,因此,重组质粒诱导表达出的预期目的蛋白大小约为43.6 ku.取诱导后的重组质粒菌离心,分别取上清和沉淀变性,SDS-PAGE检测结果(图4A)显示,在沉淀中出现与预期大小相同的蛋白,而在空质粒菌和上清中未出现,表明该蛋白为包涵体蛋白.接着取Pet-32a-M重组质粒菌沉淀,在IPTG诱导的条件下,可明显表达出大小约为43 ku的特异性条带,同样条件诱导下的空白菌和Pet-32a空载体菌均未出现该特异性条带(图4B).同时对比未诱导的Pet-32a-M重组质粒菌和诱导后的Pet-32a-M重组质粒菌,可见诱导后的重组菌出现的特异性条带的亮度明显大于未诱导的重组菌.此外,Pet-32a(+)空载体菌诱导组与空白菌相比,可见一条大小约为20 ku的条带,这也与预期的空载体标签蛋白大小相符.
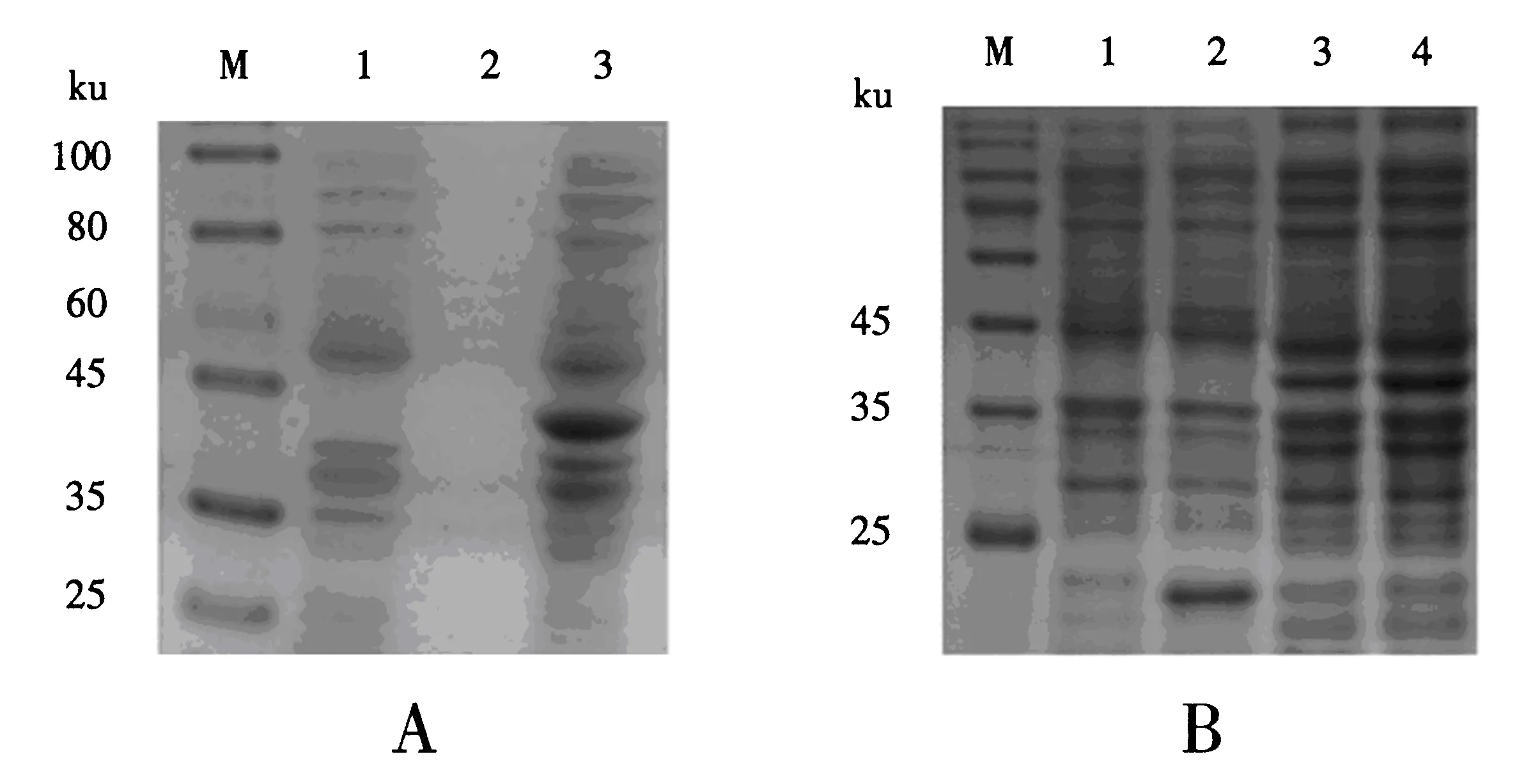
A:可溶性的重组质粒表达产物(M:蛋白质分子质量标准;1:空白诱导组;2:上清;3:沉淀);B:IPTG诱导的重组质粒表达产物(M:蛋白质分子质量标准;1:空白诱导组;2:空载体菌诱导组;3:重组质粒菌未诱导组;4:重组质粒菌诱导组).图4 E.coli BL21(DE3)中重组菌诱导表达的SDS-PAGE电泳图Fig.4 SDS-PAGE analysis of the recombinant protein expressed in E.coli BL21 (DE3)
2.4 32a-M诱导表达条件的优化
2.4.1 IPTG最佳诱导浓度的优化 在37 ℃下,用不同浓度的IPTG进行诱导,SDS-PAGE检测结果(图5)显示:IPTG终浓度为0~0.6 mmol·L-1时,蛋白条带较暗且变化不大;IPTG终浓度为0.8~1.5 mmol·L-1时,蛋白条带的亮度有所增大,且在0.8 mmol·L-1时最亮.可见,Pet-32a-M重组质粒菌在IPTG终浓度为0.8 mmol·L-1时的表达量最大.
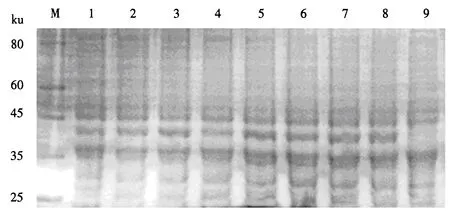
M:蛋白质分子质量标准;1~8:IPTG浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2和1.5 mmol·L-1时诱导的重组质粒菌组;9:空白诱导组.图5 重组蛋白诱导浓度优化的SDS-PAGE电泳图Fig.5 Electrophoretogram of the induced recombinant protein under the optimum IPTG concentration by SDS-PAGE
2.4.2 IPTG最佳诱导时间的优化 在IPTG终浓度为1.0 mmol·L-1,温度为37 ℃的条件下,检测Pet-32a-M重组质粒菌在0、2、4、6、8和10 h的表达情况.SDS-PAGE检测结果(图6)显示:诱导0和2 h时,蛋白条带较暗;诱导4 h时,蛋白条带的亮度明显增强,且在4~8 h时亮度逐渐递增,在8 h时达到最亮.可见,在IPTG终浓度为1.0 mmol·L-1,温度为37 ℃的条件下,Pet-32a-M重组质粒菌在诱导8 h时的表达量最大.
2.4.3 IPTG最佳诱导温度的优化 在IPTG终浓度为0.8 mmol·L-1,诱导8 h的条件下,检测Pet-32a-M重组质粒菌在25、28、31、34、37和40 ℃下的表达情况.SDS-PAGE检测结果(图7)显示,37 ℃下诱导的蛋白条带最亮.可见,37 ℃为最适诱导温度.
2.5 32a-M蛋白的蛋白免疫印迹检测结果
为验证Pet-32a-M重组质粒菌诱导后是否是预期的目的蛋白并验证该蛋白是否具有活性,分别以His·Tag标签蛋白的抗体和PEDV阳性血清作为一抗,对诱导变性后的蛋白进行蛋白免疫印迹检测.结果显示,以His·Tag标签蛋白抗体作为一抗的重组质粒菌组和空质粒菌组分别在43和20 ku左右的位置出现了特异性条带,而空白菌组未出现任何条带(图8A),该结果可进一步证明Pet-32a-M蛋白在体外成功表达.采用PEDV阳性血清作为一抗的蛋白免疫印迹检测结果(图8B)表明,PEDV M蛋白的体外表达具有一定的抗原活性.
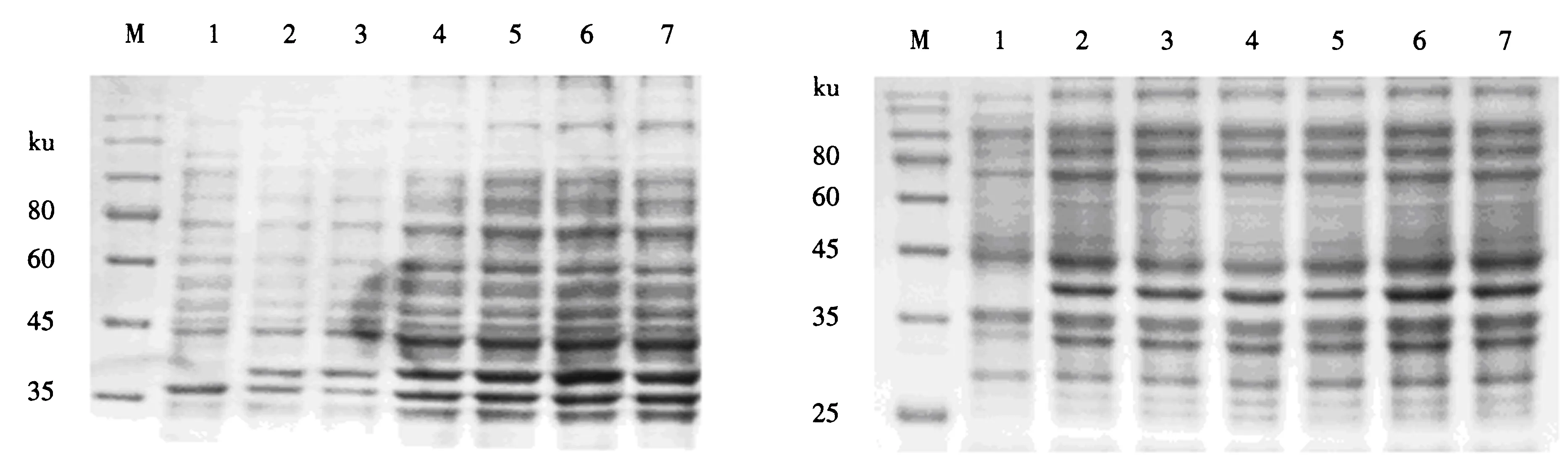
M:蛋白质分子质量标准;1:空白诱导组;2~7:分别为诱导0、2、4、6、8和10 h时的重组质粒菌组.图6 重组蛋白诱导时间优化的SDS-PAGE电泳图Fig.6 Electrophoretogram of the induced recombinant protein under the optimum expression time by SDS-PAGE
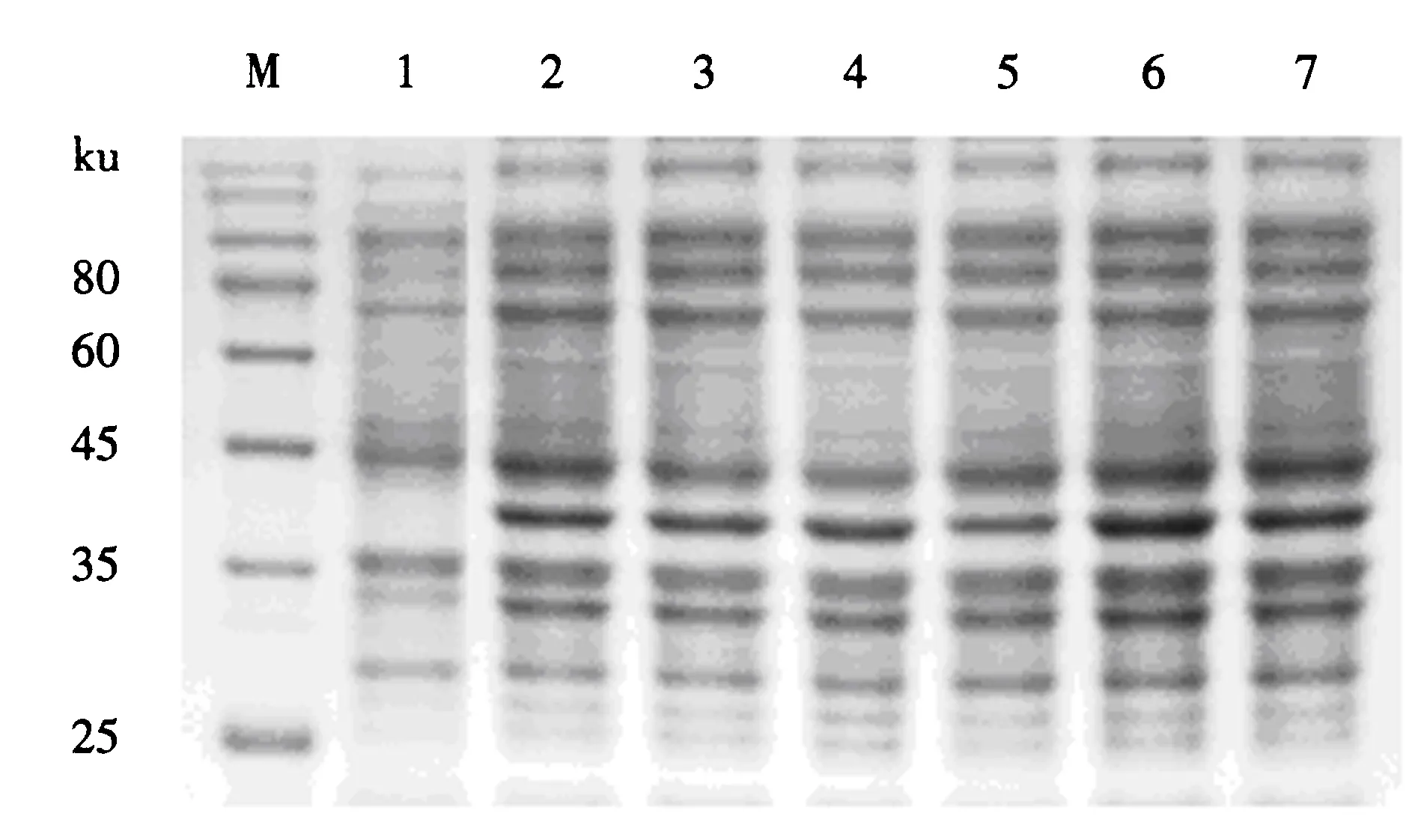
M:蛋白质分子质量标准;1:空白诱导组;2~7:分别在25、28、31、34、37和40 ℃下诱导的重组质粒菌组.图7 重组蛋白诱导温度优化的SDS-PAGE电泳图Fig.7 Electrophoretogram of the induced recombinant protein under the optimum temperature by SDS-PAGE
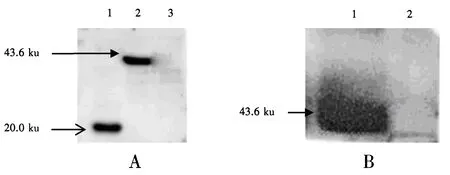
A:以His·Tag抗体为一抗(1:空质粒菌组;2:重组质粒菌组;3:空白菌组);B:以PEDV血清为一抗(1:阳性血清组;2:阴性血清组).图8 蛋白免疫印迹检测电泳图Fig.8 Electrophoretogram of the recombinant Pet-32a-M by Western blot
3 讨论
研究表明,冠状病毒M蛋白表达较为困难,且不稳定,少部分动物(如猪、犬等)的M蛋白得到表达,但表达结果不理想,或表达不稳定[14-15].张志榜[16]、Gao et al[17]通过将M蛋白基因设计为不同大小的片段并结合融合蛋白进行原核表达的方法,能够稳定地将各个片段稳定表达,但只有膜外区获得了高度表达,且没能表达出M蛋白全序列.有研究表明:M蛋白具有抑菌作用,能使细胞膜破裂,导致细胞凋亡,因此在表达过程中很难实现大量表达,且表达不稳定[18-19];当蛋白浓度达到一定量时,会对菌体产生一定的抑制作用,即对宿主产生毒性作用[20].但郑芳园等[21]研究表明,通过对M蛋白的亲水区进行原核表达并不会在表达过程中出现抑菌或导致细菌死亡现象的发生.目前对于M蛋白是如何作用于细胞的机制尚不是很清楚,因此,为提高M蛋白体外的表达量,本试验对诱导条件进行了优化,并明确了M蛋白表达的最佳诱导条件.优化结果表明,Pet-32a-M重组质粒菌在37 ℃,IPTG终浓度为0.8 mmol·L-1,诱导时间为8 h的条件下诱导,蛋白的表达量最高.
猪流行性腹泻是一种高度接触性肠道传染病,不同种群和不同年龄阶段的猪均易感,但对不同年龄阶段猪的致死率有所差异,其中对仔猪的致死率最高.对猪的腹泻病检测显示,流行性腹泻病例占46%,其中,混合感染的病例占31%[22],这表明流行性腹泻在我国腹泻性疾病中占主要地位.自20世纪80年代开始,PEDV在我国各地开始蔓延,并使用相应的二联苗和弱毒苗进行免疫预防.近年来,PEDV疫苗的免疫效果渐渐不理想,经典疫苗株CV777弱毒疫苗对变异株引起的流行性腹泻的免疫效果不佳.通过对PEDV疫苗毒株的全基因组序列与我国临床毒株的同源性比较发现,两者存在较大的差异[23];对变异毒株进行序列分析发现,S基因是PEDV变异最大的区域[24].变异株中S基因的突变或缺失都会使毒株之间的免疫原性存在较大的差异,导致疫苗免疫效果不佳.研究表明,M蛋白较为保守,是病毒刺激机体产生免疫保护的重要结构蛋白;同时,M蛋白能诱导宿主α-干扰素的表达,并能够刺激机体产生相应的抗体,是作为PEDV基因工程疫苗较为理想的候选蛋白.因此,M蛋白体外的成功表达对该蛋白功能的探索以及基因工程疫苗的研发都具有重要的意义.
[1] 宋世阳.猪流行性腹泻流行特点及流行现状的研究[J].当代畜牧,2016(14):117.
[2] 苏运芳,孙彦刚,刘运超,等.猪流行性腹泻疫苗研究进展[J].畜牧与兽医,2016,48(2):134-138.
[3] 杜晓莉,王一成,吴润,等.2010—2013年浙江省猪流行性腹泻病毒临床检测及PEDV-S基因型分析[J].浙江农业学报2014,26(3):581-587.
[4] 王靓靓,李训良,李鹏冲,等.猪流行性腹泻的诊断与预防[J].世界华人消化杂志,2013(1):33-38.
[5] SATO T, TAKEYAMA N, KATSUMATA A, et al. Mutations in the spike gene of porcine epidemic diarrhea virus associated with growth adaptationinvitroand attenuation of virulenceinvivo[J]. Virus Genes, 2011,43(1):72-78.
[6] ARNDT A L, LARSON B J, HOGUE B G, et al. A conserved domain in the coronavirus membrane protein tail is important for virus assembly [J]. J Virol, 2010,84(21):11 418-11 428.
[7] 雷喜梅.PEDV变异株S、M蛋白原核表达及分泌抗S蛋白单抗杂交瘤细胞株的建立[D].郑州:河南农业大学,2015.
[8 ] PARK S J, SONG D S, PARK B K. Molecular epidemiology and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field isolates in Korea [J]. Archives of Virology, 2013,158(7):1 533-1 541.
[9] FAN J H, LI Y J. Cloning and sequence analysis of the M gene of porcine epidemic diarrhea virus LJB/03 [J]. Virus Genes, 2005,30(1):69-73.
[10] 谭博敏,蒋志琼,余希尧,等.猪流行性腹泻病毒主要结构蛋白在杆状病毒中的表达及免疫原性分析[J].畜牧与兽医,2014,46(11):14-18.
[11] ZHANG Z, CHEN J, SHI H, et al. Identification of a conserved linear B-cell epitope in the M protein of porcine epidemic diarrhea virus [J]. Virology Journal, 2012,9(1):225.
[12] 高慎阳,刘延庆,李一经.猪流行性腹泻病毒(PEDV)M蛋白原核表达载体的构建[J].中国兽医学报,2009,29(12):1 527-1 528.
[13] 吴凌,李一经.猪流行性腹泻病毒LJB/03株的分离及膜蛋白基因的原核表达[J].畜牧兽医学报,2005,36(10):1 095-1 099.
[14] UTIGER A, TOBLER K, BRIDGEN A, et al. Identification of proteins specified by porcine epidemic diarrhoea virus [J]. Adv Exp MedBiol, 1995,380(2):287-290.
[15] WANG L F, GOULD A R, SELLECK P W. Expression of equine morbillivirus (EMV) matrix and fusion proteins and their evaluation as diagnostic reagents [J]. Arch Virol, 1997,142(11):2 269-2 279.
[16] 张志榜.猪流行性腹泻病毒膜蛋白和核蛋白抗原表位的鉴定[D].北京:中国农业科学院,2011.
[17] GAO S Y, ZHA E H. High-level prokaryotic expression of envelop exterior of membrane protein of porcine epidemic diarrhea virus [J]. Vet Microbiol, 2007,123(1-3):187-193.
[18] KOPECKY S A, LYLES D S. Contrasting effects of matrix protein on apoptosis in HeLa and BHK cells infected with vesicular stomatitis virus are due to inhibition of host gene expression [J]. Journal of Virology, 2003,77(8):4 658-4 669.
[19] 蒋梅,王印,杨泽晓,等.猪流行性腹泻病毒的分离鉴定及其M蛋白截段基因编码氨基酸的生物学分析[J].中国兽医学报,2013,33(2):195-200.
[20] CHEN J F, SUN D B, WANG C B, et al. Molecular characterization and phylogeneticanalysis of membrane protein genes of porcine epidemic diarrhea virus isolates in China [J]. Virus Genes, 2008,36(2):355-364.
[21] 郑芳园,陈攀,范宝超,等.猪流行性腹泻病毒M和S蛋白的原核表达及多克隆抗体的制备[J].畜牧与兽医,2014,46(5):35-40.
[22] 甘振磊,汤德元,李春燕,等.猪流行性腹泻流行特点及流行现状的研究[J].猪业科学,2010,27(12):24-28.
[23] 王晓飞.猪流行性腹泻弱毒疫苗毒株的全基因组克隆与序列分析[D].武汉:华中农业大学,2013.
[24] 郭春和,黄毓茂,项林盛,等.猪流行性腹泻病毒结构蛋白及疫苗的研究进展[J].畜牧与兽医,2011,43(12):83-87.
(责任编辑:施晓棠)
Prokaryotic expression of porcine epidemic diarrhea virus M protein
LIU Mengxi, LI Chunyan, CHEN Shiyi, YUAN Xiaoqin, XING Dong, WANG Quanxi
(College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
To increase the expression level of M protein which is a candidate antigen for porcine epidemic diarrhea virus, specific primer forMgene was designed and amplified. The positive recombinant plasmid was identified and transformed intoEscherichiacoliBL21 (DE3) competent cell, and followed by being induced by isopropyl β-D-thiogalactoside (IPTG). Then the inducible expression system was optimized in terms of IPTG concentration, expression time and temperature. Results showed that the recombinant protein was successfully expressed, with the molecular weight being about 43 ku. SDS-Polyacrylamide gelelectrophoresis (SDS-PAGE) analysis indicated that M protein is an inclusion body protein. The optimal induction conditions were to add 0.8 mmol·L-1IPTG and be induced at 37 ℃ for 6 h. In addition, Western-blot contfirmed that the recombinant plasmid Pet-32a-M was transformed intoE.coliBL21 (DE3) competent cell and successfully expressedinvitro.
porcine epidemic diarrhea virus; membrane protein; procaryotic expression
2016-10-24
2016-12-31
福建农林大学科学发展基金资助项目(KF2015094).
刘梦茜(1993-),女,硕士.研究方向:动物传染病.Email:1241658150@qq.com.通讯作者王全溪(1978-),男,副教授.研究方向:宿主与病原互作.Email:wqx608@126.com.
S852.65+1
A
1671-5470(2017)03-0299-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.03.011
