不同Hp感染状态下血清胃泌素-17对胃窦萎缩的诊断价值*
2017-06-15朱春平赵建业孙明军许建明蔡全才杜奕奇李兆申
朱春平 赵建业 钱 维 孙明军 刘 卫 许建明 蔡全才 杜奕奇 李兆申
第二军医大学附属长海医院消化科1(200433) 中国医科大学第一附属医院消化科2 中国人民解放军105医院消化科3 安徽医科大学第一附属医院消化科4
不同Hp感染状态下血清胃泌素-17对胃窦萎缩的诊断价值*
朱春平1赵建业1钱 维1孙明军2刘 卫3许建明4蔡全才1杜奕奇1李兆申1
第二军医大学附属长海医院消化科1(200433) 中国医科大学第一附属医院消化科2中国人民解放军105医院消化科3安徽医科大学第一附属医院消化科4
背景:慢性萎缩性胃炎(CAG)是胃癌的癌前病变。血清胃泌素-17(G-17)诊断CAG的研究结果差异较大,推测幽门螺杆菌(Hp)感染在其中起重要作用。目的:探讨Hp感染对血清G-17水平的影响,以及在不同Hp感染状态下血清G-17诊断CAG的价值。方法:纳入2014年5月—2015年5月三家不同医院的204例非萎缩性胃炎患者和81例CAG患者。行胃镜检查,以ELISA法检测空腹血清G-17、餐后血清G-17和幽门螺杆菌抗体IgG(Hp-IgG)。结果:Hp阳性组空腹血清G-17水平显著高于Hp阴性组(P=0.001),CAG组餐后血清G-17水平显著低于非萎缩组(P=0.002)。空腹血清G-17诊断Hp阳性和Hp阴性CAG的AUC分别为0.634(95% CI: 0.537~0.732)和0.576(95% CI: 0.478~0.675),准确率分别为62.6%和54.9%。餐后血清G-17诊断Hp阳性和Hp阴性CAG的AUC分别为0.675(95% CI: 0.581~0.769)和0.595(95% CI: 0.495~0.694),准确率分别为61.8%和53.1%。结论:Hp感染对血清G-17水平有一定影响,因而在不同Hp感染状态下血清G-17诊断CAG的价值存在差异。空腹和餐后血清G-17诊断Hp阳性CAG的价值高于Hp阴性CAG。
胃泌素-17; 幽门螺杆菌; 胃炎,萎缩性; 诊断
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)系指胃黏膜固有腺体减少的一类慢性胃炎,病变组织常被纤维组织代替,或出现肠化生。我国慢性胃炎共识[1]指出,CAG的发病率约为35.1%。CAG是一种癌前疾病,与肠型胃癌密切相关[2]。CAG的诊断主要通过内镜和活检明确,但为有创性检查。目前北欧和意大利等国家逐渐兴起无创血清学诊断法,通过检测胃蛋白酶(pepsinogen,PG)、胃泌素-17(gatrin-17,G-17)、幽门螺杆菌抗体IgG(Hp-IgG)等血清学指标诊断CAG[3-4],其中G-17对胃窦萎缩具有重要的提示作用。然而,G-17的分泌受Hp感染和胃内pH值等多种因素的影响,因此诊断胃窦萎缩的准确率差异较大。本研究通过检测空腹和餐后血清G-17以及Hp-IgG,旨在探讨血清G-17与CAG的相关性,并分析Hp对血清G-17诊断CAG的影响。
对象与方法
一、研究对象
本研究为连续病例、多中心横断面研究。选取2014年5月—2015年5月第二军医大学附属长海医院、安徽医科大学第一附属医院和中国人民解放军105医院消化内科因各种胃部不适就诊的患者。纳入标准:①年龄18~70周岁,性别不限;②经胃镜和组织病理学检查确诊为慢性非萎缩性胃炎和CAG患者。排除标准:①入组前2周内服用过影响本试验观察的药物(包括质子泵抑制剂、H2受体拮抗剂等);②曾接受过胃部手术者(包括外科手术和内镜下手术);③有严重的心、肝、肾功能不全,严重的神经病变或精神疾患者;④对乳糖或蛋白质粉不耐受者;⑤研究者认为不适合参加本试验者。
二、研究方法
1.胃镜检查:入选者接受胃镜检查,于胃窦大弯侧和小弯侧各取两块组织。常规制备石蜡切片,由经验丰富的病理科医师读片诊断。采用慢性胃炎的《直观模拟评分法》[5],判断萎缩情况。
2.血清G-17和Hp-IgG测定:采用ELISA法检测空腹血清G-17、餐后血清G-17和Hp-IgG(试剂盒均购自芬兰Biohit公司)。入选者停止抽烟、饮酒,2周前停服抑酸药,前1 d停服胃黏膜保护剂,空腹10 h后采集血清5 mL,检测空腹血清G-17;入选者服用标准餐(含蛋白质77%的饮品,由芬兰Biohit公司提供)20 min后采集血清5 mL,检测餐后血清G-17。具体检测步骤按试剂盒说明进行。血清Hp-IgG>30 IU视为Hp感染,即Hp阳性。
三、统计学分析
采用SPSS 19.0统计软件,所得数据以M(P25,P75)表示,组间比较采用非参数检验。P<0.05为差异有统计学意义。
结 果
一、一般情况
研究期间共纳入285例胃炎患者,其中CAG患者81例,非萎缩性胃炎患者204例;男165例,女120例;年龄40~80岁,平均56.5岁;Hp阳性123例,感染率为43.2%。
二、Hp感染与空腹和餐后血清G-17的关系
与Hp阴性组相比,Hp阳性组空腹血清G-17水平显著升高(P=0.001),餐后血清G-17水平无明显差异(P=0.476)(表1)。
三、萎缩与空腹和餐后血清G-17的关系
与非萎缩性胃炎组相比,CAG组空腹血清G-17水平无明显差异(P=0.158),餐后血清G-17水平明显降低(P=0.002)(表2)。
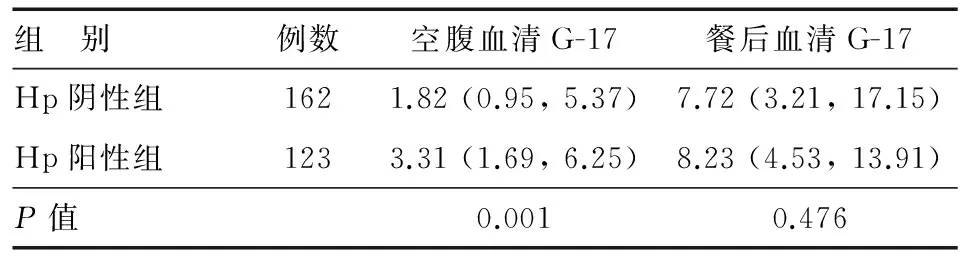
表1 不同Hp感染情况患者的空腹和餐后血清G-17水平[M (P25,P75),pmol/L]
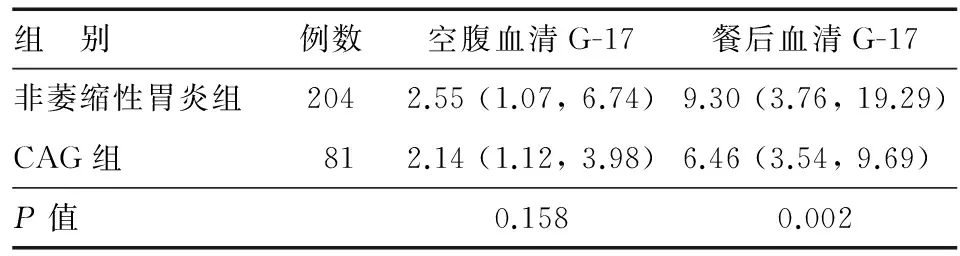
表2 不同萎缩情况患者的空腹和餐后血清G-17水平[M (P25,P75),pmol/L]
四、血清G-17诊断CAG的价值
空腹血清G-17和餐后血清G-17诊断CAG的AUC分别为0.554(95% CI: 0.487~0.620)和0.619(95% CI: 0.554~0.684)。餐后血清G-17临界值为5.93 pmol/L时,诊断CAG的准确率为60.7%(图1)。
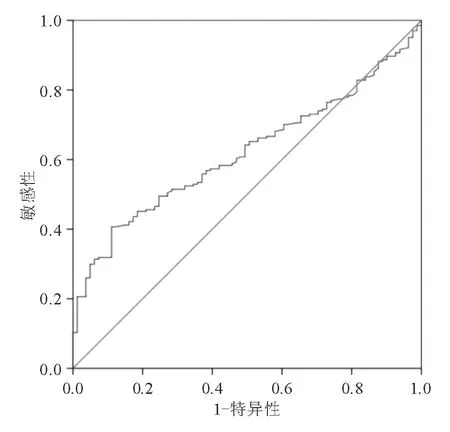
图1 餐后血清G-17诊断CAG的ROC曲线
五、Hp不同感染状态下空腹血清G-17对CAG的诊断
Hp阳性时,CAG和非萎缩性胃炎患者分别为55例和68例。空腹血清G-17诊断CAG的AUC为0.634(95% CI:0.537~0.732)(图2),其约登指数最大值为0.247,对应的临界值为2.89 pmol/L。空腹血清G-17诊断Hp阳性CAG的敏感性和特异性分别为60.0%和64.7%,阳性预测值和阴性预测值分别为57.9%和66.7%,准确率为62.6%(表3)。
Hp阴性时,CAG和非萎缩性胃炎患者分别为26例和136例。空腹血清G-17诊断CAG的AUC为0.576(95% CI:0.478~0.675)(图3),其约登指数最大值为0.089,对应的临界值为1.58 pmol/L。空腹血清G-17诊断Hp阴性CAG的敏感性和特异性分别为53.8%和55.1%,阳性预测值和阴性预测值分别为18.7%和86.2%,准确率为54.9%(表4)。
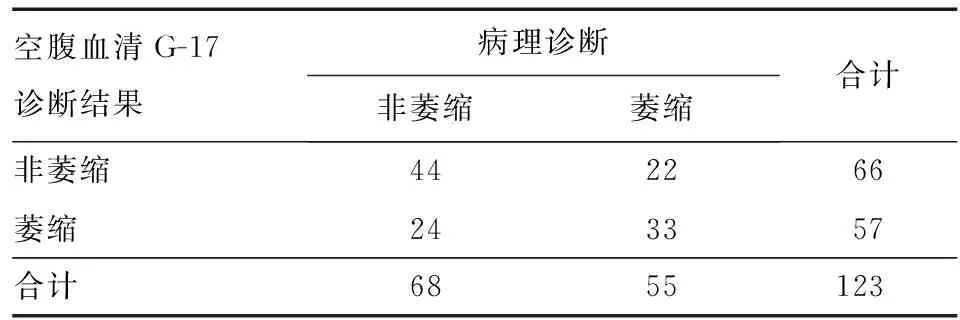
表3 Hp阳性时空腹血清G-17诊断萎缩的四格表(n)

表4 Hp阴性时空腹血清G-17诊断萎缩的四格表(n)

图2 Hp阳性时空腹血清G-17诊断CAG的ROC曲线

图3 Hp阴性时空腹血清G-17诊断CAG的ROC曲线
六、Hp不同感染状态下餐后血清G-17对CAG的诊断
Hp阳性时,餐后血清G-17诊断CAG的AUC为0.675(95% CI: 0.581~0.769)(图4),其约登指数最大值为0.191,对应的临界值为4.88 pmol/L。餐后血清G-17诊断Hp阳性CAG的敏感性和特异性分别为38.2%和80.9%,阳性预测值和阴性预测值分别为61.8%和61.8%,准确率为61.8%(表5)。
Hp阴性时,餐后血清G-17诊断CAG的AUC为 0.595(95% CI: 0.495~0.694)(图5),其约登指数最大值为0.192,对应的临界值为8.76 pmol/L。餐后血清G-17诊断Hp阴性CAG的敏感性和特异性分别为69.2%和50.0%,阳性预测值和阴性预测值分别为20.9%和89.5%,准确率为53.1%(表6)。

表5 Hp阳性时餐后血清G-17诊断萎缩的四格表(n)

表6 Hp阴性时餐后血清G-17诊断萎缩的四格表(n)
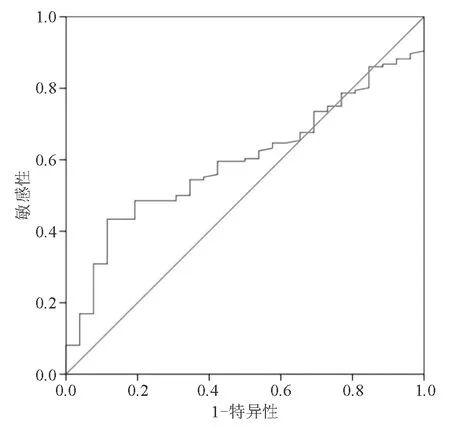
图5 Hp阴性时餐后血清G-17诊断CAG的ROC曲线
胃泌素主要由胃窦G细胞合成和分泌,经历了前胃泌素、甘氨酸延伸型胃泌素和成熟胃泌素3个阶段,前2种是未酰胺化的中间产物,成熟胃泌素是酰胺化胃泌素[6]。胃泌素的主要生理功能为刺激胃酸分泌、促进胃黏膜细胞增殖和分化。在血液循环中具有生物活性的成分主要为大分子G-34和小分子G-17[7]。
胃泌素是反映胃窦黏膜功能的良好指标,胃窦黏膜萎缩时,G细胞数量下降,血清胃泌素水平降低。Sipponen等[8]的研究显示,萎缩组空腹血清G-17和餐后血清G-17水平均明显降低。Cao等[9]的研究表明,萎缩组与对照组空腹G-17相比无明显差异(P>0.05);而胃窦萎缩组空腹血清G-17较对照组降低(P<0.05)。本研究结果表明,与非萎缩组相比,CAG组胃窦餐后血清G-17水平明显降低,而空腹血清G-17无明显差异。
Hp已被列为Ⅰ类致癌因子,可导致慢性胃炎,进而导致萎缩、肠化生、瘤变,最后进展为胃癌[10]。有研究认为Hp感染会刺激胃泌素分泌,导致血清G-17水平升高[11]。其机制主要为:Hp尿素酶分解尿素产生氨引起胃黏膜局部pH值改变,从而反馈刺激胃泌素分泌;Hp抑制生长抑素释放,从而减弱生长抑素对胃泌素分泌的抑制作用;Hp刺激胃黏膜分泌炎性介质,从而引起胃窦G细胞增殖[12]。
Zhang等[13]对3 805例患者检测血清Hp-IgG和G-17水平,结果显示Hp阳性者的G-17水平明显高于Hp阴性者。本研究中,与Hp阴性组相比,Hp阳性组空腹血清G-17明显升高(P=0.001),餐后血清G-17无明显差异。说明Hp感染对空腹血清G-17有一定影响。
目前各研究对血清G-17诊断CAG的准确率存在较大差异,除与研究设计、各地区CAG发生率、Hp感染率有关外,人种差异亦有一定影响[14-15]。Leja等[15]对空腹和餐后血清G-17诊断CAG的最佳值进行研究,结果显示241例患者(拉脱维亚人125例、立陶宛人76例、台湾人40例)中,空腹或餐后G-17诊断白种人CAG的准确率和特异性高于亚洲人。本研究中,餐后血清G-17诊断CAG的临界值为5.93 pmol/L,AUC为0.619(95% CI: 0.554~0.684),准确率为60.7%。Väänänen等[16]的诊断性试验表明,血清G-17诊断CAG的准确率高于80%。本研究的诊断准确率明显低于这一水平,进一步说明人种对血清G-17诊断CAG存在影响。
本研究显示,Hp阳性时,空腹血清G-17诊断CAG的AUC为0.634(95% CI: 0.537~0.732),对应的临界值为2.89 pmol/L,准确率为62.6%。而Hp阴性时,空腹血清G-17诊断CAG的AUC为0.576(95% CI: 0.478~0.675),对应的临界值为1.58 pmol/L,准确率为54.9%。说明空腹血清G-17对Hp阳性CAG的诊断价值远高于Hp阴性CAG。这一结果与Sipponen等[8]的研究一致。
Hp阳性时,餐后血清G-17诊断CAG的AUC为0.675(95% CI: 0.581~0.769),对应的临界值为4.88 pmol/L。准确率为61.8%。而Hp阴性时,餐后血清G-17诊断CAG的AUC为0.595(95% CI: 0.495~0.694),对应的临界值为8.76 pmol/L,准确率为53.1%。由此可见,尽管Hp感染对餐后血清G-17水平影响不大,但对Hp阳性CAG的诊断价值高于Hp阴性CAG。
总之,本研究结果表明,由于Hp对胃泌素分泌的刺激作用,Hp感染对血清G-17水平有一定影响,尤其是对空腹血清G-17。因此在临床实践中,如不考虑Hp感染状态,餐后血清G-17诊断胃窦萎缩的价值较高,诊断临界值为5.93 pmol/L。而空腹血清G-17诊断胃窦萎缩时,判断Hp感染具有重要作用,对Hp阳性和Hp阴性的诊断界限值不同,分别为2.89 pmol/L和1.58 pmol/L,且前者的诊断准确率相对较高。本研究进一步验证了Hp感染对血清G-17水平的影响,进而影响诊断胃窦萎缩的准确率,并初步提出了在不同Hp感染状态下血清G-17诊断胃窦萎缩的界限值。
1 中华医学会消化病学分会.中国慢性胃炎共识意见[J].胃肠病学,2013,18 (1):24-36.
2 Correa P,Haenszel W,Cuello C,et al.A model for gastric cancer epidemiology[J].Lancet,1975,2 (7924):58-60.
3 Sanduleanu S,Bruïne AD,Biemond I,et al.Ratio between serum IL-8 and pepsinogen A/C:a marker for atrophic body gastritis[J].Eur J Clin Invest,2003,33 (2):147-154.
4 di Mario F,Cavallaro LG.Non-invasive tests in gastric diseases[J].Dig Liver Dis,2008,40 (7):523-530.
5 Dixon MF,Genta RM,Yardley JH,et al.Classification and grading of gastritis.The updated Sydney System.International Workshop on the Histopathology of Gastritis,Houston 1994[J].Am J Surg Pathol,1996,20 (10):1161-1181.
6 杜鹃,王秀琴.胃泌素的生物活性及其信号传导通路[J].解剖科学进展,2003,9 (4):347-352.
7 Sawada M,Dickinson CJ.The G cell[J].Annu Rev Physiol,1997,59:273-298.
8 Sipponen P,Härkönen M,Alanko A,et al.Diagnosis of atrophic gastritis from a serum sample[J].Clin Lab,2002,48 (9-10):505-415.
9 Cao Q,Ran ZH,Xiao SD.Screening of atrophic gastritis and gastric cancer by serum pepsinogen,gastrin-17 andHelicobacterpyloriimmunoglobulin G antibodies[J].J Dig Dis,2007,8 (1):15-22.
10 Sipponen P,Kosunen TU,Valle J,et al.Helicobacterpyloriinfection and chronic gastritis in gastric cancer[J].J Clin Pathol,1992,45 (4):319-323.
11 Testino G,Cornaggia M,De Iaco F.Helicobacterpyloriinfluence on gastric acid secretion in duodenal ulcer patients diagnosed for the first time[J].Panminerva Med,2002,44 (1):19-22.
12 Beales I,Blaser MJ,Srinivasan S,et al.Effect ofHelicobacterpyloriproducts and recombinant cytokines on gastrin release from cultured canine G cells[J].Gastroenterology,1997,113 (2):465-471.
13 Zhang Z,Sun Lp,Gong YH,et al.Factors affecting the serum gastrin 17 level:an evidence-based analysis of 3906 serum samples among Chinese[J].J Dig Dis,2007,8 (2):72-76.
14 Ley C,Mohar A,Guarner J,et al.Screening markers for chronic atrophic gastritis in Chiapas,Mexico[J].Cancer Epidemiol Biomarkers Prev,2001,10 (2):107-112.
15 Leja M,Kupcinskas L,Funka K,et al.Value of gastrin-17 in detecting antral atrophy[J].Adv Med Sci,2011,56 (2):145-150.
16 Väänänen H,Vauhkonen M,Helske T,et al.Non-endoscopic diagnosis of atrophic gastritis with a blood test.Correlation between gastric histology and serum levels of gastrin-17 and pepsinogen Ⅰ:a multicentre study[J].Eur J Gastroenterol Hepatol,2003,15 (8):885-891.
(2016-12-19收稿;2016-12-28修回)
Diagnostic Value of Serum Gastrin-17 for Antral Atrophy under Different Hp Infection Status
ZHUChunping1,ZHAOJianye1,QIANWei1,SUNMingjun2,LIUWei3,XUJianming4,CAIQuancai1,DUYiqi1,LIZhaoshen1.
1DepartmentofGastroenterology,ChanghaiHospitalAffiliatedtoSecondMilitaryMedicalUniversity,Shanghai(200433);2DepartmentofGastroenterology,theFirstHospitalofChinaMedicalUniversity,Shenyang;3DepartmentofGastroenterology,the105thHospitalofPLA,Hefei;4DepartmentofGastroenterology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei
LI Zhaoshen,Email:zhsli@81890.net
Gastrin-17;Helicobacterpylori; Gastritis,Atrophic; Diagnosis
10.3969/j.issn.1008-7125.2017.05.006
*基金来源:国家科技支撑计划(2015BAI13B08)
#本文通信作者,Email:zhsli@81890.net
Background:Chronic atrophic gastritis (CAG) is a precancerous lesion of gastric cancer.The diagnostic value of serum gastrin-17 (G-17) level for CAG differs substantioulsy,andHelicobacterpylori(Hp) infection may play an important role.Aims:To explore the effect of Hp infection on serum G-17 level,and the diagnostic value of serum G-17 level for CAG under different Hp infection status.Methods:A total of 204 patients with chronic non-atrophic gastritis and 81 patients with CAG from May 2014 to May 2015 at the three different hospitals were enrolled.Gastroscopy was performed,fasting serum G-17 level,postprandial serum G-17 level and Hp-IgG antibody were determined by ELISA.Results:Fasting serum G-17 level was significantly increased in Hp positive group than in Hp negative group (P=0.001),and postprandial serum G-17 level was significantly decreased in CAG group than in non-atrophy group (P=0.002).AUC of fasting serum G-17 level for diagnosing Hp positive and negative CAG were 0.634 (95% CI:0.537-0.732) and 0.576 (95% CI:0.478-0.675),respectively,the accuracy were 62.6% and 54.9%,respectively.AUC of postprandial serum G-17 level for diagnosing Hp positive and negative CAG were 0.675 (95% CI:0.581-0.769) and 0.595 (95% CI:0.495-0.694),respectively,the accuracy were 61.8% and 53.1%,respectively.Conclusions:Hp infection has impact on serum G-17 level,as a result,the diagnostic value of G-17 level for CAG is different for patients with and without Hp infection.Diagnostic values of fast and postprandial serum G-17 for Hp positive CAG are higher than Hp negative CAG.
