炎症性肠病患者血清胆汁酸谱的研究*
2017-06-15陆霞娟瞿春莹葛文松陈颖伟
陆霞娟 周 敏 瞿春莹 葛文松 陈颖伟#
上海市杨浦区控江医院消化内科1(200093) 上海交通大学医学院附属新华医院消化内科2
炎症性肠病患者血清胆汁酸谱的研究*
陆霞娟1周 敏2瞿春莹2葛文松2陈颖伟2#
上海市杨浦区控江医院消化内科1(200093) 上海交通大学医学院附属新华医院消化内科2
背景:炎症性肠病(IBD)发病率不断升高,其病因和发病机制尚未完全明确。研究发现,胆汁酸代谢紊乱在实验性结肠炎的病理进程中起重要作用,但其与IBD发病的相关性尚未见报道。目的:探讨IBD患者血清胆汁酸谱的变化。方法:选取上海新华医院7名健康对照、15例溃疡性结肠炎(UC)和16例克罗恩病(CD),采用高效液相色谱-质谱法检测血清胆汁酸谱。结果:与对照组相比,UC和CD患者血清初级胆汁酸胆酸(CA)、鹅去氧胆酸(CDCA)、甘氨胆酸(GCA)、牛磺胆酸(TCA)、甘氨鹅去氧胆酸(GCDCA)含量无明显差异(P>0.05);UC患者次级胆汁酸去氧胆酸(DCA)含量显著降低(P<0.05),CD患者甘氨去氧胆酸(GDCA)和牛磺去氧胆酸(TDCA)含量显著降低(P<0.05),UC和CD患者血清石胆酸(LCA)显著降低(P<0.05)。结论:IBD患者血清胆汁酸谱发生显著改变,提示其可能参与IBD病理进程。
胆汁酸类和盐类; 炎症性肠病; 结肠炎,溃疡性; Crohn病
近年青少年和青壮年炎症性肠病(inflammatory bowel disease,IBD)的发病率不断升高,其病因和发病机制尚未完全明确。IBD主要包括溃疡性结肠炎(UC)和克罗恩病(CD),目前尚缺乏有效的治疗手段。IBD进展过程中伴随营养不良、肠梗阻、穿孔等严重并发症,疾病后期易诱发结肠癌的发生。既往研究报道表明,胆汁酸代谢紊乱在实验性结肠炎的病理进程中起有重要作用,然而其与IBD发病进程的相关性未见报道。本研究通过检测IBD患者血清胆汁酸谱的改变,旨在初步探讨胆汁酸谱改变在IBD病理进程中的可能作用和意义。
对象与方法
一、研究对象
选取2011年7月—2013年9月上海交通大学医学院附属新华医院31例IBD患者(15例UC患者和16例CD患者),诊断经内镜和病理检查证实。15例UC患者中,男9例,女6例,年龄13~39岁,平均24.9岁。16例CD患者中,男11例,女5例,年龄0~37岁,平均20.8岁。同时选取2013年1月—2013年6月7名健康志愿者作为对照,其中男3名,女4名,年龄12~33岁,平均21.2岁。本研究方案通过上海新华医院伦理委员会审批同意,并均取得受试者的知情同意。
二、研究方法
1.主要材料:均购自Waters公司,包括流动相水相(0.1%甲酸)、有机相(95% ACN、5% MeOH、0.1%甲酸);色谱柱:BEH C18,1.7 μm,2.1 mm×100 mm;胆酸内标:1.5 μmol/L CA-D4、1.5 μmol/L CDCA-D4和1.5 μmol/L LCA-D4;实验使用的胆汁酸标准品包括胆酸(CA)、甘氨胆酸(GCA)、牛磺胆酸(TCA)、鹅去氧胆酸(CDCA)、甘氨鹅去氧胆酸(GCDCA)、牛磺鹅去氧胆酸(TCDCA)、去氧胆酸(DCA)、甘氨去氧胆酸(GDCA)、牛磺去氧胆酸(TDCA)、熊去氧胆酸(UDCA)、甘氨熊去氧胆酸(GUDCA)、牛磺熊去氧胆酸(TUDCA)、石胆酸(LCA)、葡糖石胆酸(GLCA)、牛磺石胆酸(TLCA)、猪胆酸(HCA)、葡糖猪胆酸(GHCA)、牛磺猪胆酸(THCA)、α-鼠胆酸(α-MCA)、牛磺α-鼠胆酸(T-α-MCA)、β-鼠胆酸(β-MCA)、牛磺β-鼠胆酸(T-β-MCA)、ω-鼠胆酸(ω-MCA)、牛磺ω-鼠胆酸(T-ω-MCA)、猪去氧胆酸(HDCA)、葡糖猪去氧胆酸(GHDCA)、牛磺猪去氧胆酸(THDCA)、鼠胆酸(muroCA)、去氢胆酸(DHCA)、葡糖去氢胆酸(GDHCA)、牛磺去氢胆酸(TDHCA)、3-去氢胆酸(3-DHCA)、7-去氢胆酸(7-DHCA)、异去氧胆酸(isoDCA)、原胆酸(apoCA)、6-酮基石胆酸(6-KLCA)、7-酮基石胆酸(7-KLCA)、12-酮基石胆酸(12-KLCA)、23-去甲脱氧胆酸 (23norDCA)、去氢石胆酸(DHLCA)。含重氢的胆酸内标石胆酸-2,2,4,4-D4(LCA-D4)和胆酸-2,2,4,4-D4(CA-D4)购自Steraloid公司。
2.血清胆汁酸谱检测方法[1-2]:取50 μL血清,加入150 μL甲醇和含重氢的胆酸内标(100 nmol/L CA-D4、LCA-D4),混匀室温放置10 min;20 000×g离心10 min,取160 μL上清置于离心管中,真空离心干燥90 min;加入40 μL有机相,1 000×g震荡复溶10 min;加入40 μL水相,1 000×g震荡复溶10 min;18 000×g离心10 min;取70 μL上清,上高效液相色谱联用质谱仪(Waters公司)进行检测。采用MassLynx 4.1软件(Waters公司)进行胆汁酸谱分析和定量。
三、统计学分析
结 果
一、血清初级胆汁酸谱改变
与对照组相比,UC和CD患者血清非结合型初级胆汁酸CA、CDCA和结合型初级胆汁酸GCA、TCA、GCDCA水平均无明显差异(P>0.05)(表1)。
二、血清次级胆汁酸谱改变
与对照组相比,UC患者血清DCA含量显著降低(P<0.05),而CD患者无明显差异(P>0.05);CD患者GDCA和TDCA显著降低(P<0.05),而UC患者无明显差异(P>0.05);UC和CD患者血清LCA含量均显著降低(P<0.05);UC和CD患者血清TUDCA、GUDCA、UDCA和TLCA含量均无明显差异(P>0.05)(表2)。
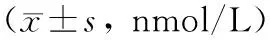
表1 各组初级胆汁酸谱
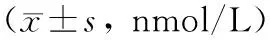
表2 各组次级胆汁酸谱
*与对照组比较,P<0.05
讨 论
近年发现,25%~30%的IBD患者为儿童和青少年,严重影响患者的身心发育和生活质量。IBD重要的病理特征之一为持续不断和反复发作的慢性肠道炎症,不断累积的病理变化最终发展为结肠癌等相关恶性病变,但目前尚缺乏行之有效的治愈手段。肠道与肝脏有着共同的胚胎起源,两者并非为两个相互独立的器官,在各种解剖和生物学功能上存在很多内在的联系。肠肝循环是负责胆汁酸从肝脏运送到小肠并重新回到肝脏的重要机制。胆汁酸的肠肝循环依赖于回肠末端和结肠对胆汁酸的重吸收。
最新研究发现胆汁酸代谢紊乱在肠道炎症发展中起有重要作用[3]。胆汁酸不仅参与了胆汁的形成、胆固醇消除、肠道吸收脂类和脂溶性分子等生理过程,还可作为信号分子在调控能量平衡、炎症和肝脏再生中起重要作用[4-7]。研究证实过氧化物酶体增殖物激活受体α-尿苷二磷酸葡萄糖醛酸转移酶(PPARα-UGTs)信号通路是胆汁酸平衡的重要决定因素。在葡聚糖硫酸钠诱导的小鼠结肠炎中,肠道PPARα-UGTs信号通路被激活,导致胆汁酸在炎症结肠组织中积聚。UGTs加速代谢消除胆汁酸,由此降低其在小肠细胞中的水平。细胞内胆汁酸下降使法尼酯衍生物X受体-成纤维细胞生长因子15(FXR-FGF15)信号受到抑制,导致肝脏胆固醇7α羟化酶(cholesterol 7α hydroxylase,CYP7A1)上调,促进新胆汁的合成。
胆汁酸从来源上可分为初级胆汁酸和次级胆汁酸。肝细胞内以胆固醇为原料直接合成的胆汁酸称为初级胆汁酸,可分为非结合型和结合型两种。初级胆汁酸在肠道中受细菌的作用,进行脱羟作用生成的胆汁酸,称为次级胆汁酸。胆固醇首先在CYP7A1的催化下生成中间产物,然后经还原、羟化和加辅酶A等多步反应生成初级游离胆汁酸,最后与甘氨酸或牛磺酸修饰生成初级结合胆汁酸[8-9]。部分胆汁酸由胆盐输出泵和多药耐药蛋白排入胆管,另一部分通过多药耐药相关蛋白和组织相容性转运体进入门静脉[10-11]。胆管中的胆汁酸汇集到胆囊,胆囊收缩将其排入肠道,在肠内被肠道细菌代谢成为次级胆汁酸。游离的次级胆汁酸在小肠和结直肠通过扩散作用被动运输和被重吸收。结合次级胆汁酸在回肠通过钠离子依赖的胆汁酸转运体主动吸收进入小肠黏膜细胞并与回肠胆汁酸结合蛋白结合,由基侧膜的终末腔面钠盐依赖的胆汁酸转运体重吸收至门静脉中,然后经牛磺酸钠协同转运蛋白被肝细胞重新摄取[12]。通过肠肝循环,约95%的胆汁酸被重吸收入肝脏后再利用,5%由粪便排出丢失。因此,肠黏膜疾病可影响胆汁酸的重吸收,通过检测血清胆汁酸可反映肠黏膜功能。IBD可导致发作与缓解交替的肠道黏膜屏障损伤,目前尚未见关于IBD患者胆汁酸代谢情况的报道。
本研究通过血清胆汁酸谱检测发现IBD患者血清初级胆汁酸含量有所升高,但与对照者相比并无明显差异;IBD患者次级胆汁酸明显降低。在CD患者中,GDCA和TDCA显著下降,可能与CD的主要病变好发部位为回肠末端有关。GDCA和TDCA属结合型胆汁酸,主要在回肠主动重吸收。在UC患者中,DCA显著下降,其属游离胆汁酸,在结直肠以被动重吸收为主,其下降与UC的病变部位有关。血清LCA在UC和CD患者中均显著下降,提示LCA在IBD病理进程中可能起有重要作用。LCA可与维生素D受体结合,动物实验[13]发现,在维生素D缺乏大鼠中,补充LCA可替代维生素D在体内的活性功能。研究显示IBD患者普遍缺乏维生素D[14],推测IBD患者胆汁酸LCA降低可能会加重维生素D的缺乏。FXR是维持胆汁酸稳态的重要调控因子,具有抗炎的作用[3,15]。胆汁酸LCA是FXR有效激动剂,IBD患者LCA减少可能会加重肠炎和胆汁酸代谢的失衡。
总之,本研究发现IBD患者血清胆汁酸谱发生显著改变,提示胆汁酸代谢紊乱在IBD病理进程中起有重要作用,可能为现有结肠炎的治疗提供了新的视角。
1 Xie G,Zhong W,Li H,et al.Alteration of bile acid metabolism in the rat induced by chronic ethanol consumption[J].FASEB J,2013,27 (9):3583-3593.
3 Zhou X,Cao L,Jiang C,et al.PPARα-UGT axis activation represses intestinal FXR-FGF15 feedback signalling and exacerbates experimental colitis[J].Nat Commun,2014,5:4573.
4 Chávez-Talavera O,Tailleux A,Lefebvre P,et al.Bile acid control of metabolism and inflammation in obesity,type 2 diabetes,dyslipidemia,and nonalcoholic fatty liver disease[J].Gastroenterology,2017,152 (7):1679-1694.e3.
5 Xiao YT,Cao Y,Zhou KJ,et al.Altered systemic bile acid homeostasis contributes to liver disease in pediatric patients with intestinal failure[J].Sci Rep,2016,6:39264.
6 Guo C,Xie S,Chi Z,et al.Bile acids control inflammation and metabolic disorder through inhibition of NLRP3 inflammasome[J].Immunity,2016,45 (4):802-816.
7 Rau M,Stieger B,Monte MJ,et al.Alterations in enterohepatic Fgf15 signaling and changes in bile acid composition depend on localization of murine intestinal inflammation[J].Inflamm Bowel Dis,2016,22 (10):2382-2389.
8 Chiang JY.Bile acids:regulation of synthesis[J].J Lipid Res,2009,50 (10):1955-1966.
9 Bertolotti M,Abate N,Loria P,et al.Regulation of bile acid synthesis in humans:effect of treatment with bile acids,cholestyramine or simvastatin on cholesterol 7 alpha-hydroxylation ratesinvivo[J].Hepatology,1991,14 (5):830-837.
10 Zwicker BL,Agellon LB.Transport and biological activities of bile acids[J].Int J Biochem Cell Biol,2013,45 (7):1389-1398.
11 Wolkoff AW,Cohen DE.Bile acid regulation of hepatic physiology:I.Hepatocyte transport of bile acids[J].Am J Physiol Gastrointest Liver Physiol,2003,284 (2):G175-G179.
12 Dawson PA,Karpen SJ.Intestinal transport and metabolism of bile acids[J].J Lipid Res,2015,56 (6):1085-1099.
13 Nehring JA,Zierold C,DeLuca HF.Lithocholic acid can carry outinvivofunctions of vitamin D[J].Proc Natl Acad Sci U S A,2007,104 (24):10006-10009.
14 Ghaly S.Iron and vitamin D deficiency in inflammatory bowel disease[J].J Gastroenterol Hepatol,2016,31 Suppl 1:27-28.
15 Attinkara R,Mwinyi J,Truninger K,et al;Swiss IBD Cohort Study Group.Association of genetic variation in the NR1H4 gene,encoding the nuclear bile acid receptor FXR,with inflammatory bowel disease[J].BMC Res Notes,2012,5:461.
(2016-12-27收稿;2017-02-05修回)
Serum Bile Acid Profile in Patients with Inflammatory Bowel Disease
LUXiajuan1,ZHOUMin2,QUChunying2,GEWensong2,CHENYingwei2.
1DepartmentofGastroenterology,KongjiangHospitalofShanghaiYangpuDistrict,Shanghai(200093);2DepartmentofGastroenterology,XinHuaHospitalAffiliatedtoShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai
CHEN Yingwei,Email:way-01chen@163.com
Bile Acids and Salts; Inflammatory Bowel Disease; Colitis,Ulcerative; Crohn Disease
10.3969/j.issn.1008-7125.2017.05.009
*本课题由国家自然基金项目(批准号81370485)资助
#本文通信作者,Email:way-01chen@163.com
Background:The incidence of inflammatory bowel disease (IBD) is increasing in recent years,and the etiology and pathogenesis of IBD remain unclear.Studies showed that disorder of bile acid metabolism plays an important role in the pathological process of experimental colitis.However,serum bile acid profile in IBD patients has not been reported.Aims:To investigate the changes of serum bile acid profile in patients with IBD.Methods:Seven healthy controls,15 patients with ulcerative colitis (UC) and 16 patients with Crohn’s disease (CD) at Shanghai Xin Hua Hospital were enrolled.High-performance liquid chromatography-mass spectrometry was used to determine serum bile acid profile.Results:No significant differences in serum concentrations of primary bile acid cholic acid (CA),chenodeoxycholic acid (CDCA),glycocholic acid (GCA),taurocholic acid (TCA),glycochenodeoxycholic acid (GCDCA) were found between UC or CD and controls (P>0.05).Compared with controls,serum concentration of secondary bile acid deoxycholic acid (DCA) in UC patients was significantly decreased (P<0.05),glycodeoxycholic acid (GDCA),taurodeoxycholic acid (TDCA) in CD patients were significantly decreased (P<0.05),serum concentration of lithocholic acid (LCA) in UC and CD patients was significantly decreased (P<0.05).Conclusions:The serum bile acid profile in IBD patients is significantly changed,which suggests that it may be involved in the pathological process of IBD.
