猪殃殃药材质量控制方法研究
2017-06-15李建晨白伟红槐红微
李建晨,白伟红,黑 静,槐红微
(河北科技大学化学与制药工程学院,河北石家庄 050018)
猪殃殃药材质量控制方法研究
李建晨,白伟红,黑 静,槐红微
(河北科技大学化学与制药工程学院,河北石家庄 050018)
为了修订猪殃殃原有标准中关于性状方面的内容,有效反映和控制药材的内在质量,收集了10批猪殃殃药材,对其性状、专属性鉴别、检查项、指标成分含量进行了研究。采用薄层色谱进行定性鉴别,高效液相色谱法测定绿原酸的含量。研究发现:TLC斑点清晰,分离度好;10批样品中水分小于13.0%,总灰分小于16.0%,酸不溶性灰分小于3.5%,醇溶性浸出物小于7.0%,绿原酸质量分数小于0.1%。结果表明:所制定的猪殃殃药材质量控制方法,操作简便,重复性良好,可为猪殃殃药材的全面质量控制提供依据。
中药化学;猪殃殃;质量控制方法;绿原酸;含量测定;高效液相色谱法
猪殃殃为茜草科植物猪殃殃Galium aparine L.var.tenerum(Gren.et Godr.)Rchb.的干燥全草,味辛,微寒,具有清热解毒、利尿消肿、止血的功效,用于治疗水肿、尿路感染、痢疾、便血尿血、跌扑损伤、痈肿疔疮、虫蛇咬伤等。猪殃殃为常用中药,也为藏族习用药材,资源丰富,全国各地均产。有关猪殃殃的内容收载于《中华人民共和国药典》(1977年版)和《上海市中药材标准》(1994年版),但标准中涉及的内容较少,仅规定了其性状特征,没有药材的专属性鉴别、检查项与含量测定项,不能有效地反映和控制药材的内在质量[1-4]。
本文拟修订猪殃殃原有标准中关于性状方面的内容,制定药材的显微鉴别、薄层鉴别以及含量测定方法,同时增加检查项(水分、总灰分、酸不溶性灰分)及浸出物的测定,制定完善的猪殃殃药材质量控制方法,更好地对猪殃殃药材进行质量控制[5-12]。猪殃殃药材中主要含苯丙素类、黄酮类和环烯醚萜类成分,其中的苯丙素类化合物绿原酸具有抗菌、抗病毒、清除自由基和令中枢神经系统兴奋的作用[13],为猪殃殃药材的主要活性成分[14-19]。本文选取绿原酸作为定量控制的指标成分。
1 主要仪器与药品
Agilent 1200液相色谱仪,OLYMPUS CX22LED 显微镜,XP-205十万分之一电子分析天平,AL 204 分析天平,梅特勒-托利多公司提供。
猪殃殃对照药材,由中国食品药品检定研究院购得,批号为121513-200501;绿原酸对照品,由中国食品药品检定研究院购得,批号为110753-201415;水,广州屈臣氏食品饮料有限公司提供;乙腈,色谱纯,德国MERCK公司提供;薄层板为硅胶GF254(MERCK)。
共收集10批药材样品,经河北省药品检验研究院段吉平研究员鉴定为猪殃殃Galium aparine L.var.tenerum (Gren.et Godr.) Rchb.的全草。
2 方法与结果
2.1 性状
本品茎细长,呈方柱形,多分枝,直径约1 mm,表面呈深褐色或绿褐色,四棱上生有倒生小刺;质脆,易折断,断面中空;叶6~8枚轮生,无柄,叶片多为卷缩状,易破碎,完整叶片展平后呈现为披针形或条状倒披针形,长1~2 cm,宽0.2~0.4 cm,两面常有刺状毛;聚伞花序腋生或顶生,花小,易脱落;果小,常呈二半球形,深褐色或绿褐色,密生白色钩毛;气微,味淡。
2.2 显微鉴别
本品粉末呈灰褐色,叶上表皮细胞壁较平直,下表皮细胞壁呈波状弯曲,气孔不定式;茎表皮细胞类长方形,气孔平轴式;纤维呈束或散在,直径13~32 μm;导管多为螺纹和环纹导管,直径5~27 μm;非腺毛,尖端弯曲如钩状或形似鸟嘴,长70~440 μm,基部直径26~110 μm。草酸钙针晶呈束或散在,长约100 μm。详见图1。
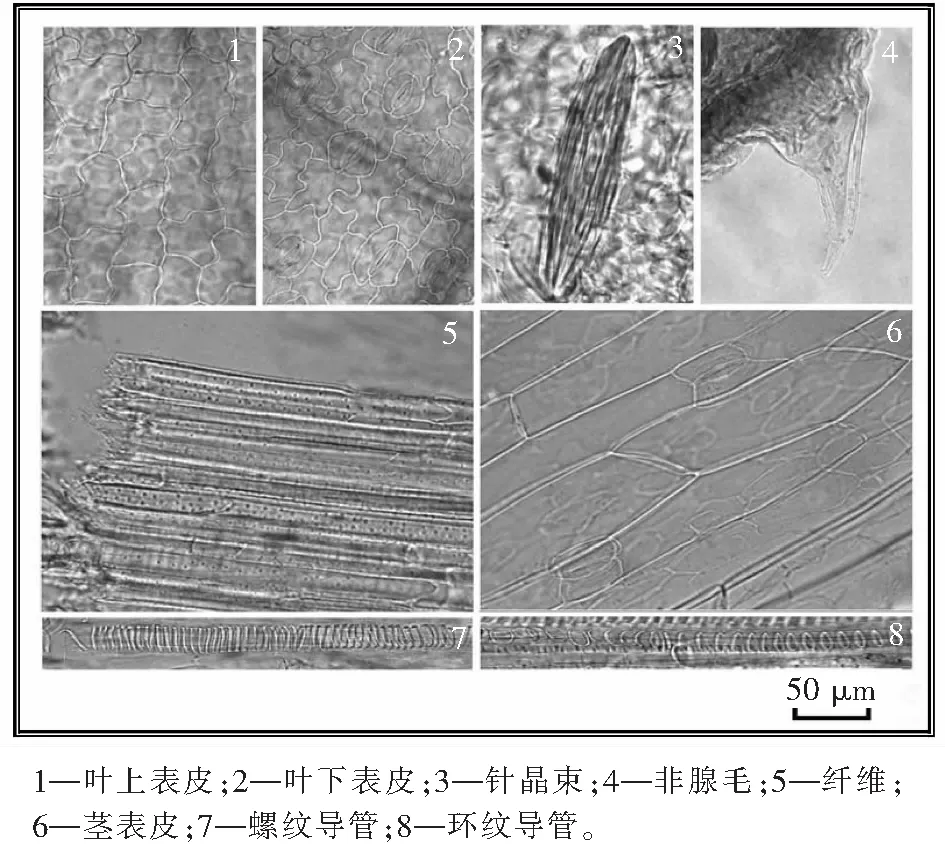
图1 猪殃殃显微鉴别Fig.1 Powder microscopic of Galii Aparinis Herba
2.3 薄层色谱鉴别
取猪殃殃药材粉末1 g,加入甲醇30 mL,加热回流提取30 min,过滤,将滤液蒸干。在残渣中加入10 mL水使之溶解,用10 mL石油醚(60~90 ℃)振摇提取,弃去石油醚层。将水层继续用10 mL乙酸乙酯进行振摇提取,分取乙酸乙酯层(水层备用)。将乙酸乙酯层蒸干,在残渣中加入1 mL甲醇使之溶解,作为供试品溶液。另取猪殃殃对照药材粉末1 g,同法制得对照药材溶液。依照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,分别吸取上述2种溶液各3 μL,点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(三者体积比为8∶1∶0.1)为展开剂,展开,取出,晾干,在紫外光(365 nm)下进行检视,供试品色谱与对照药材色谱相对应的位置显示相同颜色的荧光斑点(见图2 a))。
取上述备用水层溶液,加入正丁醇10 mL振摇提取,分取正丁醇层,蒸干,在残渣中加入1 mL甲醇使之溶解,作为供试品溶液。取对照药材备用水层溶液,同法制备对照药材溶液。依照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,分别吸取上述2种溶液各2 μL,点于同一硅胶G薄层板上,以乙酸乙酯-甲酸-水(三者体积比为12∶3∶1)为展开剂,展开,取出,晾干,喷以10%(体积分数,下同)硫酸乙醇溶液,于105 ℃加热到斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显示相同颜色斑点(见图2 b))。
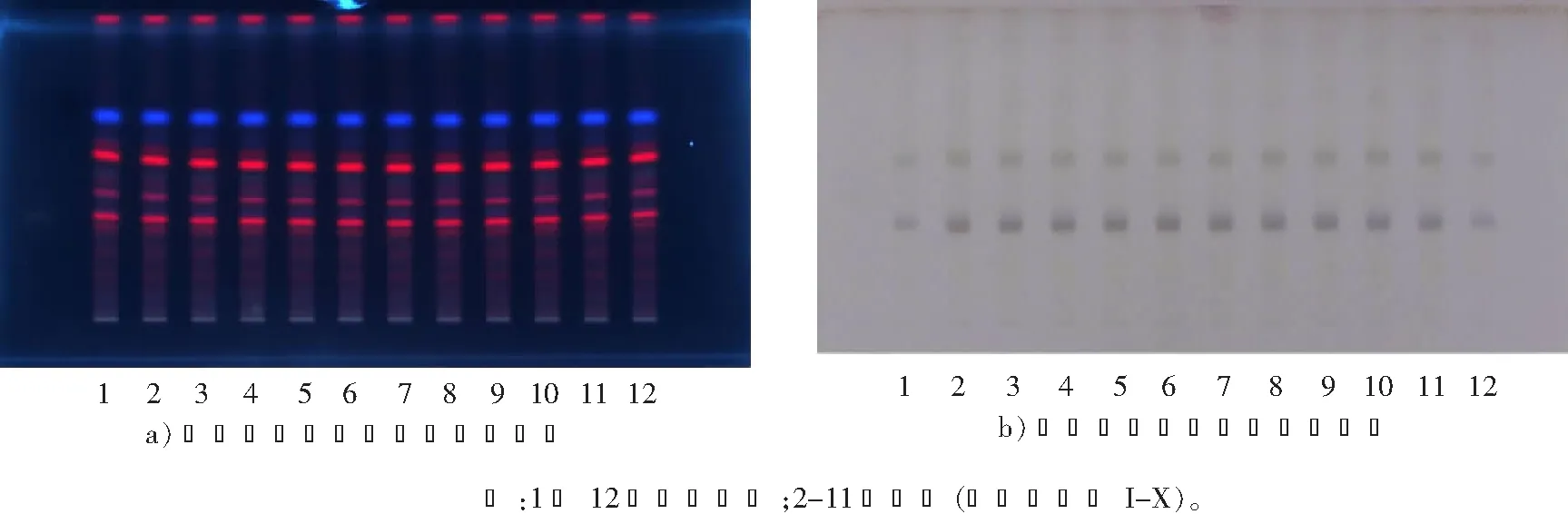
图2 猪殃殃药材的薄层色谱图Fig.2 TLC of Galii Aparinis Herba samples
2.4 检查项及浸出物测定
以《中华人民共和国药典》2015年版四部通则为参照,进行检查项(水分、总灰分、酸不溶性灰分)和醇溶性浸出物(热浸法)的测定,结果见表1。

表1 10批样品水分、总灰分等的测定结果
2.5 含量测定
2.5.1 色谱条件
Kromasil C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.1%磷酸(二者体积比为13∶87),流速为1.0 mL/min,检测波长为 327 nm,柱温为25 ℃,进样量为20 μL。在上述色谱条件下,各成分分离度良好,结果见图3。
2.5.2 对照品溶液的制备
取绿原酸对照品约10 mg,精密称定,置于25 mL的容量瓶中,加入甲醇定容至刻度,制成每1 mL约含40 μg绿原酸的对照品溶液。
2.5.3 供试品溶液的制备
将猪殃殃药材粉碎(过3号筛),精密称取约1 g粉末,加入60%(体积分数,下同)甲醇25 mL使之溶解,称重,浸泡30 min,超声处理(200 W,40 kHz)30 min,放冷。用60%甲醇补足损失的质量,摇匀,过滤,将续滤液作为供试品溶液。
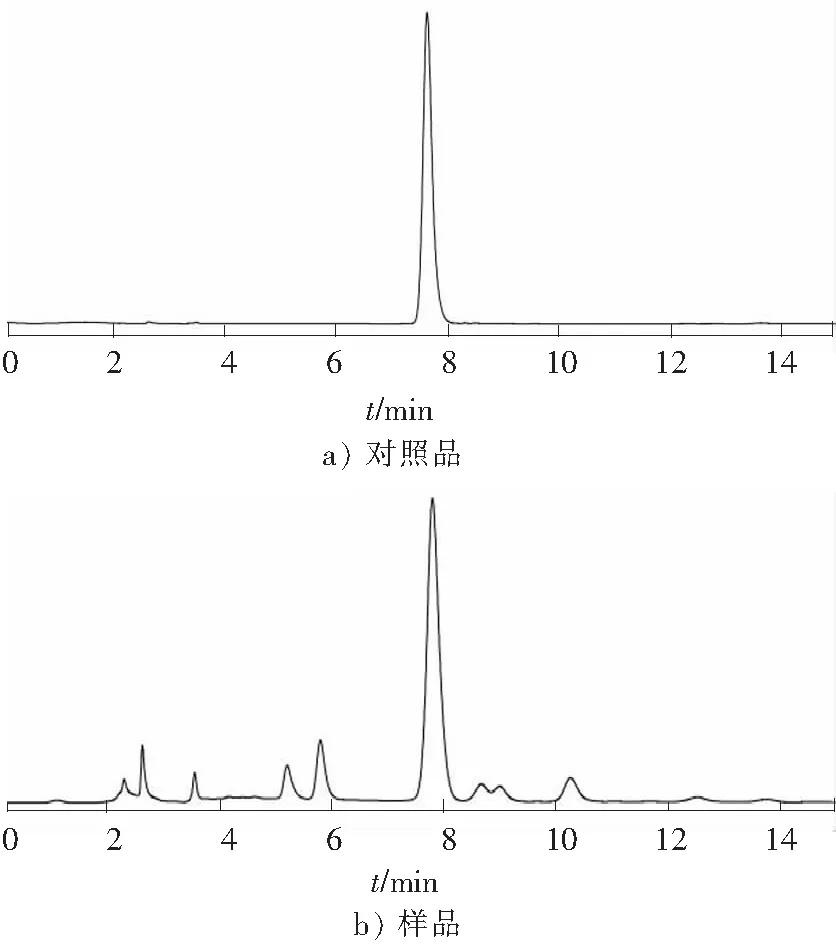
图3 对照品和样品HPLC图Fig.3 HPLC chromatograms of standard solution and sample solution
2.5.4 线性关系考察
选取80 μg/mL绿原酸对照品溶液作为储备液,分别精密吸取绿原酸储备液1,2,4,5,6,8 mL,加入甲醇定容至10 mL,摇匀。进样量为20 μL,测定峰面积,绘制关于绿原酸质量浓度与峰面积的标准曲线,得到线性回归方程为Y=163.44X-104.02,r=0.999 5。结果表明,绿原酸在8.01~64.08 μg/mL内有良好的线性关系。
2.5.5 精密度试验
取绿原酸对照品溶液20 μL,重复进样6次。结果表明,其精密度良好,峰面积的RSD值为0.45%。
2.5.6 稳定性试验
取供试品溶液(编号为Ⅷ),室温放置,于0,4,8,12,16,24 h依次进样。结果表明,供试品溶液稳定性良好,峰面积RSD值为1.38%。
2.5.7 重复性试验
平行取编号为Ⅷ的药材粉末6份,每份约1 g,精密称定,按“2.5.3”项下方法进行处理,配制成供试品溶液,按建立的色谱条件分别进样。结果表明,该方法重复性良好,峰面积RSD值为1.21%。
2.5.8 回收率试验
精密称取编号为Ⅷ的猪殃殃药材粉末9份,每份约0.5 g,精密称定,分为3组,分别加入低(质量分数为80%)、中(质量分数为100%)、高(质量分数为120%)3种不同浓度的绿原酸对照品溶液,混匀,进样,计算回收率,结果如表2所示,得到的RSD值为1.24%,回收率为97.71%~101.33%,符合要求。
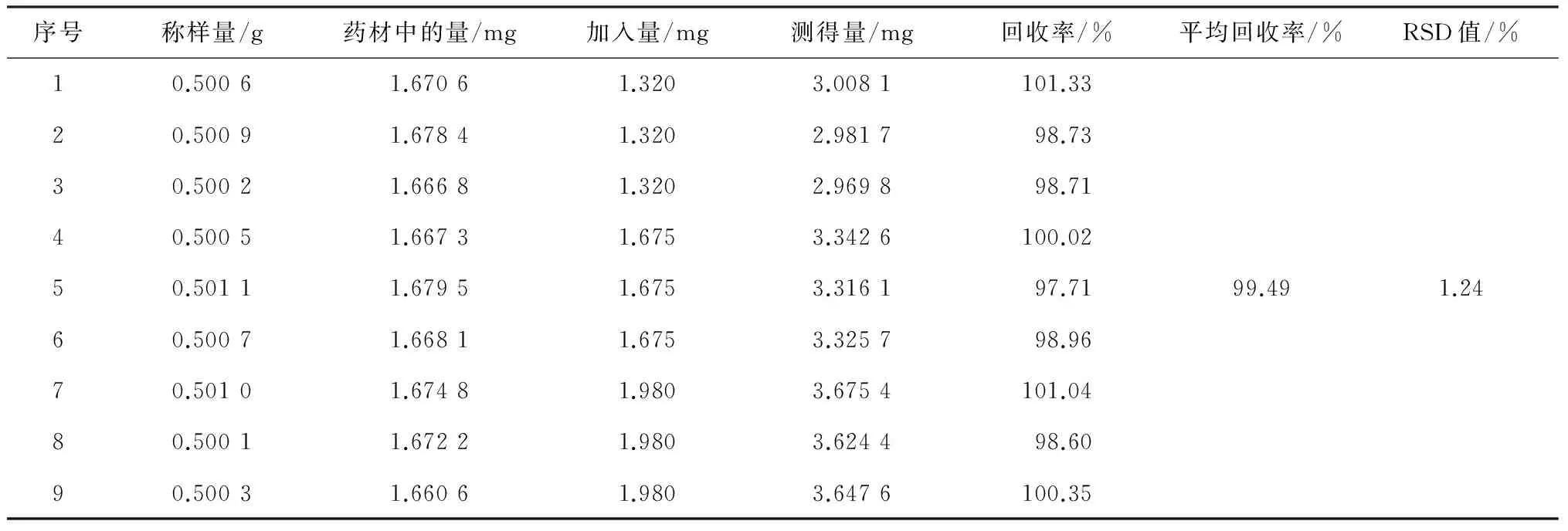
表2 加样回收率试验结果
2.5.9 样品含量测定
精密称取各批次样品1 g,按“2.5.3”项下的方法制备各批次药材的供试品溶液,按建立的色谱条件分别进样测定,样品含量测定结果见表3。
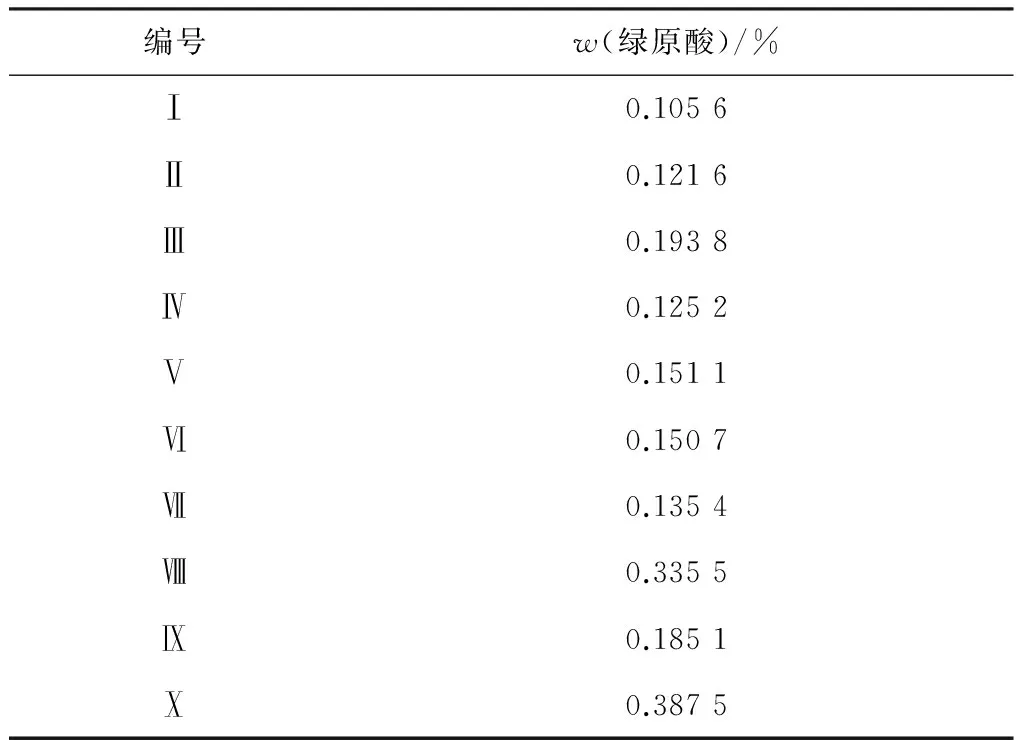
表3 猪殃殃含量测定结果(n=3)
3 讨 论
在《中华人民共和国药典》(1977年版)中猪殃殃药材的原植物记载为猪殃殃Galium aparine L,而在《上海市中药材标准》(1994年版)以及《江西省中药饮片炮制规范》(2008年版)中,原植物均记载为猪殃殃Galium aparine L. var. tenerum(Gren.et Godr.)Rchb.。参照《上海市中药材标准》(1994年版),将原植物拉丁名定为猪殃殃Galium aparine L.var.tenerum(Gren.et Godr.)Rchb.。
本文修订了药材的性状特征,结合对药材的实际观察,对《中华人民共和国药典》(1977年版)猪殃殃性状鉴别中叶片的刺状毛以及果实的颜色进行了修改:由原来的“边缘及下表面中脉有倒生小刺”修改为“两面常有刺状毛”;将原来的果实颜色“绿褐色”修改为“深褐色或绿褐色”,使性状描述更加准确。制定了检查项、浸出物、绿原酸含量的限度,利用各测定项限度,对药材内在质量进行更好的评价。
薄层鉴别是中药材进行定性鉴别的重要方法之一。本文薄层鉴别中对提取的溶剂、方法以及提取液的纯化方法分别进行了考察,发现甲醇作为提取溶剂时,采用加热回流的方法能使药材的提取更加完全。通过比较,发现萃取方法能够有效除去低极性的杂质,利用所含成分的差异,对乙酸乙酯提取部位和正丁醇提取部位分别进行鉴别。通过2个薄层鉴别方法的建立,能够对药材进行更多层次和比较全面的质量控制。
参考菊花中绿原酸的含量测定方法[20],对猪殃殃药材中的绿原酸进行含量测定,流动相曾采用不同比例的乙腈-磷酸,结果发现以乙腈-0.1%磷酸(二者体积比为13∶87)为流动相时,得到的绿原酸色谱峰的峰形与分离度较好,同时出峰时间亦较理想,故最终选其作为流动相。通过对提取溶剂、提取方法及提取时间的考察,确定提取溶剂采用体积分数为60%的甲醇,提取方法为超声波提取,超声时间为30 min。
本文所制定的猪殃殃药材的质量控制方法操作简便,重复性良好,能够为猪殃殃药材进行全面质量控制提供依据。
/References:
[1] 蔡小梅.猪殃殃化学成分的研究[D].贵阳:贵州大学,2009. CAI Xiaomei. Studies on Chemical Constituents of Galium Aparine[D]. Guiyang: Guizhou University, 2009.
[2] 倪志诚.西藏经济植物[M].北京:科学出版社,1990.
[3] 上海市卫生局.上海市中药材标准[M].上海:上海市卫生局,1994.
[4] 许亮,窦德强,康廷国,等.炒牛蒡子质量标准研究[J].中成药,2010, 32(4):622-624. XU Liang, DOU Deqiang, KANG Tingguo, et.al. Study on quality standard of arctll fructus[J]. Chinese Traditional Patent Medicine, 2010, 32(4): 622-624.
[5] 徐国芳.中药显微鉴定的操作方法及显微特征[J].时珍国医国药,2000, 11(7):631. XU Guofang. Operation method and microscopic characteristics of microscopic identification of traditional chinese medicine[J]. Lishizhen Medicine and Materia Medica Research, 2000, 11(7): 631.
[6] 赵希贤,尤立华,杨秉呼,等.中药薄层色谱鉴别检验常见问题探讨[J].中国药业,2013, 22(6): 2-4. ZHAO Xixian, YOU Lihua, YANG Binghu, et al. Discussion on common problems in identification of thin-layer chromatography of traditional Chinese medicine[J]. China Pharmaceticals, 2013, 22(6): 2-4.
[7] 李向军,王超,王永,等.中药薄层色谱影响因素分析及应用[J].中国药业,2011, 20(14):13-15. LI Xiangjun, WANG Chao, WANG Yong, et al. Thin layer chromatography application in medicine and its influence factor analysis[J]. China Pharmaceticals, 2011, 20(14):13-15.
[8] 王丽萍,郭栋,王果,等.中药绿原酸的研究进展[J].时珍国医国药,2011, 22(4):961-963. WANG Liping, GUO Dong, WANG Guo, et al. Advancement of chlorogenic acid in traditional chinese medicine[J]. Lishizhen Medicine and Materia Medica Research, 2011, 22(4): 961-963.
[9] 李建晨,廖明丽,贾玉捷,等.双黄连口服液中绿原酸含量的影响因素研究[J].河北科技大学学报,2015, 36(5):499-503. LI Jianchen, LIAO Mingli, JIA Yujie, et al. Study on the influence factors for chlorogenic acid content in Shuanghuang-lian oral liquid[J]. Journal of Hebei University of Science and Technology, 2015, 36(5): 499-503.
[10]柴江,王欣,杨芳,等.延龄草药材质量评价方法的研究[J].中国药学杂志,2014, 49(24):2150-2154. CHAI Jiang, WANG Xin, YANG Fang, et al. Quantitative evaluation methodTrilliumtschonoskii[J]. Chinese Pharmaceutical Journal, 2014, 49(24): 2150-2154.
[11]严倩茹,郭伟魁.白芍饮片的质量现状与质量控制方法研究进展[J].药物评价研究,2015, 38(2):229-232. YAN Qianru, GUO Weikui. Advances in study on quality status and quality control of Paeoniae Alba Radix[J]. Drug Evaluation Research, 2015,38(2): 229-232.
[12]郝哲.河南蒲公英质量标准的研究[D].郑州:河南中医学院,2010. HAO Zhe. Study on Quality Standard of Henan Dandelion[D]. Zhengzhou: Henan University of TCM, 2010.
[13]邢丽娜,周明眉,李云,等.绿原酸及其肠道代谢产物对中枢神经系统疾病的作用和机制研究进展[J].中国中药杂志,2015, 40(6): 641-643. XING Lina, ZHOU Mingmei, LI Yun, et al. Recent progress of potential effects and mechanisms of chlorogenic acid and its intestinal[J]. China Journal of Chinese Materia Medica[J]. 2015, 40(6): 641-643.
[14]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1975.
[15]GUVENALP Z,KAZAZ C, KAYA Y, et al. Phytochemical investigation on galium humifusum growing in Turkey[J]. Biochemical Systematics and Ecology, 2006,34: 894-896.
[16]李娟,陈春霞,皮慧芳,等.猪殃殃的生药学研究[J].中国药业,2009, 18(20):65-66. LI Juan, CHEN Chunxia, PI Huifang, et al. Pharmacognostical study on Galium aparine L.[J]. China Pharmaceuticals, 2009,18(20): 65-66.
[17]杨娟,蔡小梅,穆淑珍,等.猪殃殃酚性成分研究[J].中国中药杂志,2009, 34(14):1802-1803. YANG Juan, CAI Xiaomei, MU Shuzhen, et al. Phenolic compounds from Galium aparine var.tenerum[J]. China Journal of Chinese Materia Medica, 2009, 34(14): 1802-1803.
[18]蔡小梅,杨娟,饶琼娟.猪殃殃黄酮类成分研究[J].中国药学杂志,2009, 44(19):1475-1477. CAI Xiaomei, YANG Juan, RAO Qiongjuan. Studies on flavonoids from Galium aparine[J]. Chinese Pharmaceutical Journal, 2009,44(19): 1475-1477.
[19]乔卫,张彦文,吴寿金,等.天然环烯醚萜类化合物的生物活性[J].国外医药·植物药分册,2001,16(2):65-67.
[20]孙英英,崔永霞,刘伟.HPLC对不同品种菊花中绿原酸含量的测定[J].中国实验方剂学杂志,2011, 17(24):83-84. SUN Yingying, CUI Yongxia, LIU Wei. Determination of chlorogenic acid from various species of chrysanthemum morifolium by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(24): 83-84.
Research on quality control method of Galii Aparinis Herba
LI Jianchen, BAI Weihong, HEI Jing, HUAI Hongwei
(School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
In order to revise the original Galii Aparinis Herba standard on the nature of the content, and effectively reflect and control the inherent quality of herbs,ten batches of Galii Aparinis Herba are collected. The morphology, identification, inspection and the content of target components in these crude drugs are studied. TLC method is used to identify this crude drug. The contents of chlorogenic acid in these samples are determined by HPLC. The spot of TLC is clear and well-separated. According to the measurement results of the ten samples, moisture is not more than 13.0%, total ash is not more than 16.0%, acid-insolubal ash content is not more than 3.5%, and alcohol extracts content is not less than 7.0%. The content of chlorogenic acid is above 0.1%. The results show that the set of medicinal materials quality control has the characteristics of simple operation and good repeatability, and can provide the basis for the comprehensive quality control of Galii Aparinis Herba.
Chinese medicine chemistry; Galii Aparinis Herba; quality control method; chlorogenic acid; content determination; HPLC
1008-1534(2017)03-0162-05
2017-03-07;
2017-04-24;责任编辑:张士莹
国家“重大新药创制”科技重大专项(2014ZX09304307-002);河北省中药材标准研究项目
李建晨(1964—),男,河北肃宁人,副教授,博士,主要从事天然药物方面的研究。
E-mail:lijianchen152@hotmail.com
TQ46;R932
A
10.7535/hbgykj.2017yx03002
李建晨,白伟红,黑 静,等.猪殃殃药材质量控制方法研究[J].河北工业科技,2017,34(3):162-166. LI Jianchen,BAI Weihong,HEI Jing,et al.Research on quality control method of Galii Aparinis Herba[J].Hebei Journal of Industrial Science and Technology,2017,34(3):162-166.
