一氧化氮提高黄瓜幼苗耐涝性的探究
2017-06-15张健刘美艳
张健,刘美艳
(江苏师范大学生命科学学院整合植物生物研究所江苏徐州221116)
一氧化氮提高黄瓜幼苗耐涝性的探究
张健,刘美艳
(江苏师范大学生命科学学院整合植物生物研究所江苏徐州221116)
为了提高黄瓜幼苗的耐涝性,以100 μmol·L-1硝普钠(SNP)作为一氧化氮供体,研究了一氧化氮对淹水胁迫下黄瓜幼苗细胞质膜、光合特性和抗氧化酶活性的影响。结果表明,外源一氧化氮能抑制淹水胁迫期间黄瓜根质膜相对透性和丙二醛含量的增加,淹水8 d时,经SNP处理的黄瓜根质膜相对透性和丙二醛含量与对照分别达到显著和极显著差异;能延缓叶片叶绿素含量的下降,使淹水期间叶片能维持较高的光合能力,淹水8 d时,经SNP处理的黄瓜叶片叶绿素含量和光合速率极显著高于对照;外源一氧化氮能提高淹水胁迫时黄瓜根SOD、POD、CAT的活性,淹水8 d时,经SNP处理的黄瓜根SOD、POD活性与对照达到极显著差异,CAT活性与对照达到显著差异。研究表明外源一氧化氮能提高黄瓜幼苗的耐涝性。
黄瓜;一氧化氮;耐涝性
黄瓜(Cucumis sativus L.)为葫芦科黄瓜属植物,是世界上的主要蔬菜作物,具有产量高、营养丰富、效益好等特点。黄瓜一生需水量较大,但不耐涝,特别是苗期,适宜的土壤含水量为60%~70%。如果田间积水而发生淹涝胁迫,会对黄瓜幼苗生长及后期产量带来严重的影响。6—8月是我国露地黄瓜生产的主要时期,气温高、降水多,涝害已经成为露地黄瓜生产的主要胁迫因子之一。一氧化氮(nitric oxide,NO)是具有生物学活性的气体分子,在植物遭受生物或非生物胁迫时,可作为一种重要的信号物质提高植物的抗逆性。研究表明,NO可提高植物对盐胁迫[1-4]、碱[5]、水分胁迫[6-8]、温度胁迫[9-10]、重金属[11-13]等逆境的抵抗能力。NO和黄瓜抗性关系的研究主要集中在低温胁迫[14-15]、盐胁迫等方面[16-17],NO和黄瓜耐涝关系的研究未见报道。本试验用硝普钠(Sodi⁃um nitro⁃prusside,SNP)作为外源NO供体,研究外源NO和黄瓜幼苗耐涝性的关系,为生产上应用NO提高黄瓜幼苗耐涝性提供理论依据。
1 材料与方法
1.1 材料
供试材料为黄瓜品种‘新津研四号’,由辽宁省新民市东高蔬菜种子繁育场提供。
1.2 试验设计
选择大小均匀且饱满的黄瓜种子,28℃催芽。然后将发芽一致的种子播于盛有泥土的塑料钵里,每钵2粒,人工气候箱中培养。光照周期为12 h光照/12 h黑暗,光照强度80 μmol·m-2·s-1,温度周期为28℃/15℃。相对湿度80%。当黄瓜幼苗长至2 叶1心时,以叶片喷施100 μmol·L-1硝普钠溶液为处理组(标记为NO),叶片喷施蒸馏水为对照组(标记为CK),每组设3次重复,每个重复30钵。每天喷施1次,连续喷施2 d。之后对黄瓜幼苗进行淹水处理,淹水时水层保持2 cm左右,在淹水后的0、2、4、6、8 d测定各项生理指标。
1.3 测定内容与方法
选取黄瓜幼苗第1叶进行叶绿素含量和光合速率测定;按照Arnon的方法测定叶片叶绿素含量(以鲜质量计)[18];用LI-6400光合仪测定叶片光合速率,测定条件为光照强度800 μmol·m-2·s-1,温度(28±1)℃;选用幼苗根测定根的各项指标,根质膜相对透性参照刘鸿先[19]的方法测定,丙二醛(MDA)含量(以鲜质量计)参照Heath[20]的硫代巴比妥酸法测定;超氧化物歧化酶(SOD)活性(以鲜质量计)参照王爱国等[21]的方法测定;过氧化物酶(POD)活性参照李瑞智[22]愈创木酚法测定;以每min吸光度变化值表示酶活性大小,即以ΔA470·g-1·min-1表示;过氧化氢酶(CAT)活性按南京建成生物工程公司试剂盒说明进行测定,以每g鲜质量每s消耗H2O2的量表示(μmol·g-1·s-1)。采用SPSS 19.0软件对试验数据进行统计分析。
2 结果与分析
2.1 NO对淹水胁迫下黄瓜根质膜相对透性的影响
淹水使黄瓜根质膜相对透性增加(图1),说明淹水对黄瓜根系产生了伤害,造成细胞原生质外流。淹水4、8 d时,根质膜相对透性分别为未淹水(0 d)时的161.6%和232.2%。外源NO可使淹涝时黄瓜根质膜相对透性增加的趋势得到一定程度的抑制,淹水4、8 d时,经SNP处理的黄瓜根质膜相对透性分别为同期对照的68.4%、77.2%。淹水4、6 和8 d,经SNP处理的黄瓜根质膜相对透性显著低于对照。

图1 NO对淹水胁迫下黄瓜根质膜相对透性的影响
2.2 NO对淹水胁迫下黄瓜根MDA含量的影响
随着淹水时间的延长,黄瓜根MDA含量呈上升趋势(图2)。淹水4、8 d时,根MDA含量分别为未淹水(0 d)时的206.3%和324.3%,说明随着淹水时间的延长,黄瓜根细胞过氧化程度加剧。外源NO可抑制淹涝时黄瓜根MDA含量的增加,淹水4、8 d时,经SNP处理的黄瓜根MDA含量分别为同期对照的66.6%、57.1%。生物学统计分析表明,淹水6、8 d,经SNP处理的黄瓜根MDA含量与对照相比,分别达到显著和极显著差异。

图2 NO对淹水胁迫下黄瓜根丙二醛含量的影响
2.3 NO对淹水胁迫下黄瓜叶绿素含量的影响
淹水使黄瓜叶绿素含量下降(图3),淹水4、8 d时,叶绿素含量分别为未淹水(0 d)时的84.6%和46.2%。外源NO可抑制黄瓜淹水时黄瓜叶绿素含量的下降,淹水4、8 d时,经SNP处理的黄瓜叶绿素含量分别为同期对照的1.1、1.8倍。淹水6、8 d,经SNP处理的黄瓜叶绿素含量与对照相比,分别达到显著和极显著差异。
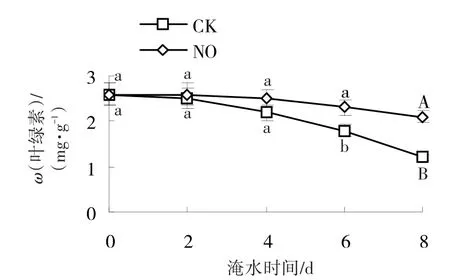
图3 NO对淹水胁迫下黄瓜叶绿素含量的影响
2.4 NO对淹水胁迫下黄瓜叶片光合速率的影响
对淹水期间黄瓜叶片光合速率的测定发现,淹水胁迫使黄瓜叶片光合速率下降,外源NO处理可抑制黄瓜叶片光合速率的下降(图4)。淹水4、8 d时,光合速率分别为未淹水(0 d)时的74.7%和21.9%;经SNP处理的黄瓜叶片光合速率分别为同期对照的1.2、2.6倍。淹水6、8 d,经SNP处理的黄瓜叶片光合速率与对照相比,差异分别达到显著和极显著水平。

图4 NO对淹水胁迫下黄瓜叶片光合速率的影响
2.5 NO对淹水胁迫下黄瓜根SOD活性的影响
淹水胁迫下,黄瓜根SOD活性呈先上升后下降的趋势(图5)。对照组和处理组SOD活性分别在淹水4、6 d时达到最高,而后开始下降。从图中可以看出,经SNP处理的黄瓜根SOD活性一直高于对照。淹水2、4、6和8 d时,处理组黄瓜根SOD活性分别是对照组的2.5、1.7、3.7和8.3倍,差异分别达到了显著和极显著水平。
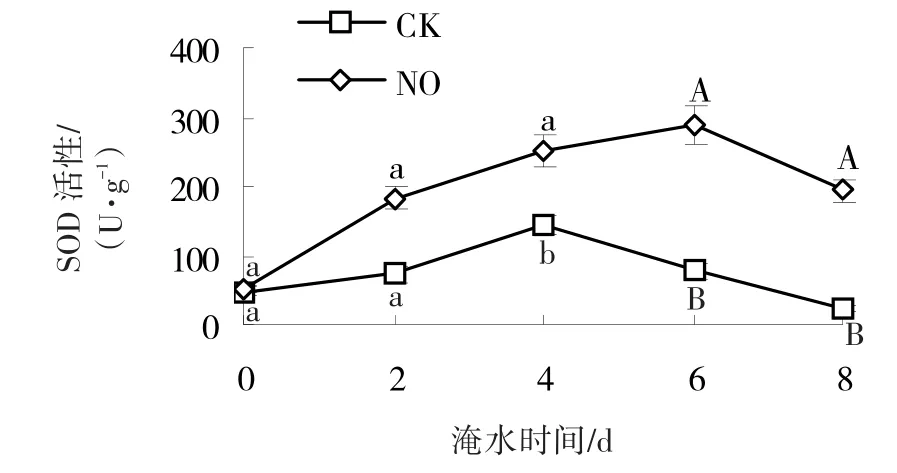
图5 NO对淹水胁迫下黄瓜根SOD活性的影响
2.6 NO对淹水胁迫下黄瓜根POD活性的影响
对照组和处理组黄瓜根POD活性分别在淹水4、6 d时达到最高,而后开始下降(图6)。NO可提高淹水胁迫下黄瓜根POD活性。淹水6、8 d时,经SNP处理的黄瓜根POD活性是对照组的1.5倍、2.1倍,差异分别达到了显著和极显著水平。

图6 NO对淹水胁迫下黄瓜根POD活性的影响
2.7 NO对淹水胁迫下黄瓜根CAT活性的影响
黄瓜根CAT活性在淹水胁迫下表现出了与SOD活性和POD活性相同的变化趋势(图7),即先上升后下降。淹水6、8 d时,经SNP处理的黄瓜根CAT活性是对照组的3.3倍、2.7倍,差异分别达到极显著和显著水平。
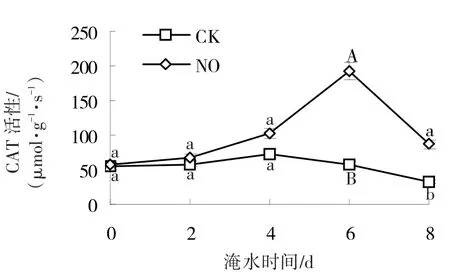
图7 NO对淹水胁迫下黄瓜根CAT活性的影响
3 讨论与结论
当土壤水分达到饱和时,植物处于淹水状态,根系是植物受到淹水胁迫后最初的直接受害器官,质膜相对透性增加,细胞原生质外流。细胞质膜过氧化作用加剧,MDA含量升高,导致根系活力降低[8]。这表明淹水胁迫导致根细胞膜结构被破坏,影响了植物对矿质元素及营养成分的吸收与利用。外源NO可有效缓解淹水胁迫对黄瓜幼苗的伤害,抑制质膜相对透性和MDA含量的升高,保护质膜结构的完整性,使根系在淹水胁迫时能维持良好的吸收水分和养分的能力。淹水胁迫使黄瓜叶片叶绿素含量下降,光合速率下降,而外源NO能有效地缓解叶绿素含量的下降,维持叶片较高的光合速率。
淹水初期,黄瓜根SOD、POD和CAT等抗氧化酶活性呈上升趋势,这是植物在受到淹水胁迫时的应激反应,抗氧化酶活性的增加有利于清除淹水胁迫时产生的活性氧及减缓膜质过氧化产物对根的伤害[23]。随着淹水时间的延长,酶活性开始下降,说明黄瓜根受到了严重的伤害。作为植物体抗性反应中的一种重要的信号物质,NO可调控活性氧的形成,抑制膜脂过氧化,增加植物对逆境的抵抗能力[24]。硝普钠能够在溶液中缓慢释放NO,因此广泛用作NO供体[25]。硝普钠处理能提高淹水胁迫时黄瓜根SOD、POD、CAT等抗氧化酶活性,并且能维持较长时间的抗氧化酶活性,从而能够有效清除涝害时黄瓜根产生的活性氧,有效缓解活性氧对黄瓜的伤害,使黄瓜幼苗在涝害下仍能维持较高的根系活力和叶片光合能力,从而提高黄瓜的耐涝性。
[1] ZHAO M G,TIAN Q Y,ZHANG W H.Nitric oxide synthase de⁃pendent nitric oxide production is associated with salt tolerance in Arabidopsis[J].Plant Physiology,2007,144(1):206-217.
[2] 刘开力,凌腾芳,刘志兵,等.外源NO供体SNP浸种对盐胁迫下水稻幼苗生长的影响[J].植物生物学通讯,2004,40(4):419-422.
[3] 郑春芳,姜东,戴廷波,等.外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响[J].生态学报,2010,30(5):1174-1183.
[4] 周万海,师尚礼,寇江涛.一氧化氮对NaCl胁迫下苜蓿种子萌发的影响[J].核农学报,2012,26(4):710-716.
[5] 郭继平.外源一氧化氮对碱胁迫下大豆幼苗生理指标的影响[J].种子,2015,34(1):5-7.
[6] 邵瑞鑫,李蕾蕾,郑会芳,等.外源一氧化氮对干旱胁迫下玉米幼苗光合作用的影响[J].中国农业科学,2016,49(2):251-259.
[7] 刘建新,王金成,王瑞娟,等.外源一氧化氮对渗透胁迫下黑麦草幼苗光合和生物发光特性的影响[J].草业学报,2013,22 (1):210-216.
[8]张健,刘美艳.外源一氧化氮提高玉米抗芽涝的研究[J].玉米科学,2014,22(5):76-80.
[9] 杨美森,王雅芳,干秀霞,等.外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响[J].中国农业科学,2012,45(15):3058-3067.
[10] 李秀,巩彪,王允,等.高温胁迫下外源一氧化氮对生姜叶片多胺代谢及PSII的调控作用[J].中国农业科学,2014,47(6):1171-1179.
[11] 刘柿良,潘远智,杨容孑,等.外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J].植物营养与肥料学报,2014,20(2):445-458.
[12] 陈银萍,蘧苗苗,苏向楠.外源一氧化氮对镉胁迫下紫花苜蓿幼苗活性氧代谢和镉积累的影响[J].农业环境科学学报,2015,34(12):2261-2271.
[13] 夏海威,施国新,黄敏,等.一氧化氮对植物重金属胁迫抗性影响的研究进展[J].生态学报,2015,35(10):1-12.
[14] 肖春燕,邢潇晨,刘会芳,等.低温下NO对黄瓜光合荧光及抗氧化特性的影响[J].核农学报,2014,28(6):1083-1091.
[15] 樊怀福,杜长霞,朱祝军.外源NO对低温胁迫下黄瓜幼苗生长、叶片膜脂过氧化和光合作用的影响[J].浙江农业学报,2011,23(3):538-542.
[16] 王春林,刘建新,尚菲,等.外源一氧化氮对盐胁迫下白皮黄瓜种子萌发的影响[J].北方园艺,2014(8):26-29.
[17] 焦娟,王秀峰,杨凤娟,等.外源一氧化氮对硝酸盐胁迫下黄瓜幼苗生长及抗氧化酶活性的影响[J].应用生态学报,2009,20 (12):3009-3014.
[18] ARNON D I.Coper enzymes in isolated chloroplants.polypheno⁃loxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):10-15.
[19] 刘鸿先,曾韶西,王以柔,等.低温对不同耐寒力的黄瓜(Cucu⁃mis sativus)幼苗子叶各细胞器中超氧物歧化酶(SOD)的影响[J].植物生理学报,1985,11(1):48-57.
[20] HEATH R L,PARKER L.Photoperoxidation in isolated chloro⁃plasts.Ⅰ.Kinetics and stoichiometry of fatty acid peroxidation [J].Arch Biochem Biophys,1968,125(1):189-198.
[21] 王爱国,罗广华,邵从本,等.大豆种子超氧化物歧化酶的研究[J].植物生理学报,1983,9(1):77-83.
[22] 李瑞智,黄林.SO2对作物叶片过氧化物酶的影响[J].西南师范大学学报,1984,9(3):380-385.
[23] HSU Y T,KAO K H.Cadmium toxicity is reduced by nitric in rice leaves[J].Plant Growth Regul,2004,42(3):227-238.
[24] LIU M Y,SUN J,WANG K Y,et al.Spermidine enhances water⁃logging tolerance via regulation of antioxidant defence,heat shock protein expression and plasma membrane H+-ATPase activity in Zea mays[J].Journal of Agronomy and Crop Science,2014,200 (3):199-211.
[25] 徐洪雷,于广建.一氧化氮(NO)对黄瓜低温胁迫的缓解作用[J].东北农业大学学报,2007,38(5):606-608.
郑重声明
本刊最近接到部分作者反映,有冒充与本刊合作的网站骗取作者版面费的情况,为避免作者上当受骗,本刊郑重声明:本刊只接收网上投稿(投稿系统:http://zgxg.cbpt. cnki.net);编辑部电话:0371-65330927;本刊无个人账号接收作者版面费。
《中国瓜菜》编辑部
Enhancement of waterlogging tolerance of cucumber seedlings by nitric oxide
ZHANG Jian,LIU Meiyan
(School of Life Science,Jiangsu Normal University,Institute of Integrative Plant Biology,Xuzhou 221116,Jiangsu,China)
In order to enhance the waterlogging tolerance of cucumber seedlings,100 μmol·L-1sodium nitroprusside(SNP)was used as a donor of exogenous nitric oxide(NO),the effects of exogenous NO on the plasma membrane,photosynthetic characteristics and antioxidant enzyme activities of cucumber seedlings under waterlogging stress were explored.The results indicated that exogenous NO could inhibited the increase of relative plasmalemma permeability and malondialdehyde of cucumber seedlings under waterlogging stress.The relative plasma membrane permeability and MDA content of the cucumber root treated by SNP were extremely significant different from that of control under waterlogging stress for 8 days. Exogenous NO could retard the decomposing of chlorophyll,maintain the photosynthetic capacity of cucumber seedlings under waterlogging.The chlorophyll content and photosynthetic rate of cucumber leaves treated by SNP were extremely higher than that of control group under waterlogging stress for 8 days.Exogenous NO could increase the activities of SOD, POD,CAT.The activities of SOD and POD of the cucumber root treated by SNP were highly significant and that of CAT were significant different from that of control group under waterlogging stress for 8 days.This experiment showed that exoge⁃nous NO could impove the capacity of anti-waterlogging stress of cucumber seedlings.
Cucumber;Nitric oxide;Waterlogging tolerance
2016-04-12;
2016-11-12
转基因生物新品种重大专项转基因生物分子特征识别技术(2011ZX08012-002);江苏高校优势学科建设工程项目;2014年徐州市科技计划项目(XF13C056)
张健,男,副教授,主要从事植物生理学的教学与科研工作。E-mail:zhangjian@jsnu.edu.cn
刘美艳,女,副教授,从事生物化学与分子生物学的研究。E-mail:liumeiyan@jsnu.edu.cn
