慢病毒介导过表达NTCP的NTCP-SK-Hep1细胞系构建
2017-06-15刘正芸肖冬焱周艳萌高兴红
勾 英,刘正芸,肖冬焱,周艳萌,罗 果,高兴红,王 欢,3
(1.遵义医学院 医学微生物学教研室,贵州 遵义 563099;2.遵义医学院 医学与生物学研究中心,贵州 遵义 563099;3.贵州省普通高等学校 传染病与生物安全特色重点实验室,贵州 遵义 563099)
基础医学研究
慢病毒介导过表达NTCP的NTCP-SK-Hep1细胞系构建
勾 英1,2,刘正芸2,3,肖冬焱1,2,周艳萌1,罗 果2,3,高兴红2,3,王 欢1,2,3
(1.遵义医学院 医学微生物学教研室,贵州 遵义 563099;2.遵义医学院 医学与生物学研究中心,贵州 遵义 563099;3.贵州省普通高等学校 传染病与生物安全特色重点实验室,贵州 遵义 563099)
目的 建立钠离子-牛磺胆酸共转运蛋白(NTCP)过表达的肝癌细胞系,以作为研究乙肝病毒(HBV)感染的细胞模型。方法 构建NTCP慢病毒重组质粒 Gv-NTCP,挑取克隆进行PCR扩增和序列测定;将阳性重组质粒与慢病毒辅助质粒共转染HEK293T细胞,包装Gv-NTCP慢病毒并进行病毒滴度测定;Gv-NTCP慢病毒感染人肝癌细胞株SK-Hep1,嘌呤霉素筛选,通过荧光显微镜,PCR和Western blot检测NTCP的表达。结果 测序结果证实Gv-NTCP慢病毒载体构建成功;在HEK293T细胞中包装的Gv-NTCP慢病毒滴度为2.0×108TU / mL;该病毒感染SK-Hep1细胞后,在荧光显微镜下可见感染细胞表达绿色荧光,PCR结果显示感染组的NTCP表达明显增高,WB结果显示感染组的NTCP蛋白表达明显增高。结论 成功建立了NTCP过表达的人肝癌细胞系NTCP-SK-Hep1。
钠离子-牛磺胆酸共转运蛋白;肝癌细胞;慢病毒载体
钠离子-牛磺胆酸钠共转运多肽(Na+/taurocholate cotransportingpolypeptide,NTCP)是多次跨膜糖蛋白,主要在肝细胞的基底膜上表达。它是溶质载体蛋白(solute carrier family 10, SLC10)家族中发现的第一个转运体蛋白,主要介导钠依赖性胆汁酸从血液中的摄取,参与类固醇硫酸盐的摄取[1],在胆汁酸的肠肝循环中发挥重要作用[2]。研究发现,NTCP是乙型肝炎病毒(hepatitis B virus,HBV)及丁型肝炎病毒(hepatitis D virus,HDV )的功能性受体[2],且NTCP和HBV的L蛋白之间的相互作用是其进入肝细胞的关键[3]。
笔者在前期实验中发现人肝癌细胞SK-Hep1是一种低表达NTCP细胞,本研究通过建立稳定过表达NTCP基因的人肝癌SK-Hep1细胞,以期为进一步研究HBV提供新的细胞模型。
1 材料与方法
1.1 细胞株、菌株和质粒 人胚肾细胞 HEK293T细胞及人肝癌细胞SK-Hep1细胞均由本实验室保存,大肠杆菌菌株DH5α感受态细胞购自吉凯公司;GV358载体购自上海吉凯基因化学技术有限公司,质粒pHelper 1.0及pHelper 2.0均来自美国Invitrogen公司,含有病毒包装所需的元件;GV358载体含有HIV的基本元件5’LTR和5’LTR以及WRE等辅助元件,同时含有绿色荧光蛋白(GFP)基因。
1.2 主要试剂 引物(GeneRay);内切酶AgeI、EcoRⅠ(上海吉凯基因化学技术有限公司);TaqDNA聚合酶、T4 DNA连接酶(大连宝生物公司);逆转录试剂(Promega公司);质粒纯化试剂盒(北京天根生化科技有限公司);Gibco血清、α-MEM培养基、EDTA-胰酶消化液(GIBCO公司);嘌呤霉素(Sigma公司);兔抗人NTCP抗体(Santa Cruz公司);兔抗人β-actin(北京博奥森生物技术有限公司);IRDye800 Cw标记的羊抗兔IgG荧光二抗(odyssesy公司)。
1.3 方法
1.3.1 Gv- NTCP慢病毒重组质粒构建及鉴定 取对数生长期的SK-Hep1细胞,提取总RNA,根据GenBank 中NTCP的 编 码 序 列(NM003049)设计引物:上游:5’-GAG GAT CCC CGG GTA CCG GTC GCC ACC ATG GAG GCC CAC AAC GCG TCT GC- 3’,下游:5’-TCC TTG TAG TCC ATA CCG GCT GTG CAA GGG GAG CAG TCC TC- 3’。经PCR扩增获得目的基因NTCP,1%琼脂糖凝胶电泳分离,回收目的片段并进行纯化。将纯化的PCR产物和经BamHI和AgeI酶切的GV358慢病毒载体进行交换,交换反应产物转化感受态细胞中,混匀,在冰上放置30 min,42 ℃热激90 s,冰浴2 min。加入500 μL LB培养基,置于37 ℃摇床振荡培养1 h。取适量菌液均匀涂布在含有1%氨苄青霉素的平板上,在恒温培养箱中倒置培养12 h;挑取单克隆,做菌液PCR进行初步鉴定。初步鉴定正确后进行摇菌,取适量菌液送上海吉玛制药技术有限公司测序。将测序正确的转化子进行扩增,无内毒素质粒提取试剂盒提取质粒DNA,按照试剂盒说明书进行操作,将其命名为Gv-NTCP。
1.3.2 HEK293T、SK-Hep1细胞培养 分别采用含10%胎牛血清的DMEM及α-MEM培养基,37 ℃、5% CO2细胞培养箱培养。
1.3.3 Gv-NTCP慢病毒包装 转染前24 h,将对数生长期的HEK293T细胞以5 ×106/ 15 mL接种于10 cm细胞培养皿。待细胞密度达80%时进行转染。转染前2 h将细胞培养基更换为无血清培养基。按照Lipo 2000操作说明,取Gv-NTCP 20 μg,包装质粒(pHelper1.0 15 μg,pHelper 2.0 10 μg)与1.5 mL的Opti-MEM混合均匀,同时将脂质体60 μg与Opti-MEM混合均匀,将两者混合均匀,室温静置15 min,进行共转染包装细胞HEK293T,于37 ℃、5% CO2培养箱中培养。6 h后弃去含有转染混合物的培养基,加入含10%胎牛血清的DMEM培养基15 mL,继续培养。72 h后收集细胞培养上清,4 ℃,4 000 rpm离心10 min,除去细胞碎片;以0.22 μm滤器过滤,分装后置-80 ℃冰箱中保存。
1.3.4 Gv-NTCP病毒滴度测定 测定前1 d,取对数生长期HEK293T细胞接种于96孔板,每孔加入培养基100 μL。24 h后吸去90 μL培养基,分别加入以10倍梯度稀释好的Gv-NTCP病毒液90 μL,继续培养,24 h后,加入完全培养基100 μL,72 h后,加入嘌呤霉素(5 μg/mL)继续培养24 h,镜下观察感染后的活细胞数量,以此计算病毒滴度。病毒滴度=每孔活细胞数/病毒原液量。
1.3.5 过表达NTCP基因的SK-Hep1细胞系筛选 将SK-Hep1细胞按2×103/孔接种于96孔板中。待细胞融合度达到约30%~40%时,分别加入GV-NTCP病毒液、阴性对照病毒液进行感染。用a-MEM 培养基清洗孔板2遍, 然后添加病毒稀释液10 μL (MOI=16,含9.5 μL Ehanced Infection Solution和0.5 μL Gv-NTCP慢病毒)和含50 μg/mL polybrene的无血清培养基90 μL,充分混匀,37 ℃、5% CO2培养8~16 h后观察细胞状态并更换为新鲜培养基,感染后96 h加入嘌呤霉素(2 μg/mL),继续培养48 h,Gv-NTCP病毒组和阴性对照病毒组有细胞漂浮,消化细胞传代继续培养,重复筛选1次,培养5代后,无细胞死亡,命名为NTCP-SK-Hep1和NC-SK-Hep1,收获细胞进行后续检测。
1.3.6 Real-time PCR检测NTCP-SK-Hep1中NTCPmRNA 设计Real-time PCR检测引物(NTCP上游:5’-CTC TCT TCT GCC TCA ATG GAC-3’,下游5’-CAG TTG TGG CAG CTG TGT AG-3’;β-actin上游:5’-GTG GGG CGC CCC AGG CAC CA -3’,下游5’-CTC CTT AAT GTC ACG CAC GAT TTC),交由上海生工合成。分别用Trizol按酚氯仿法提取SK-Hep1、NC-SK-Hep1及NTCP-SK-Hep1细胞的总RNA,通用引物反转录后进行 Real-time PCR检测。PCR反应条件:95 ℃预变性 3 min;95 ℃变性10 s、60 ℃退火45 s,40个循环;65 ℃延伸5 min。制备2%琼脂糖凝胶,取以上已测量各DNA样品与6× DNA Loading Buffer分别混合,以12 μL均量上样,电压90 V,电泳90 min后凝胶图像处理系统观察结果。
1.3.7 Western blot法检测NTCP-SK-Hep1中NTCP蛋白的表达 收集SK-Hep1、NC-SK-Hep1及NTCP-SK-Hep1细胞,提取细胞总蛋白,用BCA法进行蛋白定量。根据蛋白浓度每孔上样50 μg蛋白,进行10% SDS-PAGE蛋白凝胶电泳,350 mA转膜2 h、5%脱脂牛奶封闭2 h后,TBST洗膜3次,兔抗人一抗[NTCP(1∶200),β-actin(1∶200)]4 ℃孵育过夜,TBST洗膜3次,室温下IRDye 800 Cw标记的羊抗兔IgG荧光二抗(1∶10 000)孵育1 h,用ODYSSEY双色红外激光成像系统检测NTCP和内参β-actin的表达。
2 结果
2.1 Gv-NTCP慢病毒重组载体构建 将连接的重组慢病毒质粒、GV358载体分别转化DH5α,涂板,37 ℃培养,挑取8个重组克隆(图1中的5~12泳道)及1个阴性克隆,提取质粒,进行PCR反应扩增,PCR产物经1%琼脂糖凝胶电泳鉴定,可见其重组质粒转化子在1 200 bp左右出现条带,其大小符合预期(见图1)。将阳性克隆测序,测序结果与克隆模板序列比对完全一致(见图2),表明 Gv-NTCP慢病毒载体构建成功。
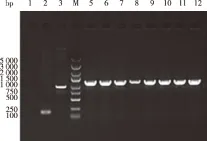
1:空白对照(ddH2O); 2:阴性对照(GV358载体); 3:阳性对照(GAPDH);M:Marker;5~12:1~8号重组质粒转化子。 图1 Gv-NTCP慢病毒重组质粒PCR扩增产物凝胶电泳结果

图2 Gv-NTCP阳性克隆的测序比对结果
2.2 Gv-NTCP慢病毒包装及病毒滴度测定 Gv-NTCP与慢病毒包装质粒pHelper 1.0及pHelper 2.0共转染HEK293T细胞,在荧光显微镜下观察嘌呤霉素筛选后HEK293T的数量。结果提示,Gv-NTCP慢病毒已经成功感染HEK293T细胞,Gv-NTCP载体包装成功。计算得出病毒滴度为2.0×108TU/mL。
2.3 过表达NTCP的NTCP-SK-Hep1细胞系的筛选及鉴定
2.3.1 Gv-NTCP慢病毒液感染细胞 将Gv-NTCP慢病毒液与阴性对照病毒液分别感染SK-Hep1细胞,通过荧光倒置显微镜观察GFP表达情况。结果显示,在转染Gv-NTCP慢病毒96 h后,在荧光显微镜下观察到大量绿色荧光蛋白表达的SK-Hep1细胞(见图3A、3B);而在转染对照病毒相同时间后,仅见部分SK-Hep1细胞表达较弱的绿色荧光蛋白(见图3C、3D )。嘌呤霉素持续加压筛选、传代后在倒置荧光显微镜下观察到各转染细胞中均有绿色荧光蛋白表达(见图3E、3F、3G、3H)。此结果表明,Gv-NTCP慢病毒已经成功感染SK-Hep1细胞,NTCP-SK-Hep1细胞系药物筛选成功。

A:明场(Gv-NTCP病毒感染96 h后); B:荧光(Gv-NTCP病毒感染96 h后); C:明场(对照病毒液感染96 h后);D:荧光(对照病毒液感染96 h后); E:明场(Gv-NTCP病毒感染及嘌呤霉素筛选后14 d);F:荧光(Gv-NTCP病毒感染及嘌呤霉素筛选后14 d); G:明场(对照病毒液感染及嘌呤霉素筛选后14 d); H:荧光(对照病毒液感染及嘌呤霉素筛选后14 d)。图3 Gv-NTCP慢病毒感染的SK-Hep1细胞(×100)
2.3.2 Real-time PCR和Western blot检测NTCP-SK-Hep1中NTCP mRNA和蛋白表达 Real- time PCR的检测结果显示:与对照组细胞相比,NTCP-SK-Hep1细胞系中NTCP的mRNA表达水平显著升高(见图4A),差异有统计学意义(P<0.05)。Western blot检测结果也表明,NTCP-SK-Hep1细胞系中 NTCP蛋白的表达水平也明显升高(见图4B,4C)。以上结果提示过表达NTCP的NTCP-SK-Hep1细胞系构建成功。
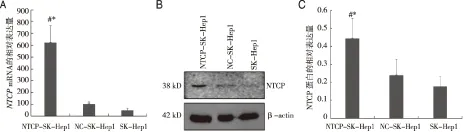
A:NTCP mRNA的相对表达量;B,C:各组细胞中NTCP蛋白的相对表达量。NTCP-SK-Hep1与SK-Hep1细胞比较,*P<0.05; NTCP-SK-Hep1与NC-SK-Hep1细胞比较,#P<0.05。图4 SK-Hep1细胞中的NTCP基因及蛋白表达
3 讨论
HBV感染是一种严重影响公共卫生和人体健康的全球性流行性疾病,尽管乙肝防治能力已有很大提高,但其严峻现状仍不容忽视。根据世界卫生组织报道: 全球约20亿人曾感染HBV,其中2.4亿人为慢性HBV感染者,每年约有65万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌(Hepatocellular carcinoma,HCC)。中国是乙型肝炎的高流行区:2014年全国1~29岁人群乙型肝炎流行病学调查结果显示,1~4岁、5~14岁和15~29岁人群HBsAg阳性率分别为0.32%、0.94%和4.38%[中国《慢性乙型肝炎防治指南》(2015年版)]。目前,乙肝的抗病毒治疗药物主要有干扰素(Interferon,IFN)和核苷(酸)类似物[nucleos(t)ide analogues,NAs][4]。但这些药物也有其不足之处,如IFN应答率低,副作用大,NAs易引起耐药以及停药反弹[5-8];IFN及NAs的HBV表面抗原(HBsAg)转阴的疗效欠佳[9]。因此,深入研究HBV,进一步揭示HBV的确切发生机制,探究药物的有效治疗靶点,具有重要的社会意义和临床意义。
细胞模型是体外研究HBV的重要工具。目前用于研究HBV的细胞模型大致分为两种:转染细胞系模型和感染细胞系模型[10]。HepG2.2.15细胞系是经典的转染细胞模型,它是将重组载体质粒polTHBV-1转染人肝癌细胞株HepG2细胞,经G418筛选构建而成的细胞系[11]。该细胞模型虽然已被广泛用于研究HBV生活周期、感染HBV基因组细胞与正常细胞之间的免疫活性以及抗HBV药物筛选等方面,但是,它却并不适于研究 HBV感染肝细胞的早期分子机制,即从HBV入侵到cccDNA产生阶段[10]。虽然人原代肝细胞(PHH)、原代树鼩肝细胞(PTH)和HepaRG细胞系已被用作HBV感染模型,但是这3种模型价格昂贵,应用条件有限,难以保持其对HBV的易感性[12-13]。因此,寻求细胞模型构建的新方法成了HBV研究的重要组成部分。2012年对NTCP的突破性发现极大地推动了HBV细胞模型和动物模型的发展。研究证实:将外源性NTCP导入对HBV并不易感的HepG2[3,12]、HuH7[3,14]及HepaR G[3]细胞后均可实现其对HBV的有效感染。实际上,NTCP过表达细胞模型的构建也在不断发展。罗梦月[15]运用慢病毒的方法构建了稳定表达hNTCP的LLC-PKl细胞模型(LLC-PKl/NTCP),王宇泽[16]使用hNTCP慢病毒感染人肝癌细胞株HepG2获得稳定表达hNTCP的HepG2-NTCP细胞株。Verrier等[17]用转染的方法构建了Huh7-NTCP细胞。
SK-Hep1细胞是1975年确定、报告的肝癌细胞[18]。该细胞来源于肝腺癌病人腹水,属于内皮细胞,具有分化程度低[18],侵袭性及迁移力较强的特点[19]。SK-Hep1细胞同时也是最稳定的,分裂和分化能力很强的间充质细胞[19]。 换言之,我们认为:SK-Hep1细胞株的生物学特性相对稳定,有体外易培养的优点,如用于转染、构建细胞模型,便于扩大培养。此前,何玉琦等[20]用SK-Hep1细胞建立了SK-Hep1Cyb细胞模型,用以探讨线粒体DNA缺失对肝癌细胞表型影响;彭晓慧等[21]建立了受强力霉素调控的,可用于c-myc基因功能研究的细胞株SK-Hep1 tet-on 10#;赵文淘等[22]建立了稳定过表达miR-26a的肝癌细胞株。因此在本研究中,我们选用SK-Hep1细胞用于HBV研究的细胞模型。
慢病毒载体作为一种外源性转基因载体,是以HIV-1的主要功能元件为基础构建起来的转基因和基因治疗载体[23]。慢病毒载体技术是广泛运用于稳定基因过表达的转导技术[24]。它能够实现持续的基因传递、将载体稳定的整合到宿主基因组;能够感染分裂和非分裂细胞;载体转导后并不表达病毒蛋白[24]。经过20多年的不断改进,慢病毒载体也更为安全、有效。
在本研究中,我们采用了GV358慢病毒载体构建慢病毒重组质粒Gv-NTCP,用HEK293T细胞包装获得Gv-NTCP慢病毒液,再用该病毒液感染SK-Hep1细胞,进一步构建NTCP过表达的NTCP-SK-Hep1细胞。同时,我们采用GFP为报告基因,通过观察绿色荧光直接评价NTCP蛋白质在细胞中的表达情况。在慢病毒感染后,经过嘌呤霉素筛选的14 d,便可获得稳定过表达NTCP的NTCP-SK-Hep1细胞。筛选出的稳定表达株在mRNA及蛋白水平均有较高的NTCP表达,说明我们获得了稳定过表达NTCP的人肝癌细胞NTCP-SK-Hep1,这为乙肝的进一步研究提供了工具。
本研究通过构建Gv-NTCP慢病毒载体,包装出Gv-NTCP慢病毒液,用其感染人肝癌细胞SK-Hep1,筛选出NTCP过表达的SK-Hep1细胞,从mRNA水平及蛋白水平加以验证,最终证明:过表达NTCP的人肝癌NTCP-SK-Hep1稳转细胞系得以成功构建。这一结果将为后续研究奠定坚实的基础。
[1] Geyer J,Wilke T,Petzinger E.The solute carrier family SLC10:more than a family of bile acidransporters regarding function and phylogenetic relationships[J].Naunyn-Schmiedebergs Arch Pharmacol,2006,372(6):413-431.
[2] Yan H,Peng B,Liu Y,et al.Viral entry of hepatitis B and D viruses and bile saltstransportation share common moleculardeterminants on sodiumtaurocholate cotransporting polypeptide[J].Journal of Virology,2014,88(6):3273-3284 .
[3] Yan H,Zhong G,Xu G,et al.Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J].E Life,2012,3(1):e00049.
[4] Kwon H,Lok A S.Hepatitis B therapy[J].Nature Reviews Gastroenterology and Hepatology,2011,8(5):275-284.
[5] Feng H,Hu K H.Structurl characteristics and molecular mechanism of hepatitis B virus reverse[J].中国病毒学:英文版,2009,43(6):509-517.
[6] Ying C,Li Y,Leung C H,et al.Unique antiviral mechanism discovered anti-hepatitis B virus research with a natural product analogue[J].Pro Natl Acad Sci USA,2007,104(20):8526-8531.
[7] Ganem D,Prince A M.Hepatitis B virus infectionn-natural history and clinical consequeces[J].N Engl J Med,2004,350(11):1118-1129.
[8] Glebe D.Recent advances in hepatitis B virus research:a German point of view[J].World J Gastoenterol,2007,13(1):8-13.
[9] 张伟,贾继东,陈力元.乙型肝炎抗病毒治疗2014年国内外进展[J].中华肝脏病杂志,2015,23(1):2-4.
[10] 于德敏,张欣欣,陆志檬.HBV细胞模型及其在抗病毒药物研究中的应用[J].国际流行病学传染病学杂志,2003,30(4):212-215.
[11] 韩建,王晓娟,刘鹏,等.HepG2.2.15细胞模型功能的重新评价:分泌HBV DNA、cccDNA及血清学标志物的动态变化研究[J].中国病原生物学杂志,2013,8(5):385-388 .
[12] Okuyamadobashi K,Kasai H,Tanaka T,et al.Hepatitis B virus efciently infectsnon-adherent hepatoma cellsvia human sodium taurocholatecotransporting polypeptide[J].Scientific Reports,2015,5:17047.
[13] 吴文楠,欧启水.人NTCP与HBV感染的研究进展[J].中华微生物学和免疫学杂志,2015,35(9):703-705.
[14] Ni Y,Lempp F A,Mehrle S,et al.Hepatitis B and D viruses exploit sodiumtaurocholate co-transporting polypeptide for species--specific entry into hepatocytes[J].Gastroenterology,2014,146(4):1070-1083.
[15] 罗梦月.稳定表达Na+-牛磺胆酸钠共转运多肽LLC-PK1细胞模式的构建及应用[D].杭州:浙江大学,2015.
[16] 王宇泽.表达人源NTCP的小鼠肝细胞限制HBV的生活史[D].厦门:华侨大学,2015.
[17] Verrier E R,Colpitts C C,Bach C,et al.A targeted functional RNAi screen uncovers glypican 5 as an entryfactor for hepatitis B and D viruses[J].Hepatology,2016,63(1):35-48.
[18] Fogh J,Trempe G.New human tumor cell lines[M].Springer US,1975:115-159.
[19] Heffelfinger S C,Hawkins H H,Barrish J,et al.SK HEP-I:A human cell line of endothelial origin[J].In Vitro Cell Dev Bio- Animal,1992,28(2):136-142
[20] 何玉琦,凌贤龙.线粒体DNA缺失SK-Hep1细胞转线粒体模型的建立及生物学特性分析[J].细胞生物学杂志,2009,31(1):107-112.
[21] 彭晓慧,毛宣,汤顺清.受四环素调控的真核表达系统SK-Hep1细胞株的建立[J].生物技术通报,2012(2):93-96.
[22] 赵文淘,赵尊兰,史俊文,等.稳定过表达miR-26a肝癌细胞株的建立[J].热带医学杂志,2013,13(2):140-142.
[23] 牛鑫,邓志华.慢病毒载体及其在肿瘤基因治疗中的研究应用[J].国际肿瘤学杂志,2014,41(6):422-424.
[24] Sakuma T,Barry M A,Ikeda Y,et al.Lentiviral vectors:basic to translational[J].Biochem J,2012,443(3):603-618.
[收稿2016-10-29;修回2016-12-23]
(编辑:王静)
Establishment of SK-Hep1 cell lines over-expressed NTCP gene by lentiviral system
GouYing1,2,LiuZhengyun2,3,XiaoDongyan1,2,ZhouYanmeng1,LuoGuo2,3,GaoXinghong2,3,WangHuan1,2,3
(1.Department of Microbiology,Zunyi Medical University,Zunyi Guizhou 563099,China; 2.Research Center for Medicine and Biology,Zunyi Guizhou 563099,China; 3.Key Laboratory of Infectious Diseases & Biosafety,Guizhou Ordinary High School,Zunyi Guizhou 563099,China)
Objective To establish the SK-Hep1 cell lines over-expressed NTCP gene by lentiviral vector and further investigate the hepatitis B virus (HBV) cell model.MethodsNTCPgene was amplified by PCR and sub-cloned into the lentiviral vector GV358 and then was assessed by DNA sequencing.The recombinant lentivirus was generated by co-transfection of three plasmids into HEK293T cells.The titer of virus was calculated according to the number of the viable HEK293T cells infected by the recombinant virus.The recombinant lentivirus was used to infect hepatocellular carcinoma cell line SK-Hep1.Puromycin was applied to screen stably-transfected cells.Fluorescence microscope,real-time PCR and western blot assays were carried out to detect the expression of NTCP.Results DNA sequencing verified that NTCP was successfully inserted into GV358 vector,and Gv-NTCP virus was obtained in 293T cells.The titer of recombinant lentivirus was 2.0×108TU/mL.The SK-Hep1 cell line was infected by GV-NTCP virus and the transfected cell line stably expressing NTCP gene was selected.The results of real-time PCR and western blot assays showed thatNTCPgene expression in the stable transfected cell line was more than that in the control group (P<0.05).Conclusion A stable SK-Hep1 cell line withNTCPgene over-expression is successfully constructed.
NTCP; hepatoma cell; lentiviral vector
国家自然科学基金资助项目(NO:81360261);贵州省科学技术基金资助项目(NO:黔科合J字LKZ[2013]08)。
王欢,女,博士,教授,硕士生导师,研究方向:抗病毒感染,E-mail:wh@zmc.edu.cn。
R346
A
1000-2715(2017)02-0150-06
