γδT细胞在乙肝病毒表面抗原转基因(HBs-Tg)小鼠肝纤维化模型中的作用
2017-06-13孟子愉吴震州赵立青
孟子愉,吴震州,赵立青
(南开大学生命科学学院,天津 300071)
γδT细胞在乙肝病毒表面抗原转基因(HBs-Tg)小鼠肝纤维化模型中的作用
孟子愉,吴震州,赵立青
(南开大学生命科学学院,天津 300071)
利用乙肝病毒表面抗原转基因(HBs-Tg)小鼠与γδT细胞缺陷型(TCRδ-/-)小鼠杂交,筛选出HBs-Tg-TCRδ-/-小鼠.采用腹腔连续注射四氯化碳(CCl4)的方式建立了小鼠肝纤维化模型,探讨了γδT细胞在HBs-Tg小鼠肝纤维化模型中的作用.结果表明:与HBs-Tg小鼠相比,HBs-Tg-TCRδ-/-小鼠反映肝损伤和肝纤维化的相关指标ALT及α-SMA,TIMP1,COl1a1基因表达水平显著增高——肝纤维化更为严重——γδT细胞在HBs-Tg小鼠肝纤维化模型中具有保护作用.为今后γδT细胞对肝纤维化的治疗奠定了一定基础.
γδT细胞;肝纤维化;HBs-Tg小鼠
肝脏损伤或慢性炎症是促进肝纤维化形成的关键因素,同时伴有细胞外基质(ECM)沉积,继而可导致肝硬化或肝功能衰竭.肝星状细胞(HSC)是肝ECM胶原成分的主要来源,星状细胞被持续激活可产生大量胶原沉积在汇管区、中央静脉周围、肝窦和肝细胞间促进肝纤维化形成.细胞外基质成分包括:α-平滑肌肌动蛋白(α-SMA)、基质金属蛋白酶(MMP)、组织金属蛋白酶抑制物(TIMP)、转化生长因子β(TGF-β)等[1-2].长期腹腔注射四氯化碳(CCl4)可构建小鼠肝纤维化模型,以用于肝纤维化机制和治疗药物的研究等.
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)慢性感染是造成肝纤维化和肝癌的重要原因.HBV的感染可以加速肝纤维化的形成,但是这一过程的免疫应答机制仍不十分清楚,特别是在携带乙肝病毒状态下.[3]近年来的研究发现,乙肝病毒表面抗原转基因(HBs-Tg)小鼠对于CCl4诱导的肝损伤和肝纤维化高度敏感,并伴有HSC的激活,而这一过程中自然杀伤性T细胞(NKT)分泌的白细胞介素4(IL-4)和白细胞介素13(IL-13)对于HSC的激活起到了重要作用.[2]
γδT细胞作为T细胞亚群之一,具有独特的生物学特性和功能.与αβT细胞相比,γδT细胞的研究相对滞后.γδT细胞为主要组织相容性复合体(MHC)非限制性细胞,是一种既具有天然免疫应答特性,又具备适应性免疫应答性质的淋巴细胞,所以又称“固有类淋巴细胞”(innate-like lymphocytes).根据T细胞受体不同,外周γδT细胞主要分为Vγ1和Vγ4γδT细胞两个亚群,这两个亚群在自身免疫性疾病中起很重要的调控作用.近期的研究表明,胸腺的选择可能是γδT细胞分为IFN-γ和IL-17两群细胞的一个原因,接受抗原刺激的γδT细胞分化为IFN-γ+细胞,而未接受刺激的分化为IL-17+细胞.[4]本文利用HBs-Tg和HBs-Tg与γδT细胞缺陷型(TCRδ-/-)小鼠杂交筛选出的HBs-Tg-TCRδ-/-小鼠,腹腔连续注射CCl4建立小鼠肝纤维化模型,以探讨γδT细胞在HBs-Tg转基因小鼠肝纤维化模型中的作用.
1 材料和方法
1.1 实验动物
C57BL/6J(WT)、C57BL/6J-TgN(AlblHBV)44Bri transgenic(HBs-Tg)、HBs-Tg-TCRδ-/-小鼠,雄性,6~8周龄,体重18~20 g,饲养于南开大学生命科学学院实验动物中心SPF级动物房.
1.2 主要试剂
无水CCl4购于SIGMA-ALDRICH公司(货号:289116);橄榄油(olive oil)购于上海生工生物工程有限公司(货号:A502795-0100);丙氨酸氨基转移酶测定试剂盒(赖氏法)购于上海荣盛生物技术有限公司;TRIzol Reagent购于Invitrogen公司(货号:15596018);cDNA第一链合成试剂盒(货号:RR037A)、RealMasterMix(SYBR Green,货号:RR820A)试剂盒购于Takara公司.
1.3 动物模型建立
[5]中的方法建立肝纤维化模型:将雄性WT小鼠随机分组,每组10只,实验组腹腔注射体积分数25%的CCl4油剂溶液(0.05 mL/kg),对照组按同样方法注射等剂量的橄榄油,每周2次,连续8周.将雄性WT,HBs-Tg,HBs-Tg-TCRδ-/-小鼠随机分组,每组5只,注射体积分数25%的CCl4油剂溶液(0.05 mL/kg),每周2次,连续8周.[5]通过测量血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)含量及肝脏外观变化等确定肝纤维化模型是否造模成功.
1.4 血清丙氨酸氨基转移酶含量测定
在CCl4造模后第2,4,6,8周,每只小鼠依次眼静脉取血,取血后室温静置2 h,5 000 r/min离心8 min,提取血清样品.按试剂盒说明书操作(赖氏法)检测血清中ALT含量.
1.5 实时荧光定量PCR
在CCl4造模后第8周,眼静脉放血后处死小鼠,留取肝脏组织.利用TRIzol法提取肝脏组织RNA,反转录成cDNA,随后使用SYBR Green荧光染料定量检测各基因mRNA表达水平.内参基因选取GAPDH,反应温度为95℃,3 min预变性后,进行40个循环,每个循环反应包括:95℃,15 s;60℃,30 s.随后95℃,15 s;60℃,15 s;60℃~95℃缓慢升温25 min产生融解曲线.
1.6 统计分析
采用GraphPad PRISM 5.0 数据处理软件进行统计分析.两组间差异显著性分析采用t检验,三组及以上组间差异显著性分析采用One-way ANOVA分析.*表示P<0.05,有显著性差异;**表示P<0.01,有极显著性差异.
2 结果
2.1 WT小鼠肝纤维化模型构建
2.1.1 WT小鼠肝纤维化造模后血清中ALT动态变化
为检测CCl4肝纤维化造模后小鼠肝损伤水平,我们首先检测小鼠血清中ALT水平的变化.如图1所示,腹腔注射CCl4造模6周和8周后,随造模时间推移,ALT水平也随之升高.实验组(CCl4组)6周、8周ALT水平高于对照组(橄榄油组),且均有显著性差异.实验组ALT水平为对照组的2倍左右,表明实验组(CCl4组)肝损伤(纤维化)水平更为严重.

*P<0.05,**P<0.01,***P<0.001图1 WT小鼠肝纤维化造模后血清中ALT的变化
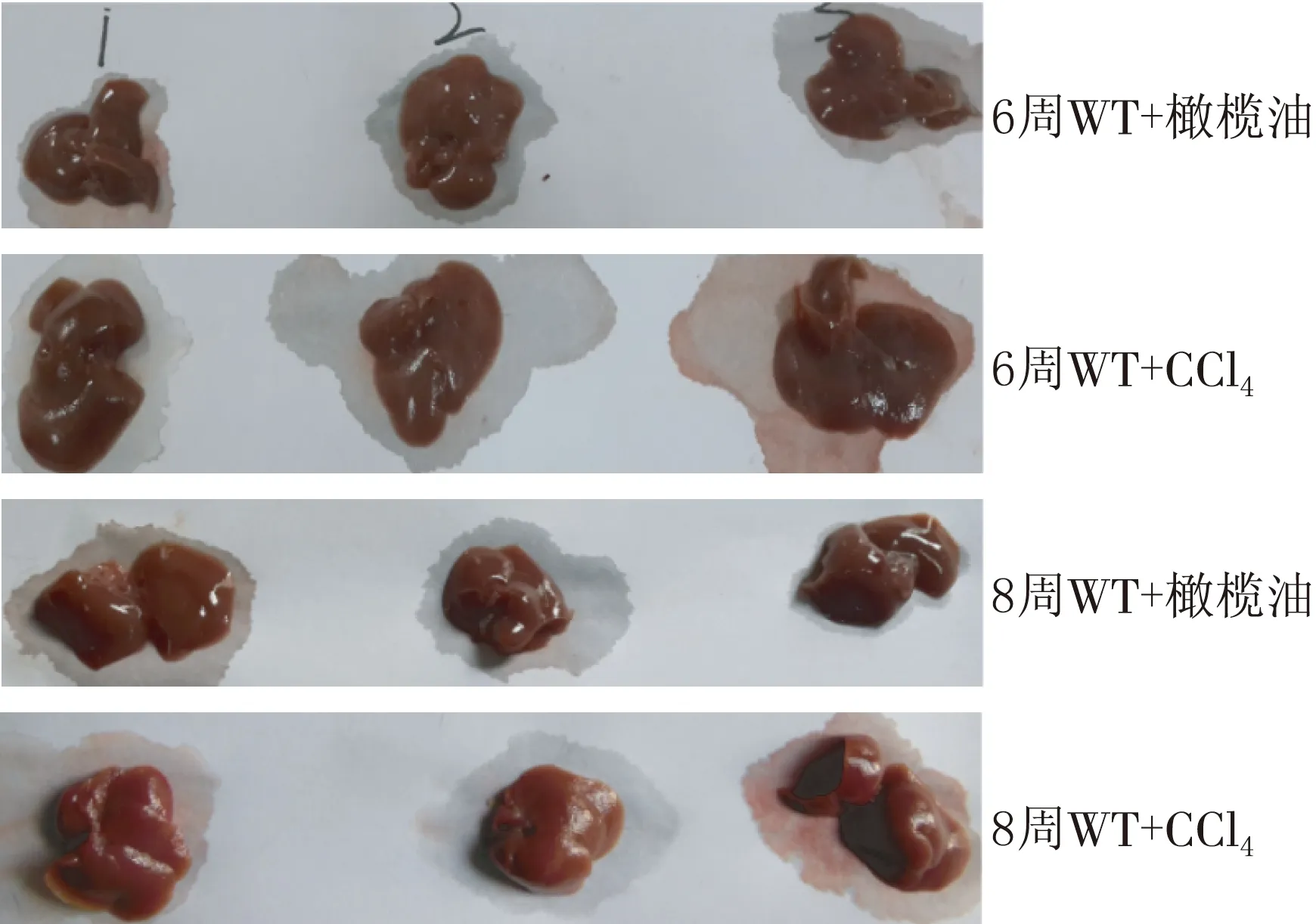
图2 WT小鼠肝纤维化造模后肝脏外观变化
2.1.2 WT小鼠肝纤维化造模后肝脏外观变化
如图2所示,腹腔注射CCl4造模6~8周后,实验组(CCl4组)小鼠肝脏表面粗糙不平,有大小不等的结节,凹凸不平,质硬,韧性大;而对照组(橄榄油组)小鼠肝脏表面光滑平整,呈暗红色,质地软,边缘锐利.结果表明四氯化碳(CCl4)建造肝纤维化模型基本成功.
2.2 HBs-Tg小鼠的γδT细胞在肝纤维化模型中的作用
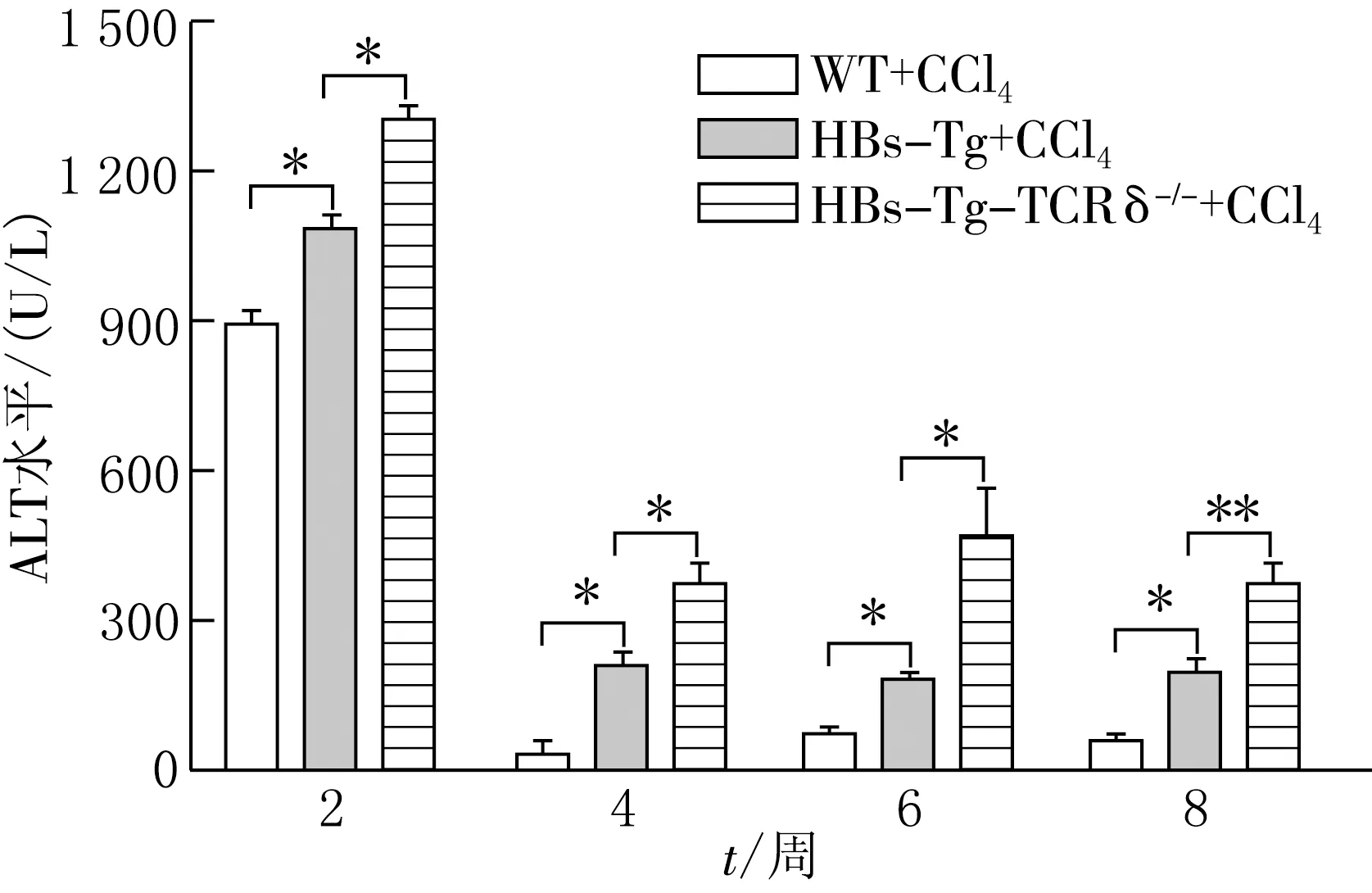
*P<0.05,**P<0.01,***P<0.001图3 WT,HBs-Tg,HBs-Tg-TCRδ-/-小鼠肝纤维化造模后血清中ALT的变化
为进一步探讨HBs-Tg小鼠的γδT细胞在肝纤维化模型中的作用,选取WT,HBs-Tg和HBs-Tg-TCRδ-/-小鼠,连续8周腹腔注射CCl4建立肝纤维化模型.分别在2,4,6,8周检测这3种小鼠血清中的ALT水平.结果(见图3)显示,HBs-Tg小鼠血清中ALT水平高于WT小鼠,且两组间有显著性差异,表明与WT小鼠相比,HBs-Tg小鼠肝损伤(纤维化)更为严重;而HBs-Tg-TCRδ-/-小鼠血清中ALT水平高于HBs-Tg小鼠,两者间也具有显著性差异,表明与HBs-Tg小鼠相比,HBs-Tg-TCRδ-/-小鼠肝损伤(纤维化)更为严重,而HBs-Tg小鼠的γδT细胞在肝纤维化过程中可能起到了保护作用.
2.3 WT,HBs-Tg和HBs-Tg-TCRδ-/-小鼠肝组织中肝纤维化相关基因表达情况
根据2.1和2.2的结果,CCl4造模8周后小鼠肝纤维化已基本形成,且ALT水平有显著性差异,因此选取CCl4造模8周这一时间点,通过实时荧光定量PCR检测WT,HBs-Tg和HBs-Tg-TCRδ-/-小鼠肝组织中肝纤维化相关基因的表达情况,结果见图4.由图4可见,与WT小鼠相比,HBs-Tg小鼠肝脏α-SMA,TIMP1,Col1a1基因高表达,且两者具有显著性差异;而HBs-Tg-TCRδ-/小鼠肝脏α-SMA,TIMP1,Col1a1基因表达水平显著高于HBs-Tg小鼠.α-SMA,TIMP1,Col1a1基因表达水平与肝纤维化程度呈正相关,进一步证明HBs-Tg小鼠的γδT细胞在肝纤维化过程中起到了保护的作用.
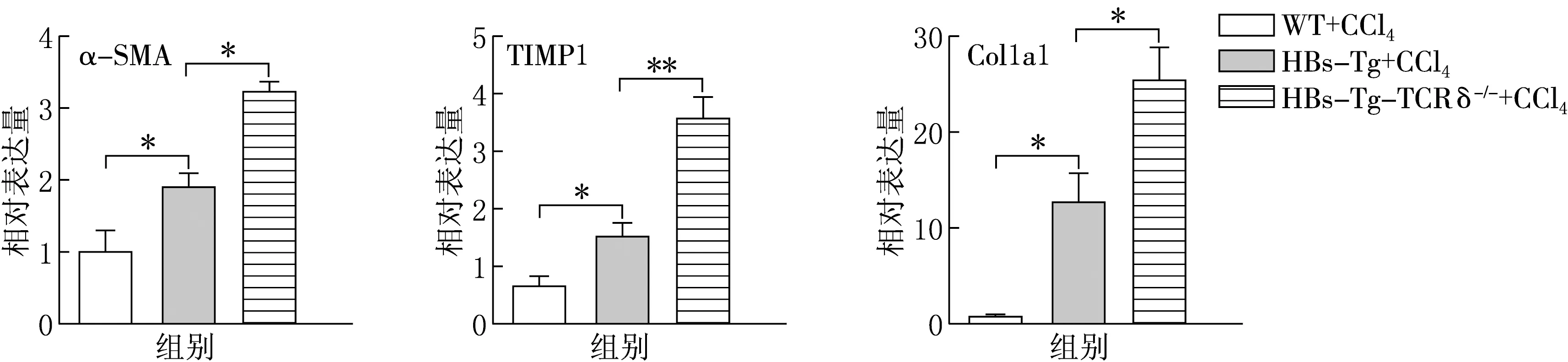
图4 WT,HBs-Tg和HBs-Tg-TCRδ-/-小鼠肝组织中肝纤维化相关基因表达情况
3 讨论
肝纤维化是各种慢性肝损害所致的病理改变,各种病因所致反复或持续的慢性肝实质炎症或坏死可导致肝脏持续不断的纤维增生而形成肝纤维化.肝纤维化的发病机制尚不完全清楚,目前国内引起肝纤维化的病因以乙型病毒性肝炎最为常见,而国外以慢性酒精性肝病最为常见.本项研究中选取的CCl4是一种选择性肝毒性物质,是经典的肝纤维化诱导剂.CCl4诱导的小鼠肝纤维化模型与人类的肝纤维化病理过程相似,同时还具有简单易行、耗时短、成模率高、具有明显的肝纤维化分期过程、停止给药后有自然恢复趋势等特点.[6]本项研究首先利用WT小鼠应用CCl4构建肝纤维化模型,通过血清ALT和肝脏外观变化可证实肝纤维化造模基本成功.
在临床研究中,乙型肝炎病毒(HBV)感染会发展为肝纤维化,但是这一过程中的具体免疫应答机制不是很清楚,特别是HBV携带状态下.本项研究选用的HBs-Tg小鼠,其过表达乙肝病毒表面抗原(HBsAg),尽管在肝细胞或血清中能检测到HBsAg,但是却没有肝功能异常和病理损伤,小鼠形成免疫耐受,模拟HBV感染后的病毒携带状态.[7]近年来多种HBV 携带转基因小鼠的制成对研究HBV 诱导的免疫病理损伤机制和新药物开发提供了新的手段.为探究γδT细胞在HBsAg转基因小鼠肝纤维化模型中的作用,利用WT,HBs-Tg,HBs-Tg-TCRδ-/-小鼠构建肝纤维化模型后,HBs-Tg-TCRδ-/-小鼠反映肝损伤程度的血清ALT水平,反映肝纤维化程度的肝脏组织α-SMA,TIMP1,Col1a1基因表达水平均显著高于HBs-Tg小鼠,结果提示HBs-Tg小鼠的γδT细胞在肝纤维化过程中起到了保护作用.
γδT细胞作为连接固有免疫和适应性免疫的桥梁,在很多疾病过程中均发挥着重要作用.在胶原诱导的关节炎(collagen-induced arthritis,CIA)疾病模型中,Vγ4 γδT细胞产生的白介素17(IL-17A)可促进CIA的疾病进程[8];同时在李斯特菌感染过程中,γδT细胞产生的IL-17A可以抵抗感染过程[9].组织分布的特异性、周围微环境、抗原受体的结构等均可以影响γδT细胞发挥不同的功能[10].肝脏是人体的一种特殊器官,既负责清除体内毒素物质(过滤器),同时又是一种富含大量免疫细胞的脏器.随着对多种肝损伤模型的深入研究,研究者发现不同刺激诱发的肝损伤由不同的免疫细胞介导.我们之前的研究结果表明,γδT细胞在ConA引起的急性肝损伤中起到了保护作用,这一过程主要是由γδT细胞分泌的IL-17A调控NKT分泌IFN-γ介导.[11]肝脏的这些免疫细胞之间通过细胞因子、黏附因子及细胞间相互作用而形成一种独特的网络.由于肝损伤最终导致肝纤维化甚至肝癌等高风险疾病,因此深入了肝纤维化发生发展过程中肝脏免疫细胞间的相互调控机制具有深远意义.本文的研究结果为今后γδT细胞对肝纤维化的治疗提供了一个新的思路和方法.
[参 考 文 献]
[1] HAMMERICH L,BANGEN J M,GOVAEREO,et al.Chemokine receptor CCR6-dependent accumulation of γδT cells in injured liver restricts hepatic inflammation and fibrosis[J].Hepatplogy,2014,59(2):630-642.
[2] JIN Z X,SUN R,WEI H M,et al.Accelerated liver fibrosis in hepatitis B virus transgenic mice:involvement of natural killer T cells[J].Hepatology,2011,53(1):219-229.
[3] PERZ J F,ARMSTRONG G L,FARRINGTON L A,et al.The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide[J].J Hepatol,2006,45(5):529-538.
[4] JENSEN K D,SU X Q,SHIN S,et al.Thymic selection determines γδ T cell effector fate:antigen-naive cells makeinterleukin-17 and antigen-experienced cells make Interferon γ[J].Immunity,2008,29(4):90-100.
[5] ARRIAZUE,GALARRETA M R,LOPEZ-ZABALZA M J,et al.GCN2 kinase is a key regulator of fibrogenesis and acute and chronic liver injury induced by carbon tetrachloride in mice[J].Lab Invest,2013,93:303-310.
[6] 黄迪,古维立,胡志文,等.大鼠肝纤维化模型建立及肝纤维化的检测[J].广州医药,2012,43(5):56-60.
[7] GILLES PN,GUERRETTER D L,ULEVITCH R J,et al.HBsAg retention sensitizes the hepatocyte to injury by physiological concentrations of Interferon-γ[J].Hepatology,1992,16(3):655-663.
[8] ROARK CL,FRENCH J D,TAYLOR M A,et al.Exacerbation of collagen-induced arthritis by oligoclonal,IL-17-producing γδT Cells[J].J Immunol,2007,179:5576-5583.
[9] HAMADA S,UMEMURA M,SHIONO T,et al.IL-17A produced by γδ T cells plays a critical role in innate immunity againstListeriamonocytogenesinfection in the liver[J].J Immunol,2008,181:3456-3463.
[10] CARDING S R,EGAN P J.γδT cells:functional plasticity and heterogeneity[J].Nat Rev Immunol,2002(2):336-345.
[11] ZHAO N,HAO J L,NI Y Y,et al.Vγ4 γδT cell-derived IL-17A negatively regulates NKT cell function in ConA-induced fulminant hepatitis[J].J Immunol,2011,187:5007-5014.
(责任编辑:方 林)
The role of γδT cells in CCl4-indecued liver fibrosis
of hepatitis B virus transgenic mice
MENG Zi-yu1,WU Zhen-zhou1,ZHAO Li-qing1
(College of Life Sciences,Nankai University,Tianjin 300071,China)
γδT cells is one subset of T cells and serve as a bridge between innate and adaptive immune responses.γδT cells also play regulatory roles in anti-tumor,virus infection and autoimmune diseases.In this study,using HBs-Tg mice crossed with TCRδ-/-mice to obtain HBs-Tg-TCRδ-/-mice,explored the role of γδT cells in CCl4-induced liver fibrosis of HBs-Tg mice.The results demonstrated that ALT,α-SMA,TIMP1,COl1a1 levels of HBs-Tg-TCRδ-/-mice were significantly higher than HBs-Tg mice,and γδT cells of HBs-Tg mice played a protective role in CCl4-induced liver fibrosis.The results provided the foundation for further research of liver fibrosis treatment via γδT cells.
γδT cells;liver fibrosis;HBs-Tg mice
1000-1832(2017)02-0116-04
10.16163/j.cnki.22-1123/n.2017.02.022
2016-09-09
国家自然科学基金资助项目(31170858,31370883).
孟子愉(1988—),女,博士研究生;通讯作者:赵立青(1962—),女,博士,教授,博士研究生导师,主要从事基础免疫学研究.
R 392.1 [学科代码] 180·2150
A
