大肠杆菌刺激猪肠上皮细胞后Nramp1基因的表达变化分析
2017-06-10戴超辉吴嘉韵吴圣龙包文斌
戴超辉,吴嘉韵,孙 丽,吴圣龙,2,包文斌,2*
(1. 扬州大学动物科学与技术学院江苏省动物遗传繁育与分子设计重点实验室,江苏扬州 225009;2. 江苏省种猪繁育和健康养殖工程技术研究中心,江苏扬州 225009)
大肠杆菌刺激猪肠上皮细胞后Nramp1基因的表达变化分析
戴超辉1,吴嘉韵1,孙 丽1,吴圣龙1,2,包文斌1,2*
(1. 扬州大学动物科学与技术学院江苏省动物遗传繁育与分子设计重点实验室,江苏扬州 225009;2. 江苏省种猪繁育和健康养殖工程技术研究中心,江苏扬州 225009)
猪天然抗性相关巨噬细胞蛋白基因1(Naturalresistance-associated Marophage Protein 1, Nramp1)作为影响抗病力的重要候选基因之一,在机体的免疫过程中发挥着重要的调控作用。为了在细胞水平上探讨Nramp1基因与引起仔猪腹泻的致病性大肠杆菌的关系及其在大肠杆菌感染过程中发挥的免疫调控作用,本研究利用F18ab、F18ac和K88ac等3种致病性大肠杆菌刺激体外培养的猪肠上皮细胞IPEC-J2,并利用实时荧光定量PCR检测3种菌体刺激IPEC-J2后Nramp1基因的表达变化情况。结果表明:F18ab、F18ac和K88ac 3种大肠杆菌刺激IPEC-J2后,Nramp1基因的表达均发生极显著(P<0.01)上调,差异倍数分别为10、8、11倍,且F18ab和K88ac 2种菌体刺激后Nramp1基因的表达上调程度均极显著高于F18ac。本研究结果提示,Nramp1基因的表达与大肠杆菌的侵染有很大的相关性,其在大肠杆菌侵袭猪肠道中发挥了重要的免疫调控作用。本研究在细胞水平分析探讨了Nramp1基因的表达与3种致病性大肠杆菌侵袭的关系,为Nramp1基因在大肠杆菌侵染机体的过程中发挥的免疫调控作用研究提供了参考依据。
猪;大肠杆菌;Nramp1基因;抗病育种
天然抗性相关巨噬细胞蛋白基因1(Naturalresistance-associated Marophage Protein 1, Nramp1)是天然抗性相关巨噬细胞蛋白家族成员之一,不但能影响动物的自身免疫,还与沙门氏菌及多种胞内病原微生物的抵抗作用有关[1-2]。猪的Nramp1基因位于15号染色体q23-26,其基因组全长约15 kb,共有15个外显子和14个内含子[3]。在目前抗病育种研究中与畜禽疾病相关的少数几个候选基因中,抗性相关巨噬蛋白基因Nramp1是与免疫相关的重要候选基因[4]。大量研究表明猪Nramp1基因的多态性与免疫功能以及仔猪腹泻具有显著的关联[4-7],加之Nramp1基因保守的序列结构及其对疾病的抗性的非病原特异性[1,8],研究探讨Nramp1基因与大肠杆菌性仔猪腹泻抗病力的关系具有重要的理论价值和现实意义。产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coil, ETEC)是引起初生仔猪和断奶仔猪腹泻和水肿病最常见和最重要的病原菌,大肠杆菌性仔猪腹泻仍然是引起仔猪高发病率和死亡率最主要的原因之一。先前的研究主要从DNA和mRNA的层面探讨Nramp1基因是否对猪免疫调控尤其是仔猪腹泻病发挥了重要的作用,但是仍需要进一步在细胞水平分析和验证Nramp1基因与产肠毒素性大肠杆菌抗性的关系,因此,本试验利用3种主要致病性产肠毒素性大肠杆菌(F18ab、F18ac和K88ac)刺激体外培养的猪肠上皮细胞IPEC-J2,模拟大肠杆菌侵袭仔猪肠道的攻毒环境,利用实时荧光定量PCR检测3种菌体刺激IPEC-J2后Nramp1基因的表达变化情况,分析Nramp1基因的表达与F18大肠杆菌侵染的关系,为下一步探讨Nramp1基因在机体抵抗大肠杆菌刺激过程中发挥的作用提供更加直接的参考与依据。
1 材料与方法
1.1 实验材料 猪肠上皮细胞系(IPEC-J2)由美国宾夕法尼亚大学惠赠;大肠杆菌F18ab、F18ac和K88ac由扬州大学兽医学院朱国强教授惠赠;完全培养液DMEM-F12培养基、LB培养基、胎牛血清均购自Gibco(美国);PBS磷酸缓冲液(干粉)购自北京赛因坦科技有限公司(中国,北京);Trizol裂解液购自Invitrogen(美国);反转录试剂盒和荧光定量试剂盒购自南京诺唯赞生物科技有限公司(中国,南京)。
1.2 引物设计及合成 Nramp1基因引物设计参照GenBank数据库中Nramp1基因序列(NC_010457.4),利用Primer Premier 5.0软件设计Real-time PCR引物,为避免基因组DNA污染,引物跨外显子设计;以GAPDH基因作为内参,引物均由生工生物工程(上海)股份有限公司合成。引物信息如表1所示。
1.3 大肠杆菌侵染IPEC-J2细胞 将IPEC-J2细胞以1×106/孔的密度接种到12孔板中,用含10%胎牛血清FBS的DMEM-F12完全培养液在37 ℃,5% CO2的恒温培养箱中培养至密度达到90%左右;分别接种大肠杆菌F18ab、F18ac和K88ac 至LB培养液中,在恒温摇床中37℃,200 r/min摇菌12 h,然后4000 r/min离心10 min收集菌体,PBS缓冲液重悬洗涤并离心,重复3次。用细胞培养液将细菌稀释至1.0×109CFU/mL,向12孔培养板中加入1.0 mL细菌悬液,每种菌体刺激处理设置3个重复孔,同时设置未经细菌刺激的对照孔,于37℃,5% CO2的恒温培养箱孵育4 h后收集细胞用于提取总RNA。

表1 Real-time PCR引物
1.4 细胞总RNA提取和实时荧光定量PCR 利用Trizol法提取各孔板细胞总RNA,提取步骤严格按照Trizol Reagent说明书操作,并以1%甲醛变性琼脂糖凝胶电泳检测RNA完整程度,使用ND-1000核酸/蛋白浓度测定仪测定浓度及纯度,-70℃保存备用。以RNA为模板进行cDNA合成:10 μL的反应体系中含5×qRT SuperMix II 2 μL,总RNA 500 ng,RNase free ddH2O补足至10 μL。反应条件为25℃ 10 min,50℃ 30 min,85℃ 5 min,4℃保存。
实时荧光定量PCR反应体系为:模板cDNA 2.0 μL,上下游引物(10 μmol/L)各0.4 μL,2× SYBR Premix ExTapTMII 10 μL,50× ROX Reference Dye II 0.4 μL,RNase free ddH2O补足至总体积20 μL,每个样本设置3个重复。扩增程序为95℃ 30 s;95℃ 5 s,60℃ 34 s,共40个循环;为了分析扩增产物的特异性,在PCR扩增结束后采集多个信息点,进行熔解曲线的分析,具体程序为95℃ 15 s,60℃ 1 min;95℃ 15 s,60℃ 15 s。
1.5 统计分析 相对定量的结果采用2-ΔΔCt法[9]进行分析处理,并利用SPSS17.0软件一般线性模型(General linear model, GLM)的Univariate统计方法分析不同菌体刺激的差异显著性,数据用平均值±标准差表示。
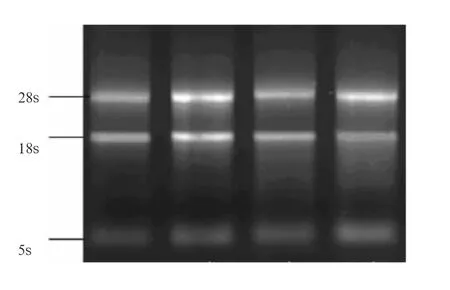
图1 总RNA提取1%琼脂糖凝胶电泳结果
2 结果与分析
2. 1 总RNA的纯度与完整性检测 如图1所示,28S、18S、5S共3条带,无DNA污染条带及明显降解,NanoDrop ND-1000核酸/蛋白浓度测定仪检测RNA纯度,样本的A260/A280为1.8~1.9,说明RNA提取的完整性和纯度较高,可用于后续试验。
2. 2 荧光定量PCR的扩增曲线与熔解曲线 由图2-A和图2-B可知,Nramp1基因成功实现扩增,且qPCR产物只有1个特异峰,无引物二聚体及非特异性产物生成。
2. 3 Nramp1基因在大肠杆菌刺激IPEC-J2后的表达变化水平 以未经细菌刺激的对照组细胞中Nramp1基因的平均表达水平为参照1,对3种大肠杆菌刺激处理的细胞中Nramp1基因mRNA的表达水平进行均一化处理。由图3可知,3种大肠杆菌刺激IPEC-J2后,Nramp1基因表达水平均发生极显著上调(P <0.01),差异倍数分别为10、8、11倍;并且不同细菌刺激后Nramp1基因表达水平上调的程度存在差异,F18ab和K88ac2种菌体刺激后Nramp1基因表达水平上调的程度要极显著高于F18ac菌体刺激后的表达水平。
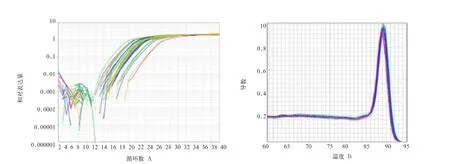
图2Nramp1基因qPCR产物在不同组织中的扩增曲线(A)和熔解曲线(B)
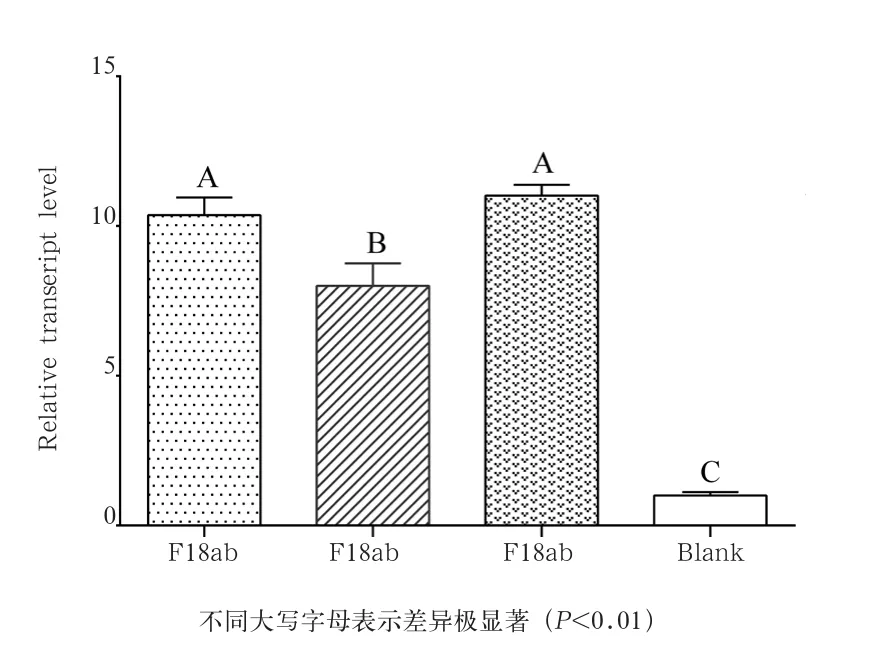
图3 F18ab、F18ac和K88ac菌体刺激细胞后Nramp1基因的表达水平
3 讨 论
本研究通过3种致病性大肠杆菌刺激体外培养的猪肠上皮细胞IPEC-J2,在细胞水平上分析探讨Nramp1基因的表达与大肠杆菌侵袭机体的关系。结果显示,经大肠杆菌刺激后的细胞中Nramp1基因的表达极显著高于未经大肠杆菌刺激的对照组细胞,提示Nramp1基因的表达与大肠杆菌的侵袭有非常密切的关系,其在大肠杆菌侵袭仔猪肠道中发挥了重要的免疫调控作用;并且F18ab和K88ac 2种菌体刺激引起Nramp1基因表达上调的程度均极显著高于F18ac,这从一定程度上说明了不同种类的大肠杆菌对机体的侵袭能力可能存在差异,F18ab和K88ac这2种大肠杆菌对机体的侵袭能力要强于F18ac。关于Nramp1基因的作用机理,前期已有研究表明,Nramp1蛋白通过转运细菌自身合成防御酶系所必需的金属离子如Mn2+或 Fe2+等使细菌无法合成防御酶系而无法生存,从而使动物抵抗病原菌侵染[10]。另外,Nramp1转运二价离子时,可通过一系列反应产生大量杀灭微生物的活性离子,激活巨噬细胞在自身免疫疾病和多种传染性疾病等方面的“多向性效应”[11]。此外,有研究发现,Nramp1基因在NO生成和促炎症反应中发挥重要作用[12]。前人的研究结合本试验初步表明,当大肠杆菌侵袭机体并进入机体后,Nramp1蛋白一方面可能通过转运大肠杆菌自身合成防御酶系所必需的二价金属离子来杀灭大肠杆菌,另一方面可能通过激活机体炎症信号通路,增强非特异性免疫效应,使机体抵抗大肠杆菌的侵染从而提高机体的抗病力。
关于Nramp1基因与仔猪腹泻的关系,目前在DNA和mRNA层面已有相关研究报道[4-8],但是还没有相关研究从细胞水平分析探讨Nramp1基因和仔猪腹泻的关系及其调控机制,本试验创新性地以体外培养的肠上皮细胞为模型,利用大肠杆菌进行活菌侵染试验,模拟体内大肠杆菌侵袭肠道组织的攻毒环境,通过刺激前后细胞中Nramp1基因的表达变化来分析探讨其在大肠杆菌刺激过程中发挥的免疫调控作用,并在细胞水平证实Nramp1基因在大肠杆菌刺激过程中确实发挥了重要的免疫调控作用,对深入研究Nramp1基因与仔猪腹泻的关系提供了一定的借鉴和参考。但考虑到离体培养的猪肠上皮细胞系和机体肠道组织有所区别,并不能完全模拟体内大肠杆菌侵袭肠道组织的攻毒环境,所以本研究只能初步说明Nramp1基因的表达和大肠杆菌的抗性具有密切关系。为了克服这个局限性,进一步研究Nramp1基因在大肠杆菌刺激过程中的免疫调控机制,下一步将利用RNAi及基因敲除结合转录组分析和转基因动物模型制备等手段,在动物模型上进行大肠杆菌体外攻毒试验,并在群体水平中进行系统分析验证,以期为Nramp1基因的功能研究以及有效分子遗传标记的筛选和确定提供指导和依据。
[1] Blackwell J M. Structure and function of the natural resistance associated macrophage protein(Nramp1), a candidate protein for infections and autoimmune disease susceptibility[J]. Mol Med Today, 1996, 2(5): 205-211.
[2] Tanaka G, Shojima J, Matsushita I, et al. Pulmonary Mycobacterium avium complex infection: Association with Nramp1 ploymorphisms[J]. Eur Respir J, 2007, 30(1): 90-96.
[3] Sun H S,Wang L, Rothschild M F, et al. Mapping of the natural resistance-associated macrophage protein 1 (NRAMP1) gene to pig chromosome 15[J]. Anim Genet, 1998 , 29(2): 138-140.
[4] 吴宏梅, 王立贤, 程笃学, 等. 猪Nramp1基因多态性与免疫功能的相关性[J]. 中国农业科学, 2008, 41(1): 215-220.
[5] 顾永娟. 猪NRAMP1基因与仔猪腹泻及其生产性状关系的研究[D]. 哈尔滨: 东北农业大学, 2006.
[6] 刘艳冬, 许厚强, 稽辛勤, 等. 香猪Nramp1基因多态性与仔猪腹泻的研究[J]. 中国畜牧兽医, 2010, 37(4): 125-127.
[7] 赵生国, 蔡原, 滚双宝, 等. 猪天然抗性相关巨噬细胞蛋白基因(Nramp1)多态性及其与仔腹泻相关性分析[J]. 农业生物技术学报, 2013, 21(11): 1351-1357.
[8] Govoni G, Gros P. Macrophage NRAMP1 and its role in resistance to microbial infections[J].Inflamm Res, 1998, 47(7): 277-284.
[9] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
[10] Supek F, Supekova L, Nelson H, et al. A yeast manganese transporter related to the acrophage protein involved inconferring resistance to mycobacteria[J]. P Nati Acad Sci, 1996, 93(10): 5105-5110.
[11] Cellier M F, Courville P, Campion C. Nramp1 phagocyte intracellular metal withdrawal defense[J]. Microbes Infect, 2007, 9(14-15): 1662-1670.
[12] Fritsche G, Nairz M, Werner ER, et al. Nramp1-functionality increases iNOS expression via repression of IL-10 formation[J]. Eur J Immunol, 2008, 38(11): 3060-3067.
Analysis of the Expression Changes of Nramp1 Gene in Pig Intestines Epithelial Cells Stimulated by Escherichia coli
DAI Chao-hui1, WU Jia-yun1, SUN Li1, WU Sheng-long1,2, BAO Wen-bin1,2*
(1.Key Laboratory for Animal Genetics, Breeding, Reproduction and Molecular Design of Jiangsu Province, College of Animal Science and Technology, Yangzhou University, Jiangsu Yangzhou 225009, China; 2. Jiangsu Engineering Research Center for Reproduction and Healthy Breeding of Boar, Jiangsu Yangzhou 225009, China)
Natural-resistance-associated marophage protein 1 (Nramp1), as one of important candidate genes affecting disease resistance,plays an important regulating role in body's immune process. To investigate the relationship between the Nramp1 gene and the invasion of pathogenic Escherichia coli (EPEC) which can cause piglet diarrhea at a cellular level and the immune regulation mechanism of Nramp1 gene in the process of Escherichia coli infection, small intestinal epithelial cells (IPEC-J2) cultured in vitro were stimulated by three kinds of pathogenic E. coli F18ab, F18ac and K88ac in this study. And real-time fluorescent quantitative PCR was used in this study to detect the expression changes of Nramp1 gene in cells stimulated by three kinds of bacteria. The results showed that there were extremely significant up-regulation of the expression of Nramp1 gene in cells stimulated by three kinds of bacteria, whose fold change reached, 10, 8 and 11 respectively(P<0.01) . At the same time, the up-regulation degree of the expression of Nramp1 gene in cells stimulated by F18ab and K88ac were significantly higher than F18ac. The results suggested that the expression of Nramp1 gene have great relevance with E. coli infection and it played an important immune regulating role in E. coli invading pig’s intestinal tract. This study investigated the relationship between the expression of Nramp1 gene and the invasion of three kinds of pathogenic E. coli at a cellular level, which provided the reference and basis for researching the immune regulation mechanism of Nramp1 gene in the process of E. coli infection.
Pig; Escherichia coli; Nramp1 gene; Resistance breeding
S828.2
A
10.19556/j.0258-7033.2017-06-040
2016-09-18;
2016-10-15
江苏省科技支撑计划(BE2015329);江苏省农业三新工程项目(SXGC[2015]326、SXGC[2016]097))
戴超辉(1993-),女,湖南新化人,硕士生,专业方向为猪抗病育种,E-mail: chdai1993@163.com
* 通讯作者:包文斌(1974-),男,博士,研究员,研究方向为猪抗病育种,E-mail: wbbao@yzu.edu.cn
