睾丸发育与精子发生相关miRNAs的研究进展
2017-06-10孙丽敏项露颉李佳蓉姜怀志
白 曼,孙丽敏,项露颉,贾 超,李佳蓉,姜怀志
(吉林农业大学动物科学技术学院,吉林长春 130118)
睾丸发育与精子发生相关miRNAs的研究进展
白 曼,孙丽敏,项露颉,贾 超,李佳蓉,姜怀志*
(吉林农业大学动物科学技术学院,吉林长春 130118)
miRNAs是一类广泛存在于真核生物中参与调节不同生物过程的非编码小RNA,可在转录后特异结合mRNAs 3'非翻译区降解靶mRNAs或抑制其翻译,调控其表达。miRNAs对精子发生的细胞特异性调控,对调节雄性生殖具有重要意义。本文概述了miRNAs的生物合成、作用机制,特别是miRNAs对睾丸组织发育及精子发生的表达调控,旨在为进一步深入研究miRNAs在雄性生殖中的作用及分子调控机制提供参考。
miRNAs;生物合成;表达调控;睾丸发育;精子发生
miRNAs是一类长约19~24 nt具有调控作用的内源性非编码单链小RNA,广泛存在于真核生物基因组,可通过特异结合mRNAs 3'非翻译区调控靶基因表达。曾被认为是“基因组垃圾”的miRNA调控人类基因组1/3以上蛋白编码基因,作为关键基因调控因子,参与细胞分化、增殖和凋亡等许多细胞过程,在转录后水平调控基因修饰作用,参与生长、发育、生殖和疾病产生等多种生物学代谢过程调控。Lee等[1]发现了第1个在转录后水平参与调控线虫胚胎发育的miRNA(lin-4)。Reinhart等[2]在线虫中发现了第2个具有转录后调控发育功能的miRNA(let-7)。此后,研究人员相继在线虫、果蝇和人体发现上百种长度相似的小分子RNA,随后又在动植物中鉴定出成百上千种与lin-4和let-7功能相似的miRNAs,并命名为microRNA(miRNA)。随着对miRNA相关进化、生物合成、表达模式等功能和分子机制研究的深入,人们建立起miRNA登记、分类和命名规则,并构建了miRNA数据库(miRBase)。
睾丸内精子发生是一个复杂而精确的过程,精子发生过程的分子事件必须受到严格调控才能将遗传信息及表观信息正确地传递给下一代。研究表明,miRNA与睾丸发育及精子发生密切相关,且miRNA表达量随着睾丸及精细胞的发育呈动态变化,miRNA表达异常会使睾丸发育和精子发生障碍,并导致雄性不育[3]。因此,深入了解调控睾丸发育和精子发生的miRNA,对于找到精子发生调控靶点和治疗雄性不育具有重要意义。
1 miRNA概述
1.1 miRNA生物合成与作用机制 真核生物miRNA合成大致需要经历几个阶段:pri-miRNA转录、pre-miRNA形成、pre-miRNA转运、双链miRNA产生及成熟,每一个生物过程都需要内切酶的参与[4]。在典型的miRNA生物合成途径中,核内miRNA host基因首先在RNA聚合酶Ⅱ和Ⅲ参与下,转录形成具有较长茎环结构的pri-miRNA,经Drosha/DGRC(人)或Drosha-Pasha(果蝇)复合体加工形成大约70 nt具有发夹结构的premiRNA。pre-miRNA通过exportion-5(核转运蛋白受体)从细胞核转移到细胞质,并在细胞质中被Dicer酶(RNaseⅢ核酸内切酶)剪切掉茎环结构,形成19~24 bp的miRNA, 即miRNA*双链体。其中一条miRNA链装载到Argonaute(AGO)蛋白上保留下来形成成熟miRNA,称为“Guide Strand”,即通常所说的miRNA;另一条链则被降解[5],称作“Passenger Strand”,也叫“*”链,常表示为“miR-×××*”,一般不容易检测到。大部分miRNA是以这种形式形成的。另外,还有几种非典型的miRNA合成途径绕过Drosha对pri-RNA剪切,在上游加工过程中,通过套索去分支酶对Mirtron及加尾Mirtron尾部剪切,产生直接适合于Dicer剪切的发夹状pre-RNA,或由shRNA及加尾shRNA在未知核酶作用下产生Dicer能剪切的发夹状pre-mRNA。之后进入细胞质中与典型miRNA形成过程相同(miRNA的典型和非典型合成途径见图1)。通过典型合成途径产生的miRNA主要来自于pri-miRNA 5'臂,而经过非典型合成途径产生的miRNA主要来自于Mirtron 3'臂[6]。
结合AGO蛋白的成熟miRNA与蛋白因子复合物结合形成RNA诱导沉默复合物(RISC)后,通过碱基互补配对原则识别靶mRNA 3'UTR,大部分miRNA通过RNA降解及翻译抑制2种作用机制发挥调控作用。当miRNA与靶mRNA 3'UTR完全互补时,可使靶mRNA降解,植物中大部分miRNA是这种作用机制;当miRNA与靶mRNA 3'UTR不完全互补时,可使靶mRNA翻译抑制,如大多数动物miRNA通过翻译抑制发挥作用[7]。研究发现,5′UTR区和编码区同样也可作为miRNA作用靶点,此时,miRNA 主要在翻译起始阶段发挥抑制作用,如通过与翻译起始复合物竞争mRNA 5′UTR区7-甲基-鸟嘌呤帽子结构,或影响核糖体大小亚基聚合抑制靶基因翻译;miRNA亦能在翻译起始后减缓核糖体在翻译中的移动速度或促进核糖体提早解离等抑制翻译,miRNA还可通过RISC结合在靶mRNA上改变mRNP结构和功能,从而促进mRNA的剪切或降解[8]。

图1 miRNA的生物合成过程[9]
1.2 miRNA命名 随着研究发展,越来越多miRNA被发现,为使miRNA能够被清楚识别而不被混淆,科学家制定了几种命名方法,最早用“-s”(sence)和 “-as”( antisence)来对先导链(-s)和*号链(-as)命名,以代表RNA双链体形成过程的正向和反向,但容易混淆,在较早的文献中容易见到这种命名方式,现已被取消。后来用“Guide Strand(先导链)”和“Passenger Strand(*)”分别命名2条链,*号链表达量特别低,所以经常被认为没有功能[10]。但自2011年开始,研究发现miRNA的*号链也有功能,且功能可能比先导链更强大。于是产生了新的命名方法,即根据miRNA产生于pre-miRNA 5'臂或3'臂而将其命名为miR-×××-5p或miR-×××-3p。miRNA成熟体一般简写为miR,miRNA前体则用mir表示。采用3~4个字母代表miRNA来源物种名缩写,阿拉伯数字表示发现先后顺序,高度同源miRNA 在数字后加上英文小写字母(a,b,c, …)。以hsamiR-199a-1-5p(也叫hsa-miR-199a-1*)为例,hsa表示miRNA来源于人,miR表示miRNA成熟体,199表示第199个被发现的miRNA,a表示miRNA在高度同源中编号为a,1表示miRNA在1号染色体上形成,5p表示miRNA来自于前体miRNA 5’臂。
目前,miRNA命名中有先导链和*号链2种,而表达量很低的*号链到底有何作用,是不是很关键,还需要大量研究证明。miRNA生物合成、作用机制及命名规则也会随着研究的新发现而更新。
2 睾丸发育相关调控miRNA
miRNA广泛表达于各种组织和细胞,且许多miRNA表达模式是固定的,但miRNA表达具有组织特异性和物种特异性。睾丸是哺乳动物产生精子和分泌雄激素的特殊组织,其中精子发生很大程度上受到miRNA调控,对睾丸中miRNA研究发现,许多miRNA在睾丸及生殖细胞(精原细胞,精母细胞及精子)中特异表达。研究人员通过高通量测序、基因芯片与qRT-PCR等方法已筛选鉴定出人、鼠、山羊等动物睾丸及生殖细胞特异表达的miRNA,以及miRNA在人、鼠、猪、狗、果蝇等睾丸中的表达谱,并筛选出不同发育阶段睾丸差异表达miRNA,发现不同发育阶段睾丸miRNA表达模式明显不同(表1)。睾丸miRNA表达阶段特异性表明,miRNA对调节睾丸发育和精子发生具有重要作用。研究发现,不同时期附睾上皮和不同附睾区域miRNA表达也存在差异,新生儿附睾检测到有127种miRNA表达,而成年人和老年人附睾分别只检测到3种和2种miRNA[11]。牛附睾头和附睾尾上皮细胞分泌的囊泡中也含有不同miRNA[12]。可见,miRNA对附睾内精子成熟也发挥了重要的调节作用。睾丸miRNA的差异表达见表1。生物技术的不断发展将有助于发现更多睾丸中特异性表达miRNA,研究miRNA的物种特异性和睾丸阶段特异性有助于解析miRNA在睾丸发育、成熟和精子发生中的调控作用。

表1 在睾丸中表达的miRNA
3 精子发生相关调控miRNA
精子发生是一个发生在睾丸曲细精管中由精原干细胞增殖分化,形成精子的复杂、精确而连续过程,主要分为3个阶段:精原细胞分化形成初级精母细胞;初级精母细胞经历两次连续减数分裂形成圆形精子细胞;圆形精子细胞分化变形为成型精子,释放到曲精细管管腔后,转移至附睾中成熟、储存。精子发生过程中,每种细胞都会产生高度有序且特异的转录组表达谱,因此,在精原细胞有丝分裂、精母细胞减数分裂及圆形精子单倍体化和后期精子变形过程都有大量特异基因参与调控。miRNA通过调控靶基因表达来调控精子发生中有丝分裂、减数分裂及减数分裂后期过程,且miRNA以细胞特异方式参与调控精子发生各个阶段。如:miR-221/ miR222可通过抑制c-KIT基因表达抑制精原细胞分化,使精原细胞处于有丝分裂状态[23]。在精原干细胞、减数分裂前细胞及减数分裂细胞(初级精母细胞)中特异表达的miRNA分别有17、11和13个,其中miR-221(精原干细胞特异表达)、miR-203(减数分裂前细胞特异表达)和miR-34b-5(初级精母细胞特异表达)的靶基因分别是 c-KIT、 RBM44和 CDK6,三者协同互作调控精子发生[24]。
3.1 miRNA对精原干细胞的调节 精原干细胞具有自我更新和分化形成精原细胞的双重特性,精子发生就是从精原干细胞开始,精原干细胞增殖和分化平衡是保证其能产生足够精原细胞从而确保终身提供精子的前提,miRNA在精原干细胞自我更新和分化过程中起到重要调节作用。精原干细胞分化是一个涉及维甲酸信号调控的过程。miR17-92簇、miR290-295簇、miR146、miR20、 miR21、miR106a、 miR106b、miR221和miR222 在富含THY1未分化的精原细胞中高表达,而在体内外维甲酸诱导的精原细胞分化过程中均显著下调,表明这些miRNA参与调控精原干细胞的增殖和分化。维甲酸抑制miR17-92簇和miR-106b表达,从而上调BIM、KIT、SOCS3和STAT3基因表达,调节精原干细胞分化,且miR17-92簇和miR-106b可通过协调互作调节精子发育,即当雄性生殖细胞中miR17-92簇缺失,miR-106b表达量会显著下调。miR-let-7家族成员(a/b/d/e/g/)可通过调节IGF1信号通路促进精原细胞分化[25];miR20 和miR106a通过下调靶基因STAT3和CCND1表达促进精原干细胞自我更新[26]。对精原干细胞起调节作用的miRNA详细见表2。
3.2 miRNA对减数分裂和精子形成的调控 减数分裂和精子形成是雄性生殖细胞特有过程。减数分裂阶段包括染色体复制、重组和精母细胞2次连续减数分裂;精子形成阶段即精子细胞分化形成精子,这2个阶段中均有大量miRNA参与精子发生表达调控。miR449 和miR34b/miR34c,通过抑制NOTCH1和DA2L基因表达影响生殖细胞分化和存活,miR-34c在粗线期精母细胞和圆形精子细胞中高表达,通过抑制ATF1基因表达影响BCL-2/ BAX基因表达,促进小鼠雄性生殖细胞凋亡。影响减数分裂和精子发生的miRNA见表3。
3.3 miRNA与精子发生障碍 精子发生障碍包括无精子症、少弱精子症、生殖细胞瘤等睾丸疾病引起的睾丸发育异常和精子发生紊乱。利用基因芯片和RT-PCR技术的研究表明,许多miRNA(如miR-449b、miR-34b、miR-517c、miR-181c和 miR-605等)在弱精子症或少精子症患者睾丸中表达量与正常男性明显不同,miR-122、miR-34c-5p、miR-146-5p、miR-374b等在无精子症患者睾丸中表达量明显下降,但在少弱精子症患者睾丸中表达量有所升高[42]。和正常男性相比,非梗阻性无精子症患者精清中miR-141(靶基因CBL和TGFβ2)、miR-7-1-3P(靶基因RBL和PIK3R3)及miR-429表达量均明显高于正常男性精清中的表达量[43]。miR-383(靶基因 FMRP )在精子成熟受阻患者睾丸中表达量下降[44]。精子发生障碍不仅与miRNA表达异常相关,还与miRNA合成异常相关。miRNA合成受到关键蛋白Dicer1、DGCR8、Drosha和AGO影响。特异性灭活雄性生殖细胞中Dicer1和DGCR8基因会使减数分裂过程发生变化,增加生殖细胞凋亡,破坏精子成熟过程,造成雄性不育[45]。雄性生殖细胞早期,Drosha缺失会使减数分裂细胞和减数分裂后细胞发生异常,导致雄性不育,AGO4富集在精母细胞核上,决定着精母细胞从有丝分裂向减数分裂的转变,AGO4缺失会抑制雄性生殖细胞减数分裂Ⅰ阶段某些miRNA的表达[46]。
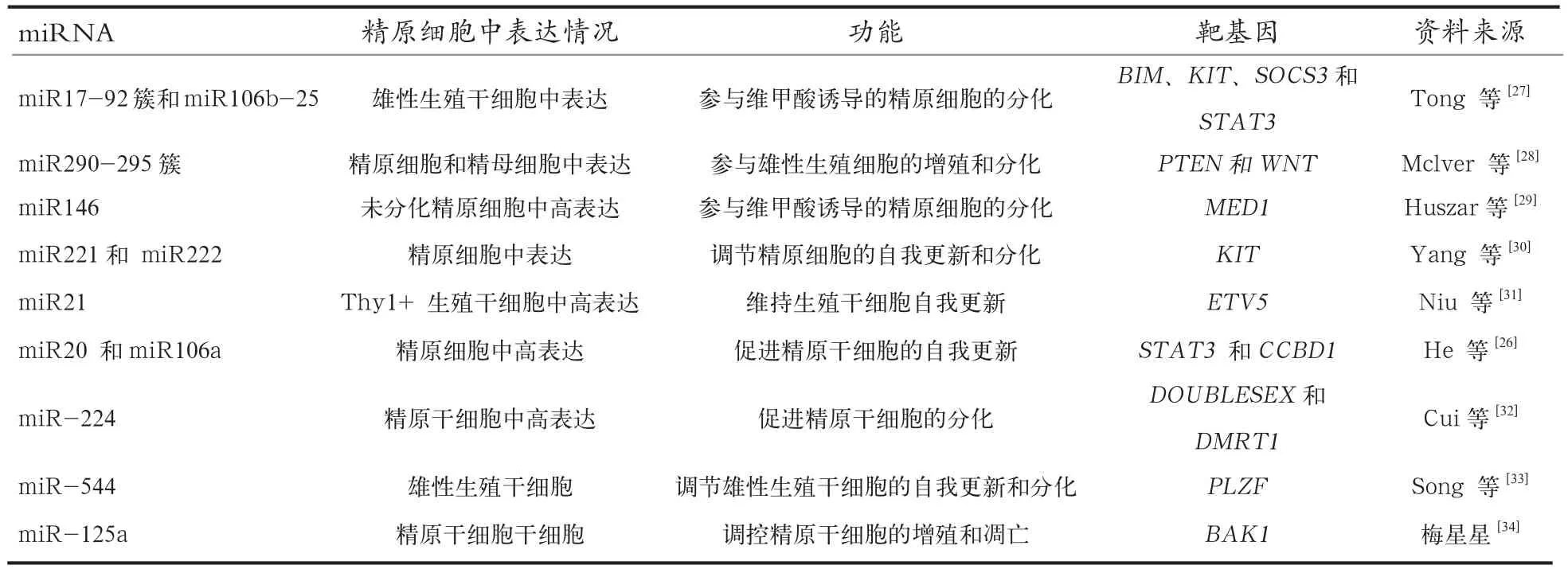
表2 调控精原干细胞增殖和分化的miRNA

表3 影响减数分裂和精子发生的miRNA
由此可见,miRNA是睾丸发育和精子发生不可或缺的调控因子,通过靶向抑制关键基因表达来调控精原干细胞分化、精母细胞减数分裂、精细胞变形及精子成熟。在睾丸发育和精子发生过程中,每一个环节都不仅仅只有一种、一簇或一个家族的miRNA参与,某些功能相关miRNA还具有补偿效应。miRNA表达异常与合成变异均可导致精子发生低下、受阻及雄性不育。因此,探索睾丸发育和精子发生中的特异miRNA及其调控功能,对于进一步找到精子发生调控靶点,治疗雄性不育具有重要意义。
4 小 结
正常睾丸发育和精子发生是提高动物精液产量和获得高品质精液的基础和前提,是雄性动物生殖健康和正常生育能力的保障。miRNA通过转录后降解靶基因mRNA或抑制靶基因翻译,对睾丸发育和精子发生中有丝分裂、减数分裂以及精子变形阶段都具有重要调控作用。虽然部分miRNA 调控功能已经得到确定,但还有许多miRNA功能尚不清楚,且miRNA在雄性生殖系统中的作用机制尚不十分明确,进一步筛选出睾丸发育和精子发生的调控miRNA,并揭示其调控机制,不仅能为提高公畜精液品质提供新途径,还能为男性不育提供新的诊疗方法。因此,在未来的研究中,应着眼于睾丸发育和精子发生阶段特异性表达 miRNA,重点开展miRNA表达分析和功能验证等研究,进一步探索出miRNA与睾丸发育和精子发生的相关性,找出睾丸发育和精子发生的调控靶点。
[1] Lee R C, Feinbaum R L, Ambros V. The C. elegansheterochronic gene lin-4, encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 89(6):1828-1835.
[2] Reinhart B J, Slack F J, Basson M, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditiselegans[J]. Nature, 2000, 403(6772):901-906.
[3] Lian C, Sun B, Niu S, et al. A comparative profile of the microRNA transcriptome in immature and mature porcine testes using Solexa deep sequencing[J]. Febs J, 2012, 279(6):964-975.
[4] Yue S B, Trujillo R D, Tang Y, et al. Loop nucleotides control primary and mature miRNA function in target recognition and repression[J]. RNA Biol, 2011, 8(6):1115-1123.
[5] O'Hara A J, Vahrson W, Dittmer D P. Gene alteration and precursor and mature microRNA transcription changes contribute to the miRNA signature of primary effusion lymphoma[J]. Blood, 2008, 111(4):2347-2353.
[6] Havens M A, Reich A A, Duelli D M, et al. Biogenesis of mammalian microRNAs by a non-canonical processing pathway[J]. Nucleic Acids Res, 2012, 40(10):4626-4640.
[7] Curtin S J, Michno J M, Campbell B W, et al. microRNA maturation and microRNA target gene expression regulation are severely disrupted in soybean dicer-like1 double mutants[J]. G3 (Bethesda), 2016, 6(2): 423-433.
[8] Piao X H, Zhang X, Wu L G, et al. CCR4-NOTDeadenylates mRNA Associated with RNA-Induced Silencing Complexes inHuman Cells[J]. Mol Cell Biol, 2010, 30(6): 1486-1494.
[9] Babiarz J E, Ruby J G, Wang Y, et al. Mouse ES cells express endogenous shRNAs, siRNAs, and other Microprocessor-independent, Dicer-dependent small RNAs[J]. Genes Dev, 2008, 22(20):2773-2785.
[10] O'Toole A S, Miller S, Haines N, et al. Comprehensive thermodynamic analysis of 3′ double-nucleotide overhangs neighboring Watson-Crick terminal base pairs[J]. Nucleic Acids Res, 2006, 34(11): 3338-3344.
[11] Zhang J, Liu Q, Zhang W, et al. Comparative profiling of genes and miRNAs expressed in the newborn, young adult, and aged human epididymides[J]. Acta Biochim Biophys Sin (Shanghai), 2010, 42(2):145-153.
[12] Belleannée C, Calvo É, Caballero J, et al. Epididymosomes convey different repertoires of microRNAs throughout the bovine epididymis[J]. Biol Reprod, 2013, 89(2):958-962.
[13] Yang Q, Hua J, Wang L, et al. MicroRNA and piRNA profiles in normal human testis detected by next generation sequencing [J]. PLoS One, 2013, 8(6):300-306.
[14] Ro S, Park C, Sanders K M, et al. Cloning and expressionprofiling of testis-expressed microRNAs[J]. Dev Biol, 2007, 311(2): 592-602.
[15] Wu J, Zhu H, Song W, et al. Identification of Conservative MicroRNAs in Saanen Dairy Goat Testis Through Deep Sequencing[J]. Reprod Domest Anim, 2013, 49(1):3-40.
[16] Yan N, Lu Y, Sun H, et al. A microarray for microRNA profiling in mouse testis tissues[J]. Reproduction, 2007, 134:73-79.
[17] Kasimanickam V R, Kasimanickam R K. Differential expression of microRNAs in sexually immature and mature canine testes[J]. Theriogenology, 2015, 83(3):394-398.
[18] Zhang X, Li C, Liu X, et al. Differential expression of miR-499 and its predicted target genes in testicular tissue of swine at different development stages[J]. DNA Cell Biol, 2015, 34(7): 464-469.
[19] Tariq K, Peng W, Saccone G, et al. Identification, characterization and target gene analysis of testicular microRNAs in the oriental fruit fly Bactroceradorsalis[J]. Insect Mol Biol, 2015, 25(1):32-43.
[20] Lian J, Zhang X, Tian H, et al. Altered microRNA expression in patients with non-obstructive azoospermia[J]. Reprod Biol Endocrinol, 2009, 7: 13.
[21] Moritoki Y, Hayashi Y, Mizuno K, et al. Expression profiling of microRNA in cryptorchid testes: miR-135a contributes to the maintenance of spermatogonial stem cells by regulating FoxO1[J]. J Urol, 2014, 191(4): 1174-1180.
[22] Abu-Halima M, Backes C, Leidinger P, et al. MicroRNA expression profiles in human testicular tissues of infertile men with different histopathologic patterns[J]. Fertil Steril, 2014, 101(1): 78-86.
[23] Yang Q E, Racicot K E, Kaucher A V, et al. MicroRNAs 221 and222 regulate the undifferentiated state in mammalian male germ cells[J]. Development, 2013, 140:280-290.
[24] Smorag L, Zheng Y, Nolte J, et al. MicroRNA signature in various cell types of mouse spermatogenesis: Evidence for stage-specifically expressed miRNA-221, -203 and -34b-5p mediated spermatogenesis regulation[J]. Biol Cell, 2012, 104(11):677-692.
[25] Shen G, Wu R, Liu B, et al. Upstream and downstream mechanismsfor the promotingeffects of IGF-1 on differentiation of spermatogonia to primary spermatocytes[J]. Life Sci, 2014, 101: 49-55.
[26] He Z, Jiang J, Kokkinaki M, et al. MiRNA-20 and mirna-106a regulate spermatogonial stem cell renewal at the posttranscriptional level via targeting STAT3 and Ccnd1[J]. Stem Cells, 2013, 31(10):2205-2217.
[27] Tong M H, Mitchell D A, McGowan S D, et al. Two miRNA clusters, Mir-17–92 (Mirc1) and Mir-106b-25 (Mirc3), are involved in the regulation of spermatogonial differentiation in mice[J]. Biol Reprod, 2012, 86(3):72, 1-10.
[28] McIver S C, Stanger S J, Santarelli D M, et al. A unique combination of male germ cell miRNAs coordinates gonocyte differentiation[J]. PLoS One, 2012, 7(4): e35553.
[29] Huszar J M, Payne C J.MicroRNA 146 (Mir146) modulates spermatogonial differentiation by retinoic acid in mice[J]. Biol Reprod, 2013, 88(1):15, 1-10.
[30] Yang Q E, Racicot K E, Kaucher A V, et al. MicroRNAs 221 and 222 regulate the undifferentiated state in mammalian male germ cells[J]. Development, 2013, 140(2): 280-290.
[31] Niu Z, Goodyear S M, Rao S, et al. MicroRNA-21 regulates the self-renewal of mouse spermatogonial stem cells[J]. Proc Natl Acad Sci USA, 2011, 108(31): 12740-12745.
[32] Cui N, Hao G, Zhao Z, et al. MicroRNA-224 regulates selfrenewal of mouse spermatogonial stem cells via, targeting DMRT1[J]. J Cell Mol Med, 2016, 20(8):1503-1512.
[33] Song W, Mu H, Wu J, et al. miR-544 Regulates dairy goat male germline stem cell self-renewal via targeting PLZF[J]. J Cell Biochem, 2015, 116(10):2155-2165.
[34] 梅星星, 李小勇, 吴际. 一组miRNAs在睾丸发育中的表达及miR-125a对精原干细胞发育的调节作用. 上海交通大学学报:医学版, 2015, 35(5):625-630.
[35] Liang X, Zhou D, Wei C, et al. MicroRNA-34c enhances murine male germ cell apoptosis through targeting ATF1[J]. PLoS One, 2012, 7(3): e33861.
[36] 查醒. MIR-183靶向TEX15调控精子发生[D]. 合肥: 安徽医科大学, 2016.
[37] Dai L, Tsai-Morris C H, Sato H, et al. Testis-specific miRNA-469 up-regulated in gonadotropin-regulated testicular RNA Helicase (GRTH/DDX25)-null mice silences transition protein 2 and protamine 2 messages at sites within coding region[J]. J Biol Chem, 2011, 286(52):44306-44318.
[38] Liu T, Huang Y, Liu J, et al. MicroRNA-122 influences the development of sperm abnormalities from human induced pluripotent stem cells by regulating TNP2 expression[J]. Stem Cells Dev, 2013, 22(12): 1839-1850.
[39] Bao J, Li D, Wang L, et al. MicroRNA-449 and microRNA 34b/cfunction redundantly inmurine testes by targeting E2F transcription factor-retinoblastoma protein (E2F-pRb) pathway[J]. J Biol Chem, 2012, 287(26): 21686-21698.
[40] Björk J K, Sandqvist A, Elsing A N, et al. miR-18, a member of Oncomir-1, targets heat shock transcription factor 2 in spermatogenesis[J]. Development, 2010, 137(19): 3177-3184.
[41] Rajender S, Meador C, Agarwal A. Small RNA in spermatogenesis and male infertility[J]. Front Biosci (Schol Ed), 2012, 4: 1266-1274.
[42] Wang F, Yu J, Yang G H, et al. Regulation of erythroid differentiation by miR-376a and its targets[J]. Cell Res,2011, 21(8): 1196-1209.
[43] Wu W, Qin Y, Li Z, et al. Genome wide microRNA expression profiling in idiopathic non-obstructive azoospermia: significant up-regulation of miR-141, miR-429 and miR-7-1-3p[J]. Hum Reprod, 2013, 28(7):1827-1836.
[44] Tian H, Cao Y X, Zhang X S, et al. The targeting and functions of miRNA-383 are mediated by FMRP during spermatogenesis[J]. Cell Death Dis, 2013, 4: e617.
[45] Modzelewski A J, Hilz S, Crate E A, et al. Dgcr8 and Dicer are essential for sex chromosome integrity during meiosis in males[J]. J Cell Sci, 2015, 128(12): 2314-2327.
[46] Modzelewski A J, Holmes R J, Hilz S, et al. AGO4 regulates entry into meiosis and influences silencing of sex chromosomes in the male mouse germline[J]. Dev Cell, 2012, 23(2):251-264.
Research Progress on miRNAs in Testis Development and Spermatogenesis
BAI Man, SUN Li-min, XIANG Lu-jie, JIA Chao, LI Jia-rong, JIANG Huai-zhi*
(College of Animal Science and Technology, Jilin Agricultural University, Jilin Changchun 130118, China)
miRNAs are a class of non-coding small RNA, which are widely existed in eukaryotes and involved in regulating different biological processes. miRNAs can degrade the target gene or inhibit the gene translation by targeting 3’UTR of mRNAs at the post transcriptional level to regulate the expression of gene. The cell specific regulation of miRNAs in spermatogenesis is important to regulate male reproduction. This article reviewed the biosynthesis, mechanism and especially the expressions of miRNAs in testis development and spermatogenesis, which provides a reference for further research on the role and molecular regulation mechanism of miRNAs in male reproduction.
miRNAs; Biosynthesis; Expression regulation; Testis development; Spermatogenesis
R321.1
A
10.19556/j.0258-7033.2017-06-004
2016-11-15;
2017-03-10
吉林省科技发展计划项目(20160204018NY)
白曼(1990-),女,辽宁营口人,博士研究生,研究方向为绵山羊遗传育种与繁殖,E-mail:1070598730@qq.com * 通讯作者:姜怀志,E-mail:jianghz6806@126.com
