HIV阴性免疫力低下患者痰液中耶氏肺孢子的实时荧光定量PCR检测
2017-06-09姚云清
佘 轩, 姚云清, 赵 川
(1. 四川省遂宁市中心医院 感染科, 四川 遂宁, 629000; 2. 重庆医科大学附属第一医院, 重庆, 400016)
HIV阴性免疫力低下患者痰液中耶氏肺孢子的实时荧光定量PCR检测
佘 轩1, 姚云清2, 赵 川1
(1. 四川省遂宁市中心医院 感染科, 四川 遂宁, 629000; 2. 重庆医科大学附属第一医院, 重庆, 400016)
目的 探讨实时荧光定量PCR对HIV阴性免疫力低下合并肺孢子肺炎(PCP)患者的诊断价值。方法 选取71例临床存在肺部感染并不能排除PCP的HIV阴性免疫力低下患者的痰液标本,分别运用ITS-巢式PCR法和ITS-实时荧光定量PCR法检测标本中耶氏肺孢子。结果 71例患者中, 18名临床诊断为PCP。巢式PCR检测阳性结果25例,假阳性率为36.00%, 灵敏度、特异度、阳性预测值分别为88.89%、83.01%和64.00%。若阈值为103copies/mL, 实时荧光定量PCR的特异度和阳性预测值均显著高于巢式PCR。PCP患者中,实时定量PCR检测出耶氏肺孢子的基因载量显著高于非PCP患者。结论 在HIV阴性免疫力低下患者中, RT-PCR较巢式PCR能更准确、快速地诊断PCP, 并可区分耶氏肺孢子定植与感染。
实时荧光定量PCR; 诊断; 肺孢子肺炎; HIV阴性免疫力低下
耶氏肺孢子(PJ), 又名卡氏肺孢子(PC), 是一种真菌,常常感染艾滋病(AIDS)患者及其他免疫力低下患者,引起肺孢子肺炎(PCP)。PCP患者若不经积极的诊断与治疗,死亡率高达100%。对于人类免疫缺陷病毒(HIV), 其阳性和阴性的PCP患者的临床表现差异很大,其中HIV阴性的患者往往发病更急、病情更重,病死率更高[1]。HIV阴性患者体内的P.jiroveci病原体载量比HIV阳性者更低,这大大降低了HIV阴性患者的病原体检出率。PCP的早期诊断较为困难,主要通过染色法检测患者呼吸道样本,以检出PJ的包囊或滋养体为确诊依据[2]。聚合酶链反应(PCR)是一种用于扩增特定DNA片段的分子生物学技术,该技术可以通过检测患者肺泡灌洗液中PJ的DNA用于确诊PCP, 成功率较高[3]。实时荧光定量PCR是近年来发展起来的核酸定量技术,具有敏感性高、准确性高、污染少的优势,可大大降低PJ检出的假阳性率,提高检测的特异性[4]。然而,大多数研究均使用支气管肺泡灌洗液(BALF)为标本,多数PCP患者的病情危重,往往不能耐受支气管肺泡灌洗这类侵袭性操作。本实验比较了RT-PCR和普通PCR检测HIV阴性免疫力低下患者痰液中的PJ载量,现报告如下。
1 资料与方法
1.1 标本来源
收集2012年6月—2013年1月重庆医科大学附属第一医院收治的71例HIV阴性免疫力低下患者的痰液标本,其中包含23例结缔组织疾病患者, 21例肿瘤放化疗患者, 15例血液系统疾病患者, 7例肝移植患者以及5例肾移植患者。所有患者HIV抗体均为阴性。纳入标准: ① CT片等影像学检查可见磨玻璃样改变和(或)肺间质弥漫浸润病变等典型表现; ② 抗PJ类抗生素药物治疗有效,但对其他抗生素治疗无反应和(或)显微镜下检测出PJ; ③ 合并非刺激性咳嗽、呼吸急促、进行性缺氧等典型体征; ④ 患者签署知情同意书。排除无法配合研究者。
1.2 试剂
Taq酶、dNTP、SYBR Premix Ex Taq(Tli RNaseH Plus)购自大连宝生物工程有限公司; DNA提取试剂盒购自上海生物工程有限公司; PMD18-T、DH5a等引物购自上海英潍捷基贸易有限公司; 分子量标准100 bp LadderⅡ、QIAGEN QIAprep Miniprep试剂盒购自重庆鼎国生物有限公司。
1.3 方法
1.3.1 标本处理及DNA提取[5-7]: 收集患者清晨第一口痰液,约3 mL, 先加入3 mL的无水乙醇于4 ℃冷藏30 min, 然后在14 000 r/min条件下离心7 min, 取沉淀,并加入2 mL 0.1%DTT溶液, 37 ℃水浴30 min后14 000 r/min离心5 min, 弃上清,沉淀用PBS-EDTA洗涤2次后,弃上清, -80 ℃保存。参照说明书,采用DNA提取试剂盒从处理后的痰液标本中提取DNA, -20 ℃保存备用。
1.3.2 ITS-巢式PCR法:以提取的基因组DNA为模版,进行ITS-巢式PCR扩增。参照文献[8], 设计扩增PJ ITS1-5.8S rRNA-ITS2基因的外引物为1724F: 5′-AAGTTGATCAAATTTGGTC-3′, ITS2R: 5′-CTCGGACGAGGATCCTCGCC-3′; 内引物为ITS1F: 5′-CGTAGGTGAACCTGCGGAAGGATC-3′, ITS2R1: 5′-GTTCAGCGGGTGATCCTGCCTG-3′。
采用20 μL反应体系,第一步反应体系包括: 10×PCR Buffer 2 μL, dNTP Mixture 1 μL, MgCl21.5 μL, 20 μmol/L 引物各2 μL, 5.0 U Taq 酶0.5 μL, 模版DNA 3 μL, 灭菌蒸馏水 8 μL。第二步反应体系模版DNA为第一步PCR反应产物2 μL, 灭菌蒸馏水9 μL, 其余成分同第一步反应体系。第一步反应条件: 94 ℃预变性5 min, 94 ℃变性1 min, 47 ℃退火1 min, 72 ℃延伸1.5 min, 30个循环后72 ℃延伸8 min。第二步反应条件: 94 ℃预变性5 min, 94 ℃变性1 min, 62 ℃退火1 min, 72 ℃延伸1 min, 30个循环后72℃延伸8 min。取5 μL第二步PCR扩增产物于1×TBE电泳缓冲液中进行琼脂糖凝胶电泳,用紫外线凝胶成像系统分析仪观察结果。
1.3.3 标准品制备及标准曲线建立:以ITS基因测序证实含有PJ的DNA为模版,参照1.6引物、反应体系和扩增条件扩增PJ ITS基因,将扩增的目的片段(约500 bp)做TA克隆,载体为PMD18-T, 然后转化入感受态细胞DH5a, 参照QIAGEN QIAprep Miniprep说明书将标准样品基因片段与载体重组质粒小量制备及测序验证,制备标准品。
将构建好的标准品质粒测OD值为1.97, 浓度为16.9 ng/μL, 质粒拷贝数为5.41×109copies/μL。取1 μL重组质粒,稀释100倍后作为标准品。用已知起始拷贝数的标准样品做出标准曲线,其中以起始拷贝数的对数为横坐标,以Ct值为纵坐标, 10倍梯度稀释5.41×(10~107)制作标准曲线,回归系数R2=0.999, 具有良好的线性关系,斜率(slope)为-3.332, 换算成扩增效率E=10-1/slope-1=0.995, 符合0.8~1.2的有效范围。根据标准曲线由每个样本扩增的Ct值计算样本的起始拷贝数。
1.3.4 RT-PCR: 参照文献[9], PJ ITS-RT-PCR的上游引物为5′-CAGAAAAAA GGGGATTGGGC-3′, 下游引物为5′-TCCCAGCGAATTTTTACG ACAC-3′。选择SYBR Premix Ex Taq 12.5 μL的反应体系, DNA模版2 μL, 上游引物0.5 μL, 下游引物0.5 μL, 灭菌蒸馏水 9.5 μL, 共25 μL。反应条件: 95 ℃ 2 min(1个循环), 95 ℃ 10 s、60 ℃ 30 s、70 ℃ 30 s(40个循环),溶解温度 70~95 ℃。扩增结束后进行溶解曲线分析。每次扩增均设阴性对照(灭菌蒸馏水为模版),监测污染和引物二聚体; 设立梯度稀释的标准样品管,用于绘制标准曲线。每份模版采取3管平行检测。
1.4 判断标准和结果评价
本试验设定大于103copies/mL为阳性,小于103copies/mL为阴性。以临床PCP诊断结果为标准计算巢式PCR和RT-PCR的灵敏度、特异度、阳性预测值、阴性预测值及假阳性率。
1.5 统计学分析
采用SPSS 13.0软件进行统计学分析,计数资料用率表示,采用卡方检验,计量资料以均值±标准差表示,采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病例临床特征和PCP诊断
71例研究对象中,按上述临床诊断标准, 18例诊断为PCP, 包含5例肿瘤放化疗患者、4例血液系统疾病患者、4例结缔组织疾病和5例肝肾脏疾病患者。在确诊的18例患者中, 14例曾经大剂量使用过免疫抑制剂如皮质类激素等, 4例未使用免疫抑制剂的患者中, 1例是肺癌患者经放射治疗过后患病,另3例患者为血液系统疾病患者。巢式PCR结果显示16例患者检测出PJ, 2例结果为阴性。而标本镜下检测出PJ的只有2例,阳性检出率为11.1%, 显著低于巢式PCR 88.9%的阳性检出率(P<0.05)。
2.2 RT-PCR测定的起始拷贝数
根据标准曲线计算样本的起始拷贝数[10], 结果显示, 16例标本的PJ DNA呈阳性,阳性标本PJ DNA定量在1.02×103~1.59×107copies/mL。同时, RT-PCR检出PJ DNA的载量在PCP患者中为8.65×101~1.59×107copies/mL, 显著高于非PCP患者的0~1.02×103copies/mL(P<0.05)。
2.3 巢式PCR和RT-PCR比较
71例痰液标本经临床诊断确诊,阳性患者18例,阴性患者53例。巢式PCR结果显示16例真阳性, 9例假阳性, 44例真阴性, 2例假阴性,其灵敏度、特异度、阳性预测值和阴性预测值分别是88.89%、83.01%、64.00%和95.65%。RT-PCR结果显示, 15例真阳性, 1例假阳性, 52例真阴性, 3例假阴性,其灵敏度、特异度、阳性预测值和阴性预测值分别是83.33%、98.11%、93.75%和94.55%。与巢式PCR相比, RT-PCR的假阳性患者更少,真阴性患者更多,两种方法有相近的灵敏度,但RT-PCR的特异度和阳性预测值显著高于巢式PCR(P<0.05)。见表1。
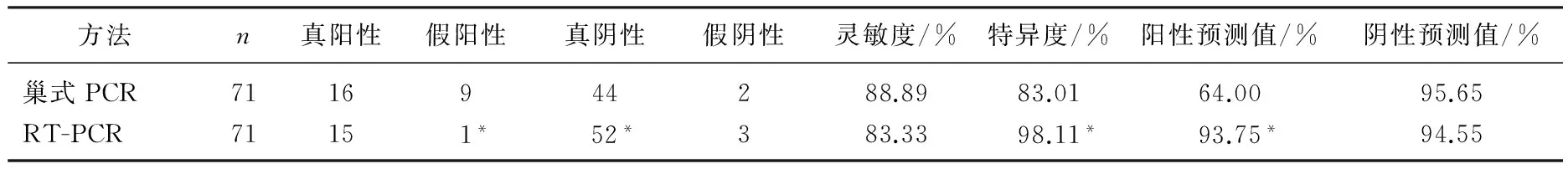
表1 两种方法的检测结果比较
与巢式PCR比较, *P<0.05。
3 讨 论
临床上痰液用于诊断PCP具有一定的诊断价值,尤其对于艾滋病患者,但其检测PCP的灵敏度较低[11]。对于部分非艾滋病的PCP患者,尤其是PJ载量低于HIV阳性的PCP患者,痰液镜检的灵敏度更低。大量研究[12-14]证明,巢式PCR检测痰液或BALF时,其诊断PCP的灵敏度比传统镜检法更高,但是对于无症状的PJ定植者或亚临床感染者中,巢式PCR检查的假阳性率较高。本研究中,巢式PCR的阳性预测值仅为64.00%, Weig M的研究结果也印证了这一点。
近年来,国外已有大量研究将RT-PCR检测PJ用于诊断PCP, 但国内却鲜有相关报道。已有研究[15-17]发现,使用患者BALF标本时, RT-PCR对PJ无症状携带者和PCP患者的区分度良好。然而, HIV阴性的PCP患者呼吸道标本中的PJ载量显著低于HIV阳性者,因此RT-PCR用于诊断PCP的阈值应针对HIV阳性和阴性患者有所不同。不同标本的PJ DNA载量不一,因此痰液和BALF的阈值也应有所差异。本研究旨在寻找出一个适用于痰液标本的RT-PCR阈值,用于HIV阴性免疫力低下患者PCP的诊断。
对于PJ而言, ITS基因的拷贝数可反映病原体载量,因此本实验选择ITS基因作为靶基因。结果显示,当阈值为103copies/mL时, RT-PCR与巢式PCR有相似的高灵敏度,但特异度和阳性预测值远远高于巢式PCR, 表明RT-PCR可大大降低假阳性检测率[18-19]。同时,检测结果表明,临床非PCP患者的PJ DNA载量明显偏低。因此,将PJ DNA载量低于103copies/mL作为确定PJ定植的标准,治疗时无需应用抗肺孢子药物,而将PJ DNA载量高于103copies/mL确定为PJ感染的标准,应积极治疗,降低病死率。
综上所述,对于HIV阴性免疫力低下的患者,使用痰液为标本时, RT-PCR有助于准确而快速地诊断PCP, 并且可以区分PJ定植与感染,较直接镜检及巢式PCR更有参考价值。
[1] Thomas C F, Limper A H. Pneumocystis pneumonia: clinical presentation and diagnosis in patients with and without acquired immune deficiency syndrome[J]. Semin Respir Infect, 1998, 13: 289-95.
[2] Oliveira A, Unnasch T, Crothers K, et al. Performance of a molecular viability assay for the diagnosis of Pneumocystis pneumonia in HIV-infected patients[J]. Diagn Microb Infect Dis, 2007, 57: 169-176.
[3] Fujisawa T, Suda T, Matsuda H, et al. RT-PCR is more specific than conventional PCR for induced sputum diagnosis of Pneumocystis pneumonia in immunecompromised patients without HIV infection[J]. Respirology, 2009, 14: 203-209.
[4] Chumpitazi B F, Flori P, Kern J B, et al. Characteristics and clinical relevance of the quantitative touch-down major surface glycoproteinpolymerase chain reaction in the diagnosis of Pneumocystis pneumonia[J]. Med Mycol, 2011, 49(7): 704-13.
[5] Flori P, Bellete B, Durand F, et al. Comparison between RT-PCR, conventional PCR and different staining techniques for diagnosing Pneumocystis jiroveci pneumonia from bronchoalveolar lavage specimens[J]. J Med Microbiol, 2004, 53: 603-7.
[6] Gupta R, Mirdha B R, Guleria R, et al. Use of different primer directed sequence amplification by polymerase chain reaction for identification of Pneumocystis jirovecii in clinical samples[J]. Indian J Chest Dis Allied Sci, 2008, 50(4): 321-7.
[7] Jiancheng W, Minjun H, Yi-jun A, et al. Screening Pneumocysti carinii pneumonia in non-HIV-infected immunocompromised patients using polymerase chain reaction[J]. Diagn Microbiol Infect Dis, 2009, 64(4): 396-401.
[8] Lu JJ, Bartlett M S, Shaw M M, et al. Typing of Pneumocystis carinii strains that infect humans based on nucleotide sequence variations of internal transcribed spacers of rRNA genes[J]. J Clin Microbiol, 1994, 32: 2904-2912.
[9] Fujisawa T, Suda T, Matsuda H, et al. RT-PCR is more specific than conventional PCR for induced sputum diagnosis of Pneumocystis pneumonia in immunocompromised patients without HIV infection[J]. Respirology, 2009, 14: 203-209.
[10] Takahashi T, Goto M, Endo T, et al. Pneumocystis carinii carriage in immunocompromised patients with and without human immunodeficiency virus infection[J]. J Med Microbiol, 2002, 51: 611-14.
[11] Huggett J F, Taylor M S, Kocjan G, et al. Development and evaluation of a RT-PCR assay for detection of pneumocystis jirovecii DNA in bronchoalveolar lavage fluid of HIV-infected patients[J]. Thorax, 2008, 63: 154-159.
[12] Larsen H H, Masur H, Kovacs J A, et al. Development and evaluation of a quantitative, touch-down, RT-PCR assay for diagnosing Pneumocystis carinii pneumonia[J]. J Clin Microbiol, 2002, 40: 490-4.
[13] Alli O A, Ogbolu D O, Ademola O, et al. Molecular detection of pneumocystis jirovecii in patients with respiratory tract infections[J]. N Am J Med Sci, 2012, 4(10): 479-85.
[14] Saito K, Nakayamada S, Nakano K, et al. Detection of Pneumocystis carinii by DNA amplification in patients with connective tissue diseases: re-evaluation of clinical features of P. carinii pneumonia in rheumatic diseases[J]. Rheuma-tology (Oxford), 2004, 43: 479-85.
[15] Mühlethaler K, Bögli-Stuber K, Wasmer S, et al. Quantitative PCR to diagnose Pneumocystis pneumonia in immunocompromised non-HIV patients[J]. Eur Respir J, 2012, 39: 971-978.
[16] 刘雅琼, 林辉, 于磊, 等. 类获得性免疫缺陷(阴性HIV)“患者”的流行病学调查[J]. 第三军医大学学报, 2013, 35(5): 369-375.
[17] 裴迎新, 李兴旺, 张智清, 等. 59例经网络征集的“自疑HIV感染者”流行病学特征与临床表现的分析[J]. 中华流行病学杂志, 2010(12): 1379-1382.
[18] 吴丹, 苑红, 张玉敏, 等. 艾滋病患者抗病毒治疗对HIV的抑制效果及临床护理措施[J]. 实用临床医药杂志, 2015, 19(16): 27-29.
[19] 刘冬梅, 庞俊, 韦淑珍, 等. 不同孕期HIV/AIDS孕妇接受抗病毒治疗的效果评估[J]. 中华全科医学, 2013, 11(7): 1061-1062.
RT-PCR detection for pneumocystis jirovecii in phlegm of patients with HIV-negative hypoimmunity
SHE Xuan1, YAO Yunqing2, ZHAO Chuan1
(1.DepartmentofInfection,SuiningCentralHospital,Suining,Sichuan, 629000;2.TheFirstHospitalAffiliatedtoChongqingMedicalUniversity,Chongqing, 400016)
Objective To explore the value of RT-PCR in diagnosis of patients with HIV-negative hypoimmunity and pneumocystis pneumonia (PCP). Methods Totally 71 phlegm samples of pulmonary infection patients with suspected PCP and HIV-negative hypoimmunity were selected. ITS-nested PCR and ITS-real-time fluorescence quantitative PCR were used to detect pneumocystis jiroveci in samples. Results Among the 71 patients, 18 cases were diagnosed as PCP. There were 25 cases with positive results by n-PCR, but the false-positive rate was 36.00%, and sensitivity, specificity and positive predictive values of n-PCR were 88.89%, 83.01% and 64.00%, respectively. If the threshold was 103copies/mL, the specificity and positive predictive value of RT-PCR were significantly higher than n-PCR. In patients with PCP, the the gene load of pneumocystis by RT-PCR was significantly higher than non-PCP patients. Conclusion In patients with HIV-negative hypoimmunity, RT-PCR is more accurate and rapid than nested PCR in the diagnosis of PCP, and it can distinguish the infection and colonization of pneumocystis.
RT-PCR; diagnosis; pneumocystis pneumonia; HIV-negative hypoimmunity
2017-01-11
R 593.3
A
1672-2353(2017)09-069-04
10.7619/jcmp.201709018
