光照对大豆叶片衰老相关基因差异表达的影响
2017-06-07张红梅董俊彤刘斌兰小茜李宏宇
张红梅,董俊彤,刘斌,兰小茜,李宏宇
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.中国农业科学院作物科学研究所)
光照对大豆叶片衰老相关基因差异表达的影响
张红梅1,董俊彤1,刘斌2,兰小茜1,李宏宇2
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.中国农业科学院作物科学研究所)
利用实时荧光定量PCR技术分析不同光照条件下大豆垦农18(KN18)叶片衰老相关基因(GmWRKY53b、GmCIB1、GmPAO1、GmSAG12)及蓝光受体隐花色素基因(GmCRY2a)的表达情况。结果表明:GmWRKY53b、GmCRY2a在长光照(LD)条件下比在短光照(SD)条件下的表达量高;GmCIB1在长光照条件下比在短光照条件下的表达量低;长光照条件下GmSAG12的基因的表达量先高于短光照条件下的表达量,光照16 h时GmSAG12在长光照条件下的表达量低于短光照条件下的表达量;而GmPAO1基因在不同光周期处理表达量没有明显差异。
光周期;基因差异表达;大豆
叶片衰老作为植物一个重要的生命特征,是程序性细胞死亡(PCD)的一种,并受诸多环境因素影响,有研究显示光也参与到此调控中[1]。鉴于衰老在植物生长发育过程中的重要性,国内外已经相继开展了广泛研究。拟南芥叶片衰老机制已得到深入全面的研究,结果显示是一系列转录调控子相互作用而程序性调控的结果,如叶片衰老相关基因WRKY53的活性及表达受植物激素和环境的共同调控[2-3]。而光作为植物生长的主要环境因子,其如何调控叶片衰老目前尚未清楚。有研究报道,光、庇荫以及黑暗均能促进拟南芥的叶片衰老,这暗示了光调控的叶片衰老是一个复杂的过程[4-7]。尽管如此,由于叶片衰老调控受诸多环境因素诱导及生长发育时期复杂的内外因素相互作用,目前对其作用机理的认识仍非常有限。光照与叶片衰老有密切关系,然而光环境如何影响叶片衰老还不清楚。目前对大豆叶片衰老分子机制的了解更是知之甚少。
大豆是全球范围内的一种重要经济作物。我国大豆种植常受外界环境因子如日照、高温、干旱等逆境因子的影响而发生早衰,最终导致减产。早期已有实验证明,减缓种子发育过程中植株的衰老可以有效地提高大豆的品质和产量[8-9]。研究选取光诱导叶片衰老相关基因利用实时荧光定量PCR方法分析不同光周期影响下GmWRKY53b、GmCIB1、GmSAG12、GmPAO1和GmCRY2a基因在大豆KN18中的转录水平表达变化,拟探索光周期对调控大豆叶片衰老影响的分子机制。大豆衰老调控机制的揭示,有助于防止大豆早衰,有效保证大豆的产量,具有重大的实用价值和经济效益,并为改良大豆叶片衰老相关性状提供理论依据。
1 材料与方法
1.1 材料
供试大豆品种:垦农18,由中国农业科学院作物科学研究所刘斌实验室提供和保存。
RNA提取试剂TRNzol购于Invitrogen公司,反转录试剂盒TransScriptROne-Step gDNA Removal and cDNA Synthesis SuperMix kit购于Transgen公司,SYBR Premix Ex Taq(Tli RNaseH Plus)购于TaKaRa公司。三氯甲烷、异丙醇、乙醇等均购于国内生化试剂公司。
小型台式高速冷冻离心机、Roche480实时荧光定量基因扩增仪、ND2000 NanoDrop分光光度计、HR350 HiPoint光谱仪、电泳仪等。
1.2 试验方法
1.2.1 植株培养条件
选取饱满、大小一致的大豆种子,种植于温室,培养条件为:长光照(16 h光照/8 h黑暗)或短光照(8 h光照/16 h黑暗),光照强度为250(μmol·m-2)·s-1,培养温度为25℃。
大豆垦农18(KN18)种植于长光照LD(16 h光照/8 h黑暗)和短光照SD(short day)(8 h光照/16 h黑暗)条件下,当子叶刚展开时每间隔4 h取样,各取7个时间点(24 h),样品用液氮冷冻后贮存于-80℃备用。
1.2.2 RNA实验
利用于Invitrogen公司TRIzol试剂盒提取大豆叶片的总RNA,利用反转录试剂盒合成cDNA第一链,用于实时荧光定量PCR的模板。
1.2.3 引物设计
根据基因的CDS序列,Real-time引物利用Primer Premier 5软件进行设计。引物合成由华大基因完成,PAGE纯化。

表1 引物设计表Table 1Primer design
1.2.4 实时荧光定量PCR(qRT-PCR)
实时荧光定量PCR采用Light Cycler 480 SYBR Green I Master system进行,利用SYBR Premix Ex Taq(Tli RNaseH Plus)检测荧光信号。以稀释100倍的cDNA为模板,大豆TIP41基因作为对照进行数据的标准化,根据2-ΔΔCT[7]计算基因相对表达变化倍数。为确保Ct值一致性,包括对照基因在内的每个样品均设置3次重复。在15 μL的反应体系中,2× SYBR Permix Ex Taq 7.5 μL,上、下游引物各0.3 μL,模板cDNA 5 μL,ddH2O 1.7 μL。PCR扩增条件为:95℃预变性30 sec,95℃变性5 sec,60℃20 sec,40 cycles。溶解曲线:95℃10 sec,65℃1 min,95℃15 sec。
2 结果与分析
2.1 光周期对大豆GmWRKY53b表达影响
GmWRKY53b在不同光周期条件下的表达情况分析显示(图1)。长光照LD条件下的GmWRKY53b表达量均明显高于短光照SD条件下的表达量,LD条件下和SD条件下GmWRKY53b表达量0至4 h都呈上升趋势,4 h后呈表达量下降;培养8 h后,LD条件下GmWRKY53b表达量呈上升趋势,16 h达最大表达量;而SD条件下GmWRKY53b表达量呈下降趋势,LD条件下GmWRKY53b表达量明显高于SD条件下表达量,经T检验分析P<0.05差异显著,与我们前期表型试验结果LD条件下促进KN18叶片衰老相符。结果表明,GmWRKY53b可能与长光照下的叶片衰老呈正相关。

图1 光周期对大豆GmWRKY53b表达影响Fig.1Effect of Light on GmWRKY53b expression
2.2 光周期对大豆GmCRY2a表达影响
KN18大豆品种中GmCRY2a的表达量在LD条件下均高于SD条件(图2)。LD条件下,GmCRY2a表达量0至4 h呈上升趋势,GmCRY2a表达量达最高;培养4 h后,GmCRY2a表达量呈下降趋势,至8 h表达量最低,8 h后GmCRY2a表达量出现上升趋势;SD条件下0至4 h GmCRY2a表达量呈缓慢上升,4 h呈下降至12 h达表达量最低,后又上升趋势。LD条件下GmCRY2a表达量明显高于SD条件下表达量,经T检验分析P<0.05差异显著。结果表明,GmCRY2a可能与长光照下的叶片衰老呈正相关。
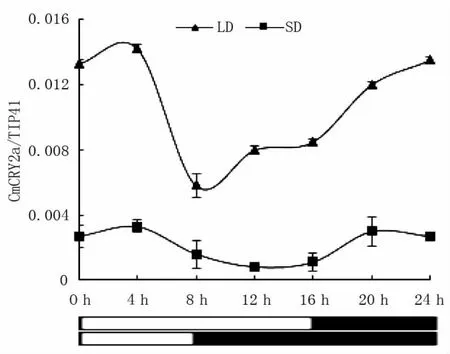
图2 光周期对大豆GmCRY2a表达影响Fig.2Effect of light on GMCRY2a expression
2.3 光周期对大豆GmCIB1表达影响
由图3可以看出,GmCIB1的表达与GmWRKY-53b、GmCRY2a基因的表达不同,在LD生长条件下的KN18中表达量明显低于SD条件下的表达量。LD条件下,GmCIB1表达量呈下降趋势至16 h。SD条件下0至8 h GmCIB1呈上升趋势,8 h达最大表达量,8 h后呈下降趋势至16 h。16 h后,LD条件下和SD条件下GmCIB1的表达量变化趋势一致,但与LD条件相比,SD条件下的GmCIB1的表达量高于LD条件的表达量。研究表明,GmCIB1可能与长光照下的叶片衰老负相关调控。

图3 光周期对大豆GmCIB1表达影响Fig.3Effect of light on GMCIB1 expression
2.4 光周期对大豆GmPAO1表达影响
由图4可以看出,GmPAO1在KN18中LD条件下的表达量与SD条件下的表达量无明显差异。在后期,LD条件下GmPAO1的表达量明显高于SD条件的表达量。
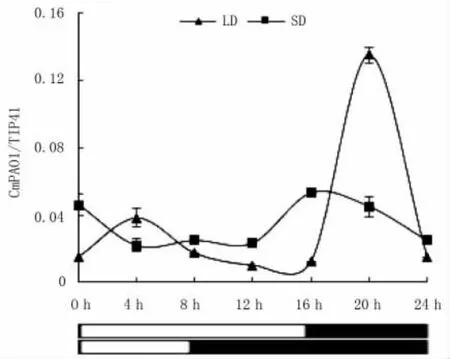
图4 光周期对大豆GmPAO1表达影响Fig.4Effect of light on GmPAO1 expression
2.5 光周期对大豆GmSAG12表达影响
不同光周期条件下GmSAG12表达情况显示(图5),LD生长条件下KN18中GmSAG12的表达变化表现为LD条件下的该基因的表达量先高于SD条件下的表达量,光照16 h时GmSAG12在LD条件下的表达量低于SD条件下的表达量。研究结果表明GmSAG12有可能是光周期调控的叶片衰老基因。

图5 光周期对大豆GmSAG12表达影响Fig.5Effect of light on GmSAG12 expression
3 讨论
衰老作为叶片发育的最终阶段,是程序性细胞死亡(PCD)的一种,并受诸多环境因素诱导,以及生长发育时期复杂的内外因素相互作用的影响[9]。与其他PCD不同的是,叶片衰老是一个有许多生理变化和分子事件组成的连续的过程。植物中大量的基因表达为节律模式。比如,拟南芥中90%的基因已经被证实在昼夜循环条件下动态表达[10]。
在WRKY家族中,WRKY53与叶片衰老相关的功能被深入研究,且在叶片衰老过程中表达量升高[11-12]。 WRKY53是一个主要的衰老正调节子,通过表达WRKY53的转基因植株表现出早衰表型,WRKY53敲除突变体的衰老明显被延缓[3]。研究表明,WRKY53在叶片衰老早期起调控作用,其表达量在叶片衰老早期上升但在后期下降,暗示了WRKY53在衰老起始阶段起到关键性作用[13]。
PAO是叶绿素降解代谢过程中的关键酶。研究表明,PAO mRNA和PAO蛋白在衰老叶片中的含量增加[14]。PAO酶的活性与叶绿素降解速率成正相关。在长光照条件下,cry2突变体表现出晚花表型;在短光照条件下,cry2突变体的开花时间不受影响,研究表明隐花色素CRY2参与了光周期控制的开花途径的调控[15]。在拟南芥中,SAG12是一个仅随叶龄的增加而表达上调的基因,其表达不受植物激素或外界环境因素影响[16],因此SAG12一直被认为是叶龄依赖的衰老标志基因。GmCIB1蛋白为bHLH转录因子家族,转基因植株表型分析显示,GmCIB1促进植物衰老[17]。
前期我们研究不同光周期对大豆叶片衰老影响的结果显示,与短光照条件相比,长光照条件下生长的KN18表现出明显的早衰表型,暗示了长光照可能促进大豆叶片衰老。为探索光周期对大豆叶片衰老相关基因的表达,我们利用实时荧光定量PCR技术分析不同光照条件下叶片衰老过程中衰老相关基因GmWRKY53b、GmCIB1、GmPAO、GmSAG12以及蓝光受体GmCRY2a在大豆叶片的表达量。结果表明,GmWRKY53b、GmCRY2a可能与长光照条件下叶片早衰正相关;GmCIB1可能与长光照条件下叶片早衰负相关,;LD生长条件下KN18中GmSAG12的表达变化表现为LD条件下的该基因的表达量先高于SD条件下的表达量,光照16 h时GmSAG12在LD条件下的表达量低于SD条件下的表达量。研究结果表明暗示了GmSAG12有可能是光周期调控的叶片衰老基因;而GmPAO基因在不同光周期处理表达量没有明显差异。研究结果为后续研究GmWRKY53b、GmCIB1、GmCRY2a、GmSAG12基因在光周期调控叶片衰老的功能奠定了基础。
[1]Quirino B F,Noh Y S,Himelblau E,et al.Molecular aspects of leaf senescence[J].Trends Plant Sci,2000(5):278-282.
[2]Lim P O,Kim H J,Nam H G.Leaf senescence[J].Plant Biol,2007,58:115-136.
[3]Wu X Y,Kuai B K,Jia J Z,et al.Regulation of leaf senescence and crop genetic improvement.J.Integr[J].Plant Biol,2012,54:936-952.
[4]Nooden L D,Hillsberg J W,Schneider M J.Induction of leaf senescence in Arabidopsis thaliana by long days through a lightdosage effect[J].Physiol Plant,1996,96:491-495.
[5]Weaver L M,Amasino R M.Senescence is induced in individually darkened Arabidopsis leaves,but inhibited in whole darkened plants[J].Plant Physiol,2001,127:876-886.
[6]Lin J F,Wu S H.Molecular events in senescing Arabidopsis leaves[J].Plant J,2004,39:612-628.
[7]Parlitz S,Kunze R,Mueller-Roeber B,et al.Regulation of photosynthesis and transcription factor expression by leaf shading and re-illumination in Arabidopsis thaliana leaves [J].Plant Physiol,2011,168:1311-1319.
[8]Nooden L D,Letham D S.Cytokinin metabolism and signaling in the soybean plan[J].Plant Physiol,1993,20:639-653.
[9]王宝生,孙福东,冯乃杰,等.S3307和DTA-6对大豆碳代谢及产量的影响[J].黑龙江八一农垦大学学报,2016,28(1):4-9.
[10]Endo M,Shimizu H,Nohales MA,et al.Tissue-specific clocks in Arabidopsis show asymmetric coupling[J].Nature,2014,515:419-422.
[11]MiaoY,LaunT,ZimmermannP,et al.Targetsofthe WRKY53 transcription factor and its role during leaf senescence in Arabidopsis[J].Plant Molecular Biology,2004,55(6):853-867.
[12]Miao Y,Zentgraf U.The antagonist function of Arabidopsis WRKY53 and ESR/ESP in leaf senescence is modulated by the jasmonic and salicylic acid equilibrium[J]. The Plant Cell,2007,19(3):819-830.
[13]Hinderhofer K,Zentgraf U.Identification of a transcription factor specifically expressed at the onset of leaf senescence[J].Planta,2001,213(3):469-473.
[14]Pruzinska A,Tanner G,Aubry S,et al.Chlorophyll breakdown in senescent Arabidopsis leaves.Characterization of chlorophyll catabolites and of chlorophyll catabolic enzymes involved in the degreening reaction[J].Plant Physiol,2005,139(1):52-63.
[15]Guo H,Yang H,Mockler TC,et al.Regulation of floweringtimebyArabidopsisphotoreceptors[J].Science,1998,279:1360-1363.
[16]Noh YS,Amasino RM.Identification of a promoter region responsible for the senescence-specific expression of SAG12[J].Plant Molecular Biology,1999,41(2):181-194.
[17]Meng Y,Li H,Liu B,et al.Blue-light-dependent interaction of CRY2 and CIB1 regulates transcription and leaf senescence in soybean(Glycine max)[J].The Plant Cell,2013,25(11):4405-4420.
Effect of Light on Soybean Leaf Senescence-associated Genes Difference Expression
Zhang Hongmei1,Dong Juntong1,Liu Bin2,Lan Xiaoxi1,Li Hongyu2
(1.College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Institute of Crop Sciences,Chinese Academy of Agricultural Sciences)
The dynamic expression profiles of the senescence-associated genes(GmWRKY53b,GmCIB1,GmPAO1,GmSAG12)and blue light receptors GmCRY2a expression profiles of Soybean(Glycine max L.)KN18 were analyzed under different light conditions by quantitative real-time PCR(qPCR).The results indicated that GmWRKY53b and GmCRY2a expression levels were higher in long day(LD)than in short day(SD),GmCIB1 expression levels was lower in LD than in SD.GmSAG12 expression levels was higher in LD than in SD,but GmSAG12 expression levels at 16 h was lower in LD than in SD,while GmPAO1 expressed in different photoperiod treatment had no significant difference.
photoperiod;genes difference expression;soybean
S565.1
A
1002-2090(2017)03-0077-05
10.3969/j.issn.1002-2090.2017.03.017
2016-06-28
黑龙江八一农垦大学博士启动基金(XDB2012-14)。
张红梅(1969-),女,副教授,吉林大学毕业,现主要从事植物生物技术方面的研究工作。
李宏宇,女,研究员,硕士研究生导师,E-mail:lihongyu@caas.net。
