牛多杀性巴氏杆菌菌影的制备
2017-06-07常春龙王士霞翟军军倪宏波
常春龙,王士霞,翟军军,倪宏波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛多杀性巴氏杆菌菌影的制备
常春龙,王士霞,翟军军,倪宏波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
试验以pHH43质粒为模板,通过PCR扩增含噬菌体PhiX174裂解基因E和CI857-PL-PR温控系统的温敏裂解盒CI857-PL-PR-E,再将该裂解盒插入到pPBA1100穿梭载体中,构建裂解质粒pPBA1100-E。利用细菌接合转化法将其转入牛多杀性巴氏杆菌中,通过溶菌动力学试验检测裂解质粒pPBA1100-E对牛多杀性巴氏杆菌的裂解效果并计算裂解效率。结果表明成功构建了裂解质粒pPBA1100-E,并将其成功地转入到牛多杀性巴氏杆菌中,溶菌动力学试验说明裂解质粒pPBA1100-E在牛多杀性巴氏杆菌中具有很高的溶菌效率,裂解效率为99.997%。因此,试验成功地制备了牛多杀性巴氏杆菌菌影,为进一步成功研制牛多杀性巴氏杆菌菌影疫苗奠定了坚实的基础。
牛多杀性巴氏杆菌;菌影;裂解效率
牛巴氏杆菌病是由牛多杀性巴氏杆菌(Pasteurella multocida,P.multocida)感染引起的一种急性、热性、败血性传染病,具有发病急、传染快、危害大的特点,是严重危害我国乃至世界养牛业的重大疾病[1]。疫苗接种是防控该病最好的方法[2],目前主要的疫苗有灭活苗和弱毒苗,由于弱毒苗在制备过程中某些蛋白的缺失导致免疫原性有所降低,所以传统的全菌体灭活疫苗存在着免疫效果不理想的问题[3];活菌苗虽然免疫原性好,免疫力产生快,生产成本低,但免疫期短、容易毒力返祖、安全性差、可引起注射部位局部坏死[4-5]。因此,研制一种安全高效的的巴氏杆菌疫苗一直是科研工作者不懈追求的目标,这对控制牛巴氏杆菌病具有极其重要意义。
细菌菌影技术是近年来兴起的一种新型疫苗技术,适用于大部分的革兰氏阴性菌,它利用噬菌体phi X174裂解基因在细胞膜上形成特异性跨膜孔道,并通过渗透压作用排出胞质内含物,从而形成的完整细菌空壳[6-7]。它完整的保留了细菌表面抗原的天然结构,可以有效诱导机体产生较强的免疫反应,同时由于不含有任何的胞质内容物和核酸,因此比弱毒疫苗和灭活疫苗更安全可靠[8-9],目前的研究已经表明,菌影既可以诱导机体产生体液免疫,又可以产生细胞免疫,因此是一种非常理想的新型细菌疫苗体系[10-12]。研究拟利用分子生物学技术,构建含有温敏裂解盒CI857-PL-PR-E的高效转化和裂解的穿梭质粒,并在此基础上制备高质量的多杀性巴氏杆菌菌影,以期为多杀性巴氏杆菌菌影疫苗的制备和工业化生产进行良好的技术储备,为牛巴氏杆菌病的防控提供新的思路。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
E.coli DH5α购自BM公司,多杀性巴氏杆菌(血清型为B∶2)、pHH43质粒(含有裂解基因和温控原件)、pPBA1100质粒均由本实验室保存。
1.1.2 主要试剂
Taq DNA聚合酶、DNA5000Marker、DNA2000 Marker均购自TaKaRa公司;BamH I、ScaⅠ限制性核酸内切酶、T4 DNA连接酶均购自thermo Scientific公司;质粒提取试剂盒和胶回收试剂盒购自AXYGEN公司。
1.2 方法
1.2.1 裂解盒的扩增
根据pHH43质粒的测序结果设计引物扩增裂解盒,即温控原件和裂解基因E。上游引物CI857-UP:CC GAGCTC TCA GCC AAA CGT CTC TTC AGG,下游引物CI857-DN:CG GGATCC TCA CTC CTT CCG CAC GTA ATT,由Invitrogen(上海)公司合成,并在上、下游引物5'端分别引入了SacⅠ和BamHⅠ限制性内切酶位点。以pHH43质粒为模板扩增裂解盒,PCR反应条件为:96℃预变性5 min;94℃热变性30 s,60℃退火30 s,72℃延伸90 s,循环30次;72℃延伸10 min,反应结束后取5.0 μL PCR产物于1%的琼脂糖凝胶上进行电泳检测。
1.2.2 穿梭质粒pPBA1100-E的构建及转化
用SacⅠ和BamHⅠ双酶切法将上述扩增的裂解盒连接到广宿主质粒pPBA1100中,并将连接产物转化DH5α感受态细胞,涂布含有卡那霉素的平板,37℃培养,挑取单菌落接种于LB培养液中增菌培养后提取重组质粒进行PCR鉴定和酶切鉴定,然后送至哈尔滨博仕生物技术有限公司进行序列测定,将测序正确重组质粒命名为pPBA1100-E。
1.2.3 重组质粒pPBA1100-E通过接合转入多杀性巴氏杆菌B∶2菌株
按照文献[13]的方法将制备的含有重组质粒pPBA1100-E的大肠埃希菌E.coli DH5α,通过接合生殖的将pPBA1100-E转入牛多杀性巴氏杆菌,通过分别对裂解盒基因和多杀性巴氏杆菌的特异性基因进行菌落PCR后,鉴定为阳性的菌落,即为多杀性巴氏杆菌接合子。
1.2.4 裂解质粒pPBA1100-E的溶菌动力学试验
将含有溶菌质粒pPBA1100-E的牛多杀性巴氏杆菌和不含有溶菌质粒的牛多杀性巴氏杆菌分别在37℃培养至OD600nm值约为0.4左右,然后将含有溶菌质粒的牛多杀性巴氏杆菌菌液分为两组,一组继续留在37℃中培养,作为对照组1,另一组将培养温度升至42℃进行诱导;将不含溶菌质粒的牛多杀性巴氏杆菌的培养温度也升至42℃,作为对照组2,每隔1 h取样检测培养物OD600nm吸光度值,观察细菌的裂解水平,直至OD600nm的吸光度值不再下降为止。
1.2.5 菌体裂解率的计算
将升温诱导之前和诱导结束后的菌液分别用无菌PBS进行适当倍数稀释,均匀涂布于含有100 μg·mL-1卡那霉素的LB固体培养基上,每板100 μL,37℃恒温箱培养24 h,分别计算诱导前细菌数和诱导后细菌数。裂解效率=(1-诱导之后CFU/诱导之前CFU)×100%。
2 结果
2.1 裂解盒CI857-PL-PR-E的PCR扩增结果
以pHH43质粒为模板扩增裂解盒,结果如图1所示,在1 429 bp处有特异性扩增条带,大小与预期结果一致。
2.2 裂解质粒pPBA1100-E的PCR和双酶切鉴定结果
裂解盒的PCR扩增结果和酶切鉴定结果如图2.2,结果说明裂解盒CI857-PL-PR-E成功插入pP BA1100载体中。

图1 裂解盒的PCR扩增结果Fig.1The result of amplification of lysis cassettes by PCR
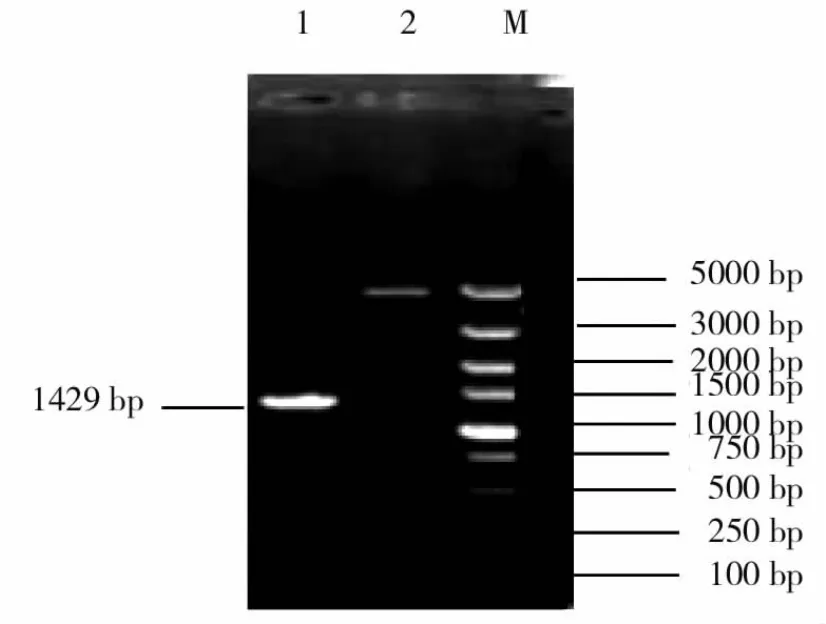
图2 裂解质粒pPBA1100-E的PCR和双酶切鉴定结果Fig.2The identify results of lysis plasmid pPBA1100-E by PCR and double digestion
2.3 接合试验鉴定结果
从接合的多杀性巴氏杆菌B∶2菌株中扩增得到约457 bp的多杀性巴氏杆菌特异性片断和约1 429 bp的裂解盒片段(图3),证明溶菌质粒pPBA1100-E成功转化入多杀性巴氏杆菌B∶2菌株中。
2.4 裂解质粒pPBA1100-E的溶菌动力学试验
溶菌动力学试验结果如图4所示,含裂解质粒pPBA1100-E的牛多杀性巴氏杆菌在42℃诱导2 h后,菌液OD600nm值达到最高,随后逐渐降低;对照组1菌液OD600nm值初期呈上升趋势,后期趋于平稳;对照组2菌液OD600nm值初期呈上升趋势,后期略有下降。

图3 接合试验鉴定结果Fig.3Bonding test identification results
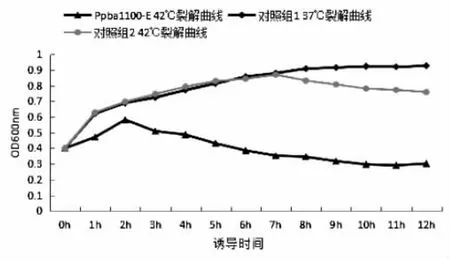
图4 含裂解质粒pPBA1100-E的牛多杀性巴氏杆菌的裂解曲线Fig.4The lysis curve of bovine P.multocida containing lysis plasmid pPBA1100-E
2.5 裂解率的计算结果
将升温诱导之前和诱导结束后的菌液分别用无菌PBS进行105和102倍稀释,均匀涂布于含有100 μg·mL-1卡那霉素的LB固体培养基上,每板100 μL,重复涂3个平板,计算cfu平均值。37℃恒温箱培养24 h,分别计算诱导前细菌数和诱导后细菌数。裂解效率=(1-6×102CFU/2.17×107CFU)×100%= 99.997%,就是菌液经高温诱导后有99.997%的细菌成功的被裂解。
3 讨论
研究构建了裂解质粒pPBA1100-E,并通过接合转化法将其转入牛多杀性巴氏杆菌中。含有裂解质粒pPBA1100-E的牛多杀性巴氏杆菌,在诱导初期其菌液OD600nm值呈上升趋势,在诱导后2 h时达到最高,随后逐渐降低,在诱导后10 h左右趋于平稳所需诱导时间较国内外报道的制备其他革兰氏阴性菌菌影所需诱导时间要长[14-16],具体原因还有待进一步探讨。
试验制备的牛多杀性巴氏杆菌菌影裂解率为99.997%,尽管能够达到较高的水平,但在诱导过程中细菌并没有全部打孔,仍有活菌存在,为了达到完全灭活,采用冻干法,将制备的菌影冻干两次,每次置于冻干机中冻干12 h,经过检测细菌已被完全灭活,其原因可能是细菌在冻干的过程中会有一部分活菌死亡,在不加保护剂的情况下死亡的细菌数量会更多,而且菌影中存留的活菌数量本身很低,导致菌影在冻干过程中存留的少量活菌被全部灭活,但是在此过程中,抗原可能由于反复冻融而遭到破坏,导致其免疫原性降低。由于金黄色葡萄球菌的核酸酶A基因对核酸有较强的降解能力,能够将细菌的核酸降解成小的片段。Haidinger等[17-18]将葡萄球菌核酸酶A与噬菌体phiX174裂解基因E联合表达来提高裂解效率。此方法能够使打孔效率提高,但是此方法仍然不能达到100%的打孔。因此,在提高菌影的打孔效率方面还需要进一步的研究。
[1]Khamesipour F,Momtaz H,Azhdary Mamoreh M.Occurrence of virulence factors and antimicrobial resistance in Pasteurella multocida strains isolated from slaughter cattle in Iran[J].Front Microbiol,2014(5):536-546.
[2]Crawshaw WM,Caldow GL.Field study of pneumonia in vaccinated cattle associated with incorrect vaccination and Pasteurella multocida infection[J].Vet Rec,2015,176 (17):434-441.
[3]Larson R L,Step D L.Evidence-based effectiveness of vaccination against Mannheimia haemolytica,Pasteurella multocida,and Histophilus somni in feedlot cattle for mitigating the incidence and effect of bovine respiratory disease complex[J].Vet Clin North Am Food Anim Pract,2012,28(1):97-106.
[4]刘欢,李德允.不同水分TMR对绵羊瘤胃纤维分解酶活力与微生物生态的影响[J].延边大学农学学报,2013 (2):160-164.
[5]郑家三,刘健男,吴凌,等.泌乳奶牛不同泌乳阶段某些主要维生素与微量元素缺乏的调查研究[J].黑龙江八一农垦大学学报,2015,27(3):52-56.
[6]Henrich B,Lubitz W,Plapp R.Lysis of Escherichia coli by induction of cloned phiX174 genes[J].Mol Gen Genet,1982,185:493-497.
[7]Langemann T,Koller VJ,Muhammad A,et al.The Bacterial Ghost platform system:production and applications[J]. Bioeng Bugs,2010(5):326-336.
[8]Chen J,Li N,She F.Helicobacter pylori outer inflammatory protein DNA vaccine-loaded bacterial ghost enhances immune protective efficacy in C57BL/6 mice[J].Vaccine,2014,32(46):6054-6060.
[9]Wen J,Yang Y,Zhao G,et al.Salmonella typhi Ty21a bacterial ghost vector augments HIV-1 gp140 DNA vaccineinduced peripheral and mucosal anti body responses via TLR4 pathway[J].Vaccine,2012,30(39):5733-5739.
[10]Langemann T,Mayr UB,Meitz A,et al.Multi-parameter flow cytometry as a process analytical technology(PAT)approach for the assessment of bacterial ghost production [J].Appl Microbiol Biotechnol,2016,100(1):409-418.
[11]Koller VJ,Dirsch VM,Beres H.Modulation of bacterial ghosts-induced nitric oxide production in macrophages by bacterialghost-deliveredresveratrol[J].FEBSJ,2013,280(5):1214-1225.
[12]Walcher P,Mayr UB,Azimpour-Tabrizi C,et al.Antigen discovery and delivery of subunit vaccines by nonliving bacterial ghost vectors[J].Expert Rev Vaccines,2004 (6):681-691.
[13]张宗伟,李娜,李兆华,等.红曲霉中药合生元对育肥猪生长性能的影响[J].延边大学农学学报,2013(3):234-237.
[14]Cai K,Tu W,Liu Y,et al.Novel fusion antigen displayedbacterial ghosts vaccine candidate against infection of Escherichia coli O157:H7[J].Sci Rep,2015(5):17479.
[15]VinodN,OhS,KimS,etal.Chemicallyinduced Salmonella enteritidis ghosts as a novel vaccine candidate against virulent challenge in a rat mode[J].Vaccine,2014,32(26):3249-5325.
[16]Marchart J,Dropmann G,Lechleitner S,et al.Pasteurella multocida-and Pasteurella haemolytica-ghosts:new vaccine candidates[J].Vaccine,2003,21(25-26):3988-3997.
[17]Haidinger W,Mayr U B,Szostak MP,et al.Eschedchia coli ghost production by expression lysis gene E and staphylococcal nuclease[J].Appl Environ Microbiol,2003,69(10):6106-6113.
[18]王丽哲,雷连成,韩文瑜.裂解基因E和核酸酶基因串联表达载体的构建及大肠杆菌菌影的制备[J].中国生物制品学杂志,2007(20):557-561.
Preparation of Cattle Pasteurella multocida Ghosts
Chang Chunlong,Wang Shixia,Zhai Junjun,Ni Hongbo
(College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
The temperature-sensitive lysis cassettes containing phage PhiX174 lytic gene E and start repressor system CI857-PLPR was amplified from plasmid pHH43 by PCR,the lysis cassettes CI857-PL-PR-E was inserted into shuttle vector pPBA1100,the recombinant plasmid pPBA1100-E was conjugated into cattle P.multocida by the experiment of conjugation,the lysis efficiency in P.multocida were detected by lysis dynamics test.The results showed that the lysis plasmid pPBA1100-E was successfully constructed,and it was transferred into P.multocida.The result of lysis dynamics test indicated that the lysis plasmid pPBA1100-E in Cattle P.multocida had a high lysising efficiency,the lysising efficiency was 99.98%.The cattle P.multocida ghosts was successfully prepared in this experiment,which laid the foundation for the further development of the cattle P.multocida ghost vaccine.
cattle Pasteurella multocida;ghost;lysis efficiency
Q78
A
1002-2090(2017)03-0020-04
10.3969/j.issn.1002-2090.2017.03.005
2016-03-20
黑龙江省博士后科研启动金资助(LBH-Q14134)。
常春龙(1989-),男,黑龙江八一农垦大学动物科技学院2013级硕士研究生。
倪宏波,男,教授,博士研究生导师,E-mail:nihongbo@sina.com;翟军军,男,讲师,E-mail:359143753@qq.com。
