抑制自噬对贝伐单抗诱导的结肠癌HCT116细胞凋亡的影响
2017-06-07张燕燕杨家梅
柴 婷,任 爽,张燕燕,匡 菁,杨家梅
郑州大学第二附属医院肿瘤科 郑州 450014
抑制自噬对贝伐单抗诱导的结肠癌HCT116细胞凋亡的影响
柴 婷,任 爽,张燕燕,匡 菁,杨家梅#
郑州大学第二附属医院肿瘤科 郑州 450014
#通信作者,女,1965年12月生,硕士,主任医师,研究方向:肿瘤化疗,E-mail:yjm6601@163.com
自噬;贝伐单抗;结肠癌;凋亡
目的:探讨抑制自噬对贝伐单抗诱导的结肠癌HCT116细胞凋亡的影响。方法:用贝伐单抗、自噬抑制剂3-甲基腺嘌呤(3-MA)处理人结肠癌HCT116细胞48 h,Annexin V-FITC染色、流式细胞术检测细胞凋亡,吖啶橙染色、荧光显微镜观察细胞酸性自噬泡的变化,Western blot法检测细胞内自噬相关蛋白Beclin-1以及凋亡相关蛋白Caspase-9的表达。结果:贝伐单抗作用48 h对HCT116细胞的半数抑制剂量(IC50)为16 mg/L,3-MA的IC50为5 mmol/L。在此浓度下,3-MA单独作用可降低细胞中Beclin-1的表达,贝伐单抗单独作用可增强细胞中Beclin-1的表达,二者联用有拮抗作用(P<0.05)。3-MA和贝伐单抗单独作用均可提高细胞凋亡率(P<0.05),增强细胞中Caspase-9蛋白的表达(P<0.05),二者联用有协同作用(P<0.05)。结论:抑制自噬可增强贝伐单抗对结肠癌HCT116细胞的杀伤作用。
贝伐单抗是靶向血管内皮生长因子(vascular endothelial growth factor,VEGF)的单克隆抗体,可以明显抑制肿瘤组织新生血管的形成,从而造成旺盛生长的肿瘤细胞的供血不足,导致肿瘤细胞缺血、缺氧[1]。自噬是肿瘤细胞对抗各种抗肿瘤作用的有效手段,通过降解受损的肿瘤细胞细胞器、大分子蛋白质,给肿瘤细胞提供生物合成所需的分子底物,帮
助其应对恶劣的生存环境并维持细胞的稳态。特别是在肿瘤化疗过程中,自噬能够通过隔离并降解被药物破坏的蛋白或细胞器,保护细胞并对抗化疗药物,降低化疗药物的疗效[2-5]。该研究中,作者用自噬抑制剂3-甲基腺嘌呤(3-MA)和贝伐单抗单独或联合作用于结肠癌HCT116细胞,观察抑制自噬对贝伐单抗诱导的HCT116细胞凋亡的影响。
1 材料与方法
1.1 材料 HCT116细胞株由河南省高等学校临床医学重点学科开放实验室冻存。贝伐单抗购自Roche公司,3-MA、膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒均购自凯基生物科技发展有限公司,胎牛血清购自四季青生物工程材料有限公司,MTT购自Sigma公司,RPMI 1640及胰蛋白酶消化液购自Solarbio公司, Beclin-1及Caspase-9多克隆抗体购自美国Santa Cruz公司。
1.2 贝伐单抗和3-MA作用浓度的筛选 配制0、4、8、16、32、64 mg/L的贝伐单抗溶液及0.0、1.0、2.5、5.0、7.0、10.0 mmol/L的3-MA溶液,均用dH2O稀释。HCT116细胞复苏后用RPMI 1640培养基于37 ℃、体积分数5%CO2、饱和湿度条件下培养,每3 d更换培养液1次,使用胰蛋白酶消化传代。取对数生长期细胞,调细胞密度为1×108L-1,接种于96孔板,每孔加入细胞悬液100 μL,连续培养24 h后弃培养液,分别加入100 μL不同浓度的贝伐单抗溶液或3-MA溶液作用24、48、72 h,然后MTT法检测细胞生长抑制率,酶标仪测定波长为490 nm,记录吸光度(A)值。以生理盐水培养的细胞为对照,每个浓度设置3个复孔。细胞生长抑制率=(1-A实验组/A对照)×100%。绘制细胞生长曲线确定贝伐单抗或3-MA的半数抑制剂量(IC50),用于后续实验。
1.3 贝伐单抗联合3-MA对HCT116细胞的影响
1.3.1 实验分组 取对数生长期的HCT116细胞,调细胞密度为1×108L-1并接种于细胞培养板,分4组处理,分别为对照组(加入生理盐水)、贝伐单抗组、3-MA组及联合组,每组3个复孔。
1.3.2 细胞自噬变化的观察 取对数生长期的HCT116细胞,经胰蛋白酶消化处理后接种于24孔板,待细胞贴壁,按1.3.1分组处理48 h,弃培养液,加入浓度为10 mg/L的吖啶橙(AO),室温、避光条件下孵育20 min,冷PBS洗涤3次,最后于倒置荧光显微镜下观察细胞中酸性自噬泡的变化。
1.3.3 细胞凋亡率检测 将细胞接种于6孔板,待细胞贴壁,按1.3.1分组处理48 h,离心收集悬浮细胞,使用胰蛋白酶消化并收集细胞,用冷PBS洗涤2次,加入5 μL Annexin V-FITC染色液并混匀,4 ℃避光条件下孵育15 min,随后加入10 μL PI并轻轻混匀,同等条件下孵育5 min,然后上流式细胞仪检测。1.3.4 细胞中Beclin-1和Caspase-9蛋白检测 HCT116细胞同上分组处理48 h后,用Western blot法检测Beclin-1和Caspase-9蛋白的表达。一抗工作浓度均为1:500,辣根过氧化物酶标记的二抗工作浓度均为1:2 000。以GAPDH为内参照。最后行ECL,扫描拍照,应用Image J图像处理软件进行灰度分析。
1.4 统计学处理 应用SPSS 13.0进行分析。采用2×2析因设计的方差分析比较贝伐单抗、3-MA单用及联用对HCT116细胞凋亡率、Beclin-1和Caspase-9蛋白表达的影响,检验水准α=0.05。
2 结果
2.1 贝伐单抗和3-MA作用浓度的筛选 HCT116细胞生长曲线见图1。作用于HCT116细胞48 h,贝伐单抗的IC50为16 mg/L,3-MA的IC50为5 mmol/L,因此后续实验贝伐单抗和3-MA的作用浓度选用16 mg/L和5 mmol/L。
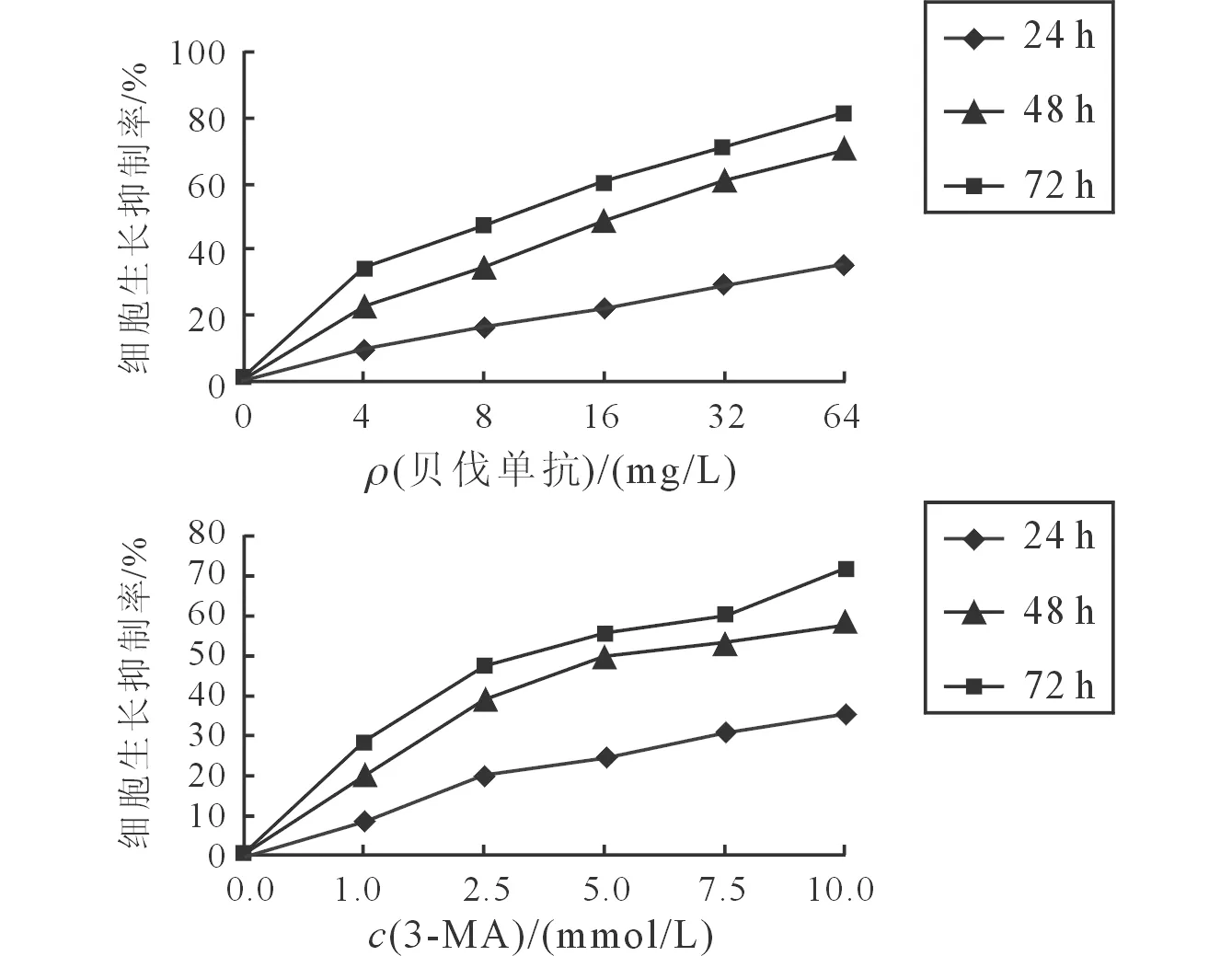
图1 贝伐单抗(上)和3-MA(下)作用下HCT116细胞的生长曲线
2.2 贝伐单抗联合3-MA作用后HCT116细胞自噬变化 倒置荧光显微镜下(图2)观察,对照组细胞胞核呈绿色荧光,胞质可见少量点状红色荧光;贝伐单抗组细胞胞核呈黄绿色荧光,且胞质呈点片状红色荧光;3-MA组细胞胞核呈绿色荧光,胞质未见红色荧光;联合组细胞胞核呈淡绿色荧光,胞质可见稀少红色荧光。结果提示,对照组、贝伐单抗组存在自噬现象,而3-MA可以抑制贝伐单抗诱导的HCT116细胞自噬。
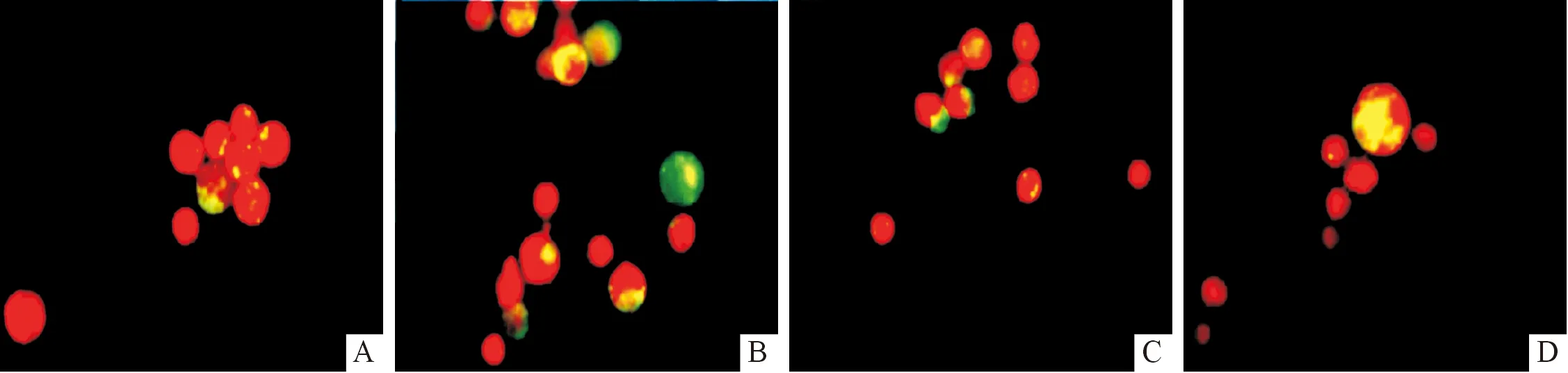
A:对照组;B:贝伐单抗组;C:3-MA 组;D:联合组。图2 细胞自噬表现(AO染色,×400)
2.3 贝伐单抗联合3-MA作用后HCT116细胞凋亡率检测结果 见表1。3-MA和贝伐单抗均可诱导HCT116细胞凋亡,且两者有协同作用。

表1 4组HCT116细胞凋亡率的比较(n=3) %
F3-MA=5 690.925,F贝伐单抗= 525 121.004,F交互=9 674.245,P均<0.001。
2.4 贝伐单抗联合3-MA作用后HCT116细胞中Beclin-1和Caspase-9蛋白的表达 见图3,表2、3。3-MA和贝伐单抗单独作用均可增强HCT116细胞中Caspase-9的表达,且两者有协同作用。3-MA可降低HCT116细胞中Beclin-1蛋白的表达,贝伐单抗则促其表达,两者有拮抗作用。

1:对照组;2:3-MA组;3:贝伐单抗组;4:联合组。图3 4组细胞中Beclin-1和Caspase-9蛋白的表达
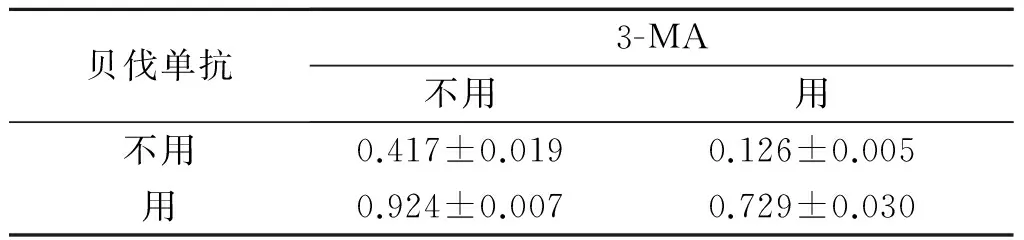
表2 4组细胞Beclin-1蛋白表达的比较(n=3)
F3-MA=1 680.884,F贝伐单抗=8 776.717,F交互=66.749,P均<0.001。
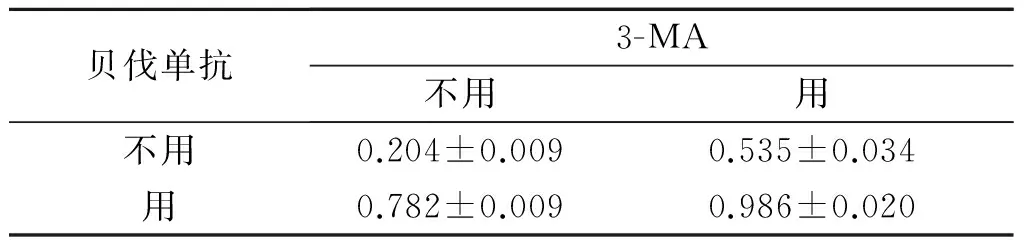
表3 4组细胞Caspase-9蛋白表达的比较(n=3)
F3-MA=1 615.213,F贝伐单抗=5 978.611,F交互=89.905,P均<0.001。
3 讨论
大量新生血管的形成是肿瘤的特征之一[6]。贝伐单抗为新型靶向VEGF的人源化单克隆抗体,主要通过中和VEGF,阻断其与膜上相关受体的结合,从而减少肿瘤细胞的血供、氧供等,抑制肿瘤细胞的生长、转移[7]。目前贝伐单抗主要应用于晚期结直肠癌、非小细胞肺癌等恶性肿瘤的辅助治疗,可显著延长患者的生存期[8-9]。
自噬是细胞一种重要的防御和自我保护机制[10]。在肿瘤早期,自噬通过破坏肿瘤细胞来抑制肿瘤的发生;在肿瘤的增殖期,肿瘤内部会出现血供不良,自噬可以使其对抗缺氧和营养不足。研究[11]表明,应用分子靶向药物治疗恶性肿瘤的同时也可诱导肿瘤细胞发生自噬,从而削弱分子靶向药物的疗效。使用伊马替尼治疗慢性髓系白血病时,伊马替尼可通过诱导自噬相关基因Beclin-1高表达,从而对白血病细胞起到保护作用,而抑制自噬可促进伊马替尼诱导的白血病细胞的死亡[12]。曲妥珠单抗在治疗HER-2(+)的乳腺癌过程中易发生耐药,而联合应用3-MA可增强曲妥珠单抗的治疗效果[13]。
该研究中,作者采用3-MA、贝伐单抗单独或联合作用于HCT116细胞,观察HCT116细胞自噬变化,检测自噬相关蛋白Beclin-1表达的变化,同时检测细胞凋亡率和凋亡相关蛋白Caspase-9表达的变化。结果显示,3-MA可增强贝伐单抗诱导的结肠癌HCT116细胞的凋亡,减弱贝伐单抗诱导的HCT116细胞的自噬水平。
该研究结果提示,自噬抑制剂3-MA可增强贝伐单抗的抗肿瘤作用,自噬抑制剂和贝伐单抗联合应用可成为一种新的结肠癌辅助治疗方法。
[1]FERRARA N,HILLAN KJ,GERBER HP,et al.Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer[J].Nat Rev Drug Discov,2004,3(5):391
[2]THORBURN A,THAMM DH,GUSTAFSON DL.Autophagy and cancer therapy[J].Mol Pharmacol,2014,85(6):830
[3]GARG AD,DUDEK AM,FERREIRA GB,et al.ROS-induced autophagy in cancer cells assists in evasion from determinants of immunogenic cell death[J].Autophagy,2013,9(9):1292
[4]GARG AD,DUDEK AM,AGOSTINIS P.Autophagy-dependent suppression of cancer immunogenicity and effector mechanisms of innate and adaptive immunity[J].Oncoimmunology,2013,2(10):e26260
[5]PETROVSKI G,AYNA G,MAJAI G,et al.Phagocytosis of cells dying through autophagy induces inflammasome activation and IL-1β release in human macrophages[J].Autophagy,2011,7(3):321
[6]HANAHAN D,WEINBERG RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646
[7]王营,郭志,倪虹.贝伐珠单抗治疗复发性卵巢癌的应用进展[J].肿瘤防治研究,2015,42(4):416
[8]胡孟达.贝伐珠单抗联合 FOLFIRI 方案对于晚期 MCRC 患者的疗效及安全性分析[J].世界最新医学信息文摘,2016,16(78):7
[9]SANDLER A,GRAY R,PERRY MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542
[10]KLIONSKY DJ,ABDALLA FC,ABELIOVICH H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445
[11]RUBINSZTEIN DC,CODOGNO P,LEVINE B.Autophagy modulation as a potential therapeutic target for diverse diseases[J].Nat Rev Drug Discov,2012,11(9):U84
[12]CAREW JS,NAWROCKI ST,GILES FJ,et al.Targeting autophagy: a novel anticancer strategy with therapeutic implications for imatinib resistance[J].Biologics,2008,2(2):201
[13]VAZQUEZ-MARTIN A,OLIVERAS-FERRAROS C,MENENDEZ JA.Autophagy facilitates the development of breast cancer resistance to the anti-HER2 monoclonal antibody trastuzumab[J].PLoS One,2009,4(7):e6251
(2016-08-31收稿 责任编辑王 曼)
Effect of autophagy inhibition on bevacizumab-induced apoptosis of human colon cancer HCT116 cells
CHAITing,RENShuang,ZHANGYanyan,KUANGJing,YANGJiamei
DepartmentofOncology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014
autophagy;bevacizumab;colon cancer;apoptosis
Aim: To study the effect of autophagy inhibition on bevacizumab-induced apoptosis of HCT116 cells.Methods: Human colon cancer HCT116 cells were treated with bevacizumab and autophagy inhibitor 3-methyl adenine(3-MA) alone or combined for 48 h, cell apoptosis rate was detected by Annexin V-FITC staining and flow cytometry, the changes of acidic autophagic vacuoles observed by acridine orange staining, the expressions of autophagy-related protein Beclin-1 and apoptosis-related protein Caspase-9 were detected by Western blot. Results: The median inhibition dose of bevacizumab for 48 h was 16 mg/L, and that of 3-MA was 5 mmol/L. At these doses,3-MA alone could decrease the expression of Beclin-1 in the cells(P<0.05), while bevacizumab alone could enhance Beclin-1 expression(P<0.05), and the effects of bevacizumab and 3-MA were antagonistic(P<0.05). 3-MA and bevacizumab alone could increase the apoptosis rate(P<0.05) and enhance the expression of Caspase-9 protein in the cells(P<0.05), and they had synergistic effect(P<0.05).Conclusion: Autophagy inhibition may enhance the killing effect of bevacizumab on the human colon cancer HCT116 cells.
10.13705/j.issn.1671-6825.2017.03.028
R735.3