药物难治性颞叶癫痫患者致痫灶组织中高迁移率族蛋白B1表达与致痫灶切除术远期预后的关系*
2017-06-07郭电渠王新军杨如意武跃辉谢井伟周少龙李晓辉
郭电渠,王新军,杨如意,武跃辉,王 振,谢井伟,梁 博,周少龙,李晓辉
1)郑州市第一人民医院神经外科 郑州 450004 2)郑州大学第五附属医院神经外科 郑州 450052 3)洛阳市中心医院神经外科 洛阳 471000
药物难治性颞叶癫痫患者致痫灶组织中高迁移率族蛋白B1表达与致痫灶切除术远期预后的关系*
郭电渠1),王新军2)#,杨如意2),武跃辉2),王 振2),谢井伟2),梁 博2),周少龙2),李晓辉3)
1)郑州市第一人民医院神经外科 郑州 450004 2)郑州大学第五附属医院神经外科 郑州 450052 3)洛阳市中心医院神经外科 洛阳 471000
#通信作者,男,1965年7月生,博士,教授,主任医师,研究方向:药物难治性癫痫的外科治疗,E-mail:wangxj@zzu.edu.cn
难治性癫痫;远期预后;高迁移率族蛋白B1
目的:探讨高迁移率族蛋白B1(HMGB1)在药物难治性颞叶癫痫患者致痫灶组织中的表达与致痫灶切除术远期预后的关系。方法:选取行致痫灶切除术的药物难治性颞叶癫痫患者80例,术中留取致痫灶组织标本;选取同期行颅内减压术的患者20例为对照,术中留取颅内减压的正常脑组织标本。免疫组化法检测脑组织中HMGB1的表达水平。患者术后随访2 a,分析预后影响因素。结果:癫痫患者致痫灶组织中HMGB1阳性表达率(100%)高于对照组(25%)(P<0.001);患者术前癫痫病程>3 a[OR(95%CI)=3.999(1.535~10.417)]、致痫灶组织中HMGB1强阳性表达[OR(95%CI)=3.483(1.459~8.317)]是药物难治性颞叶癫痫患者术后2 a癫痫控制不佳的独立危险因素。结论:HMGB1可能成为药物难治性颞叶癫痫发病机制、诊疗研究、预后评估的新靶点。
药物难治性癫痫指经两种或两种以上抗癫痫药物正规治疗2 a以上且血药浓度处于有效范围内,仍不能完全控制癫痫的发作;在我国近600万的癫痫患者中,20%~30%为药物难治性癫痫[1-2]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种广泛存在于真核细胞内的非组蛋白染色体结合蛋白[3],参与多种细胞生理过程。在细胞核内,HMGB1参与稳定核小体,调节基因转录;在细胞质和细胞外,HMGB1与多种受体结合,如Toll样受体4(toll-like receptor-4,TLR4)、TLR2和晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE),参与炎症反应、细胞分化、增殖、迁移以及抗肿瘤免疫反应等[4-6]。研究[7]表明,HMGB1-TLR4轴在小鼠急性癫痫发作的超早期及慢性癫痫模型中发挥重要作用。作者对药物难治性颞叶癫痫患者致痫灶组织中HMGB1的表达及其与致痫灶切除术远期预后的关系进行了探讨。
1 对象与方法
1.1 研究对象 选取2012年1月1日至2013年1月1日于郑州大学第五附属医院神经外科行致痫灶切除术的药物难治性颞叶癫痫患者80例为癫痫组。纳入标准:①患者术前均有典型癫痫发作症状,术前长程视频脑电监测、术中皮层脑电监测均发现固定、局限的颞叶致痫灶。②用2种或2种以上一线抗癫痫药物且血药浓度处于有效范围内、治疗2 a以上,癫痫仍不能完全控制且无手术禁忌者。③既往史、家族史、个人史及影像学检查排除继发性癫痫。80例中男44例,女36例,手术年龄7~66岁;致痫灶位于左颞叶者39例,位于右颞叶者41例;术前癫痫发作时间30 s~23 min,平均5 min;术前癫痫发作频率1~12次/月,平均3次/月;癫痫发作类型为部分性发作17例,全身性发作35例,混合性发作28例;病程2~27 a,平均3 a。
选取同期于该院行颅内减压术的20例患者为对照组,患者均无癫痫病史,均因高血压脑出血行颅内减压术,术中确认可留取非功能区脑组织。所有患者的脑组织留取均已获该院伦理委员会批准及患者、家属知情同意。
1.2 标本采集 癫痫组术中打开硬脑膜后在麻醉师配合下减轻麻醉剂量,对颞叶皮层进行脑电监测确认致痫灶区域,手术切除,在保留足够病理检测标本前提下,留取直径约1 cm的包括白质、灰质的脑组织标本块3份;对照组术中亦留取直径约1 cm的包括白质、灰质的非功能区脑组织标本块3份;于冻存管内液氮冻存,后转移至-80 ℃冰箱中保存。
1.3 脑组织标本中HMGB1的检测 兔抗人HMGB1单克隆抗体购自美国Sigma公司,羊抗兔二抗试剂盒及DAB显色试剂盒购自上海拜沃生物科技有限公司;Nikon荧光显微镜购自日本Nikon公司。标本包埋后以3 μm厚连续切片,置于防脱剂预处理后的载玻片上,滴加HMGB1单克隆抗体(抗体稀释度1:20)4 ℃过夜,PBS清洗后滴加生物素标记的二抗室温孵育20 min,PBS清洗,加辣根过氧化物酶标记的链霉卵白素工作液室温孵育15 min,DAB显色,冲洗,苏木精复染,常规乙醇脱水,二甲苯透明,中性树胶封片后显微镜下观察。以PBS代替一抗作阴性对照。结果判定:阳性细胞表现为细胞质黄色着色。每张切片选择免疫反应较强的区域,高倍(×400)视野下观察5个不重复视野。计数阳性细胞及视野内总细胞数,染色率=(阳性细胞数/总细胞数)×100%;无阳性细胞计为0分,染色率≤25%为1分,25%~为2分,50%~为3分,>75%为4分。再依据染色程度评分:无染色为0分,淡黄色为1分,深黄色为2分。两种评分相加为最终得分,0分为阴性,1~3分为弱阳性,4~6分为强阳性。
1.4 癫痫组术后随访与疗效评定 癫痫组患者出院后均遵医嘱规律口服抗癫痫药物并定期复诊,根据发作情况、脑电图调整用药。术后随访2 a,采用改良Engel分级标准进行预后评估:无影响功能的癫痫发作(除外术后早期的发作)为EngelⅠ级,仅有稀少的影响功能的癫痫发作为EngelⅡ级,癫痫发作得到相当改善为EngelⅢ级,改善不明显为EngelⅣ级。
1.5 统计学处理 利用SPSS 21.0进行统计学处理。两组脑组织中HMGB1阳性表达率的比较采用精确概率法,不同临床病理特征癫痫患者预后的比较采用χ2检验,采用logistic回归分析筛选远期预后的影响因素,检验水准α=0.05。
2 结果
2.1 两组患者脑组织中HMGB1表达情况的比较
HMGB1免疫组化染色表现见图1。癫痫组致痫灶脑组织中HMGB1强阳性表达44例,弱阳性表达36例;对照组强阳性表达1例,弱阳性表达4例。致痫灶组织中HMGB1阳性表达率(100%)明显高于对照组(25%)(P<0.001)。
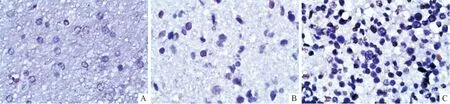
A:HMGB1阴性;B:HMGB1阳性;C:HMGB1强阳性。图1 HMGB1的免疫组化染色表现(SP,×400)
2.2 不同临床病理特征的癫痫患者远期预后的比较 80例患者随访资料完整,其中术后2 a癫痫发作达到EngelⅠ级者56例,EngelⅡ~Ⅳ级者24例(EngelⅡ级12例,EngelⅢ级7例,EngelⅣ级5例)。远期预后与术前癫痫发作时间、癫痫发作频率、癫痫发作类型、病程、致痫灶脑组织中HMGB1的表达水平有关,而与患者性别、手术年龄、致痫灶位置无关,详见表1。
2.3 癫痫患者远期预后影响因素分析 以患者远期预后为因变量,以患者性别、手术年龄、致痫灶位置、癫痫发作时间、癫痫发作频率、癫痫发作类型、术前病程、致痫灶组织中HMGB1表达为自变量进行logistic回归分析,变量赋值见表2,回归结果见表3。最终术前病程>3 a和致痫灶组织中HMGB1强阳性表达是药物难治性颞叶癫痫患者术后2 a癫痫控制不佳的独立危险因素。
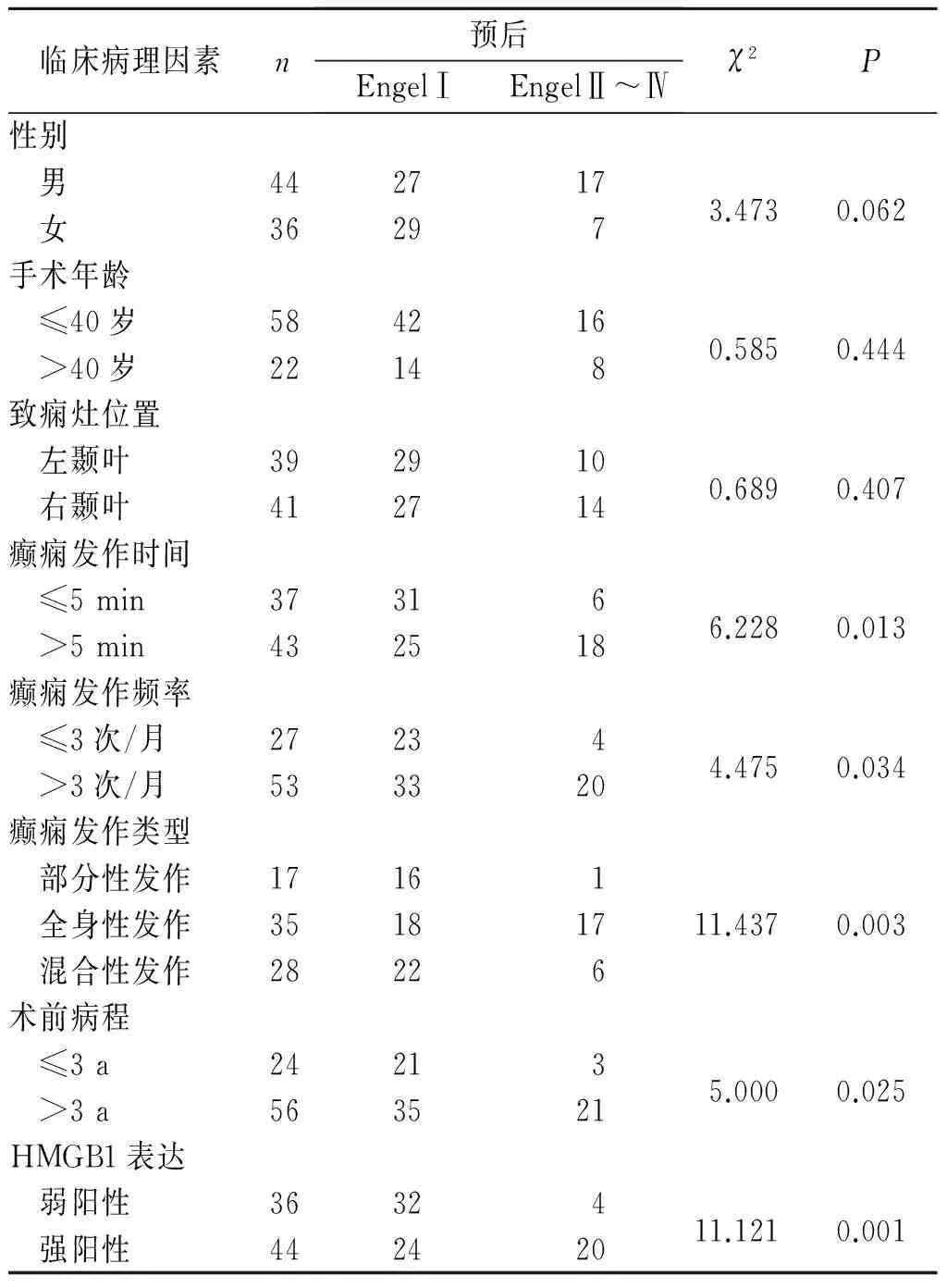
表1 不同临床病理特征的癫痫患者远期预后的比较 例

表2 变量赋值表
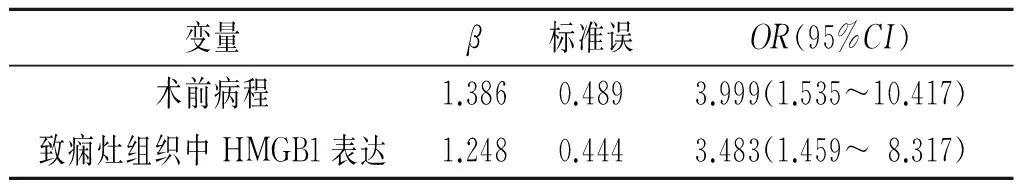
表3 Logistic回归结果
3 讨论
近年来研究表明,HMGB1与多种疾病的发生发展密切相关,如鼻咽癌[8]、黑色素瘤[9]、胶质瘤[10-11]等。胶质瘤组织中HMGB1的高表达与症状性癫痫的发生关系密切[12]。Maroso等[7]研究表明癫痫模型小鼠脑组织中HMGB1高表达,HMGB1或其受体TLR4的拮抗剂可减轻癫痫发作程度。
该研究发现,药物难治性颞叶癫痫患者致痫灶组织中HMGB1阳性表达率明显高于正常脑组织,致痫灶组织中HMGB1表达水平与术后2 a预后关系密切,高表达者手术的远期预后不佳,表明HMGB1可能在致痫灶形成、癫痫发作中起到重要作用。致痫灶组织中小胶质细胞、星形胶质细胞、神经元变性后可释放大量HMGB1,作用于细胞膜上的受体TLR4、RAGE,活化COX-2、NF-κB,介导炎症反应;神经元中HMGB1-TLR4炎症反应通路可通过酪氨酸激酶调节的磷酸化作用引起Ca2+的大量释放,导致神经元细胞内外离子失衡,形成异常放电,异常放电达到一定阈值就会出现癫痫发作[13]。HMGB1-TLR4介导的炎症反应越强烈,越易产生密集异常脑电的发放与传导,使得癫痫发作频率增加,发作时间延长。
该研究还发现,术前病程>3 a是药物难治性颞叶癫痫术后2 a癫痫控制不佳的独立危险因素。有研究[14]报道,病程越长,患者术后预后越差,其原因可能为大量异常放电同步化时出现癫痫发作,这些异常放电会对致痫灶周围及传导通路周围的正常神经元产生干扰,久之会使致痫灶区域扩大甚至出现远隔部位的新致痫灶,形成多灶性癫痫,其定位难度及手术难度增大,手术治疗预后不佳。故建议药物难治性颞叶癫痫患者宜早期手术以改善预后。
综上所述,HMGB1作为一种炎症因子,可能通过介导颅内局部慢性炎症参与癫痫发作,影响患者致痫灶切除术的远期预后。HMGB1可能成为评估药物难治性癫痫患者致痫灶切除术远期预后的新指标,为难治性癫痫的发病机制、诊疗研究提供了新的方向。
[1]FARRELL K,WIRRELL E,WHITING S.The definition and prediction of intractable epilepsy in children[J].Adv Neurol,2006,97:435
[2]KWAN P,ARZIMANOGLOU A,BERG AT,et al.Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J].Epilepsia,2010,51(6):1069
[3]ELLERMAN JE,BROWN CK,DE VERA M,et al.Masquerader:high mobility group box-1 and cancer[J].Clin Cancer Res,2007,13(10):2836
[4]TANG D,KANG R,ZEH HJ 3RD,et al.High-mobility group box 1 and cancer[J].Biochim Biophys Acta,2010,1799(1/2):131
[5] SIMS GP,ROWE DC,RIETDIJK ST,et al.HMGB1 and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,28:367
[6]YANG H,TRACEY KJ.Targeting HMGB1 in inflammation[J].Biochim Biophys Acta,2010,1799(1/2):149
[7]MAROSO M,BALOSSO S,RAVIZZA T,et al.Toll-like receptor 4 and high-mobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J].Nat Med,2010,16(4):413
[8]WU D,DING Y,WANG S,et al.Increased expression of high mobility group box 1(HMGB1) is associated with progression and poor prognosis in human nasopharyngeal carcinoma[J].J Pathol,2008,216(2):167
[9]POSER I,GOLOB M,BUETTNER R,et al.Upregulation of HMG1 leads to melanoma inhibitory activity expression in malignant melanoma cells and contributes to their malignancy phenotype[J].Mol Cell Biol,2003,23(8):2991
[10]WANG XJ,ZHOU SL,FU XD,et al.Clinical and prognostic significance of high-mobility group box-1 in human gliomas[J].Exp Ther Med,2015,9(2):513
[11]王新军,杨如意,周少龙,等.胶质瘤相关性癫痫致痫灶组织中高迁移率族蛋白 B1的表达[J].郑州大学学报(医学版),2015,50(5):634
[12]王新军,杨如意,单峤.等 胶质瘤相关性癫痫瘤组织中高迁移率族蛋白B1表达与痫性发作[J].中国神经精神疾病杂志,2015,41(3):155
[13]IORI V,MAROSO M,RIZZI M,et al.Receptor for advanced glycation endproducts is upregulated in temporal lobe epilepsy and contributes to experimental seizures[J].Neurobiol Dis,2013,58(10):102
[14]LEE SA,YIM SB,LIM YM,et al.Factors predicting seizure outcome of anterior temporal lobectomy for patients with mesial temporal sclerosis[J].Seizure,2006,15(6):397
(2016-07-10收稿 责任编辑王 曼)
Correlation of HMGB1 expression in epileptogenic focus tissue from temporal lobe intractable epilepsy patients and postoperative long-term prognosis
GUODianqu1),WANGXinjun2),YANGRuyi2),WUYuehui2),WANGZhen2),XIEJingwei2),LIANGBo2),ZHOUShaolong2),LIXiaohui3)
1)DepartmentofNeurosurgery,theFirstPeople′sHospitalofZhengzhouCity,Zhengzhou450004 2)DepartmentofNeurosurgery,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 3)DepartmentofNeurosurgery,LuoyangCityCentralHospital,Luoyang,Henan471000
intractable epilepsy;long-term prognosis;high mobility group box 1
Aim: To explore the correlation of HMGB1 expression in epileptogenic focus tissue of temporal lobe intractable epilepsy patients and prognosis after resection of epileptogenic focus. Methods: The epileptogenic focus tissue from 80 temporal lobe intractable epilepsy patients undergoing resection of epileptogenic focus(experimental group) and the normal brain tissue from 20 patients undergoing intracranial decompression(control group) were collected to detect HMGB1 expression by immunohistological method. Epilepsy patients were followed up for 2 years after operation. Results: Positive expression rate of HMGB1 in experimental group(100%) was higher than that(25%) in control group(P<0.001). Course of preoperative epilepsy>3 years(OR=3.999,95%CI=1.535-10.417) and high expression of HMGB1 in epileptogenic focus tissue(OR=3.483,95%CI=1.459-8.317) were the independent factors impacting the prognosis of intractable epilepsy patients 2 years after operation.Conclusion: HMGB1 may become a new biomarker to study pathogenesis, diagnosis and treatment as well as evaluate prognosis.
10.13705/j.issn.1671-6825.2017.03.017
*河南省教育厅重点科技攻关项目 092102310090;郑州市科技创新领军人才项目 121PLJRC536
R742.1