人脂肪间充质干细胞体外高效扩增新方法
2017-06-06黄邓高高元慧王顺兰曹卉郑琳麟张淑芳余平
黄邓高,高元慧,王顺兰,曹卉,郑琳麟,张淑芳,余平
(1.中南大学湘雅医学院免疫系,湖南长沙410013;2.海口市人民医院暨中南大学湘雅医院附属海口医院中心实验室,海南海口570208)
人脂肪间充质干细胞体外高效扩增新方法
黄邓高1,高元慧2,王顺兰2,曹卉2,郑琳麟2,张淑芳2,余平1
(1.中南大学湘雅医学院免疫系,湖南长沙410013;2.海口市人民医院暨中南大学湘雅医院附属海口医院中心实验室,海南海口570208)
目的运用低强度脉冲场超声(LIPUS)刺激促进人脂肪间充质干细胞(hASCs)增殖,为临床干细胞体外高效增殖提供新方法。方法通过LIPUS体外刺激hASCs细胞生长,采用Scepter 2.0手持细胞计数器进行细胞计数,运用荧光倒置显微镜观察细胞形态,运用流式细胞仪检测细胞表面标志物,并进行干细胞临床前质量检测。结果刺激组50 mW/cm2和60 mW/cm2的LIPUS刺激强度均能促进细胞增殖,60 mW/cm2强度更显著,与对照组比较差异均具有统计学意义(P<0.05);细胞倍增时间比对照组缩短,差异具有统计学意义(P<0.05),刺激后刺激组细胞表面标志物无变化,增殖后干细胞质量检测符合标准要求。结论LIPUS刺激可促进hASCs有效增殖,低强度脉冲场超声可作为干细胞体外扩增的新方法。
低强度脉冲场超声;人脂肪间充质干细胞;细胞增殖;质量检测
低强度脉冲场超声(low-intensity pulsed ultrasound,LIPUS)作为高频、小振幅和脉冲压力波传递机械刺激经皮进入生物组织的一种非侵入性的治疗方式[1],目前被广泛应用于临床治疗。有报道,LIPUS刺激既促进细胞DNA和蛋白质合成[2],又促进细胞对钙的吸收[3]。LIPUS亦可提高细胞活性、细胞因子释放、基因表达、矿化率、Akt信号、钾流动、血管生成、腺苷酸环化酶活性和TGF-β合成的影响等[4-6],对再生医学具有重要意义。
脂肪间充质干细胞(adipose tissue-derived mesenchymal stem cells,ASCs)由于其来源广、且容易获得等特点,已经成为新一代组织工程种子细胞的来源之一。随着近年来干细胞研究领域的快速发展,人们对干细胞生物学的了解越来越深入。人脂肪间充质干细胞(hASCs)因具有低的免疫原性和强大的免疫调节特性,被用于同种异体的细胞移植等,治疗多种疾病和组织损伤[7-8],促进了干细胞移植和再生医学的发展。
LIPUS促进体内组织的修复,那么它应先促进体内细胞增殖然后再作用于损伤部位。然而,以往的研究者未见运用LIPUS对hASCs细胞增殖的研究,且促进细胞增殖机制未明确。本实验中,我们运用LIPUS刺激促进hASCs增殖,增殖后干细胞质量检验符合要求,实验结果为hASCs体外高效扩增和产业化提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源人脂肪间充质干细胞购自广州赛业生物科技有限公司,按标准操作进行培养和传代[9-11]。
1.1.2 仪器和试剂人脂肪间充质干细胞完全培养基(广州赛业生物科技有限公司);0.25%胰酶消化液(Gibco公司);流式抗体CD105-PE、CD73-PE、CD34-PE、CD14-PE、CD45-PE、HLA-DR-PE和HLA-ABC-PE(广州BD公司);支原体培养和鉴定药敏检测试剂盒(中山市天祥电子生物传感器有限公司);实时定量PCR法检试剂盒(中山达安基因检测有限公司);细菌内毒素检查试剂盒(厦门市鲎试剂实验厂有限公司);快速革兰氏染色试剂盒(珠海贝索生物技术有限公司);细胞培养皿、12孔板、50 mL离心管(Grenier公司);手持细胞计数仪(Merck Millipore公司);细胞扩增仪SonaCell (加拿大Intelligent-Nano公司);细胞培养箱(美国Thermo);实时定量PCR仪(瑞士罗氏公司);荧光倒置显微镜(日本Olympus公司)。
1.2 方法
1.2.1 SonaCell细胞扩增仪LIPUS刺激Sona-Cell(Jie Chen提供)超声设备是基于生物学和临床研究的基础上设置的:超声频率为1.5 MHz,脉冲重复频率为1 kHz,脉冲循环为20%。超声平均强度可调整在0~100 mW/cm2。仪器探头通过耦合剂紧贴培养皿底部进行辐照,本实验选用SonaCell细胞扩增仪40 mW/ cm2、50 mW/cm2、60 mW/cm2强度的LIPUS刺激[12]为刺激组,0 mW/cm2强度为对照组。取hASCs第3代细胞2×104个的密度1 mL接种于12孔板相应的孔中,细胞培养24 h后换液,然后使用SonaCell设备的LIPUS刺激部件于细胞培养箱中刺激,5 min/d,连续刺激4d(即细胞培养24 h、48 h、72 h、96 h),第5天收集细胞并计数。细胞倍增时间(population doubling time,PDT)计算方法:t=T/3.32(lgN2-lgN1),T为对数期的持续增长时间,N1和N2分别是对数增长开始和结束的细胞数量。做5组重复实验,对数据进行统计学分析。
1.2.2 细胞计数运用Scepter 2.0手持细胞计数器进行细胞计数,用0.25%胰酶-EDTA消化液消化并收集细胞,用适量的D-PBS重悬细胞,取150µL细胞悬液至1.5 mL离心管中,使用Scepter 2.0计数器的60µL感应探头插入液面以下。根据制造商的说明书进行操作。使用Scepter Software Pro软件进行数据分析,准确测量细胞的直径和每毫升体积内细胞的数量。
1.2.3 细胞形态观察由于细胞生长至第5天(120 h)后,显微镜下观察不好分辨细胞的数量。本实验选择第2次刺激后12 h(即细胞培养60 h),对数生长期初始阶段,将刺激组和对照组细胞置于倒置显微镜下观察,运用Image-Pro Plus软件拍照。
1.2.4 hASCs免疫表型测定通过流式细胞仪测定hASCs刺激组与对照组表面标记物CD105、CD73、CD34、CD14、CD45、HLA-DR和HLA-ABC的表达情况。取消化待测细胞,用D-PBS缓冲液清洗两次。调整细胞浓度为3×105个/mL,加入适量荧光标记的单克隆抗体,室温,避光孵育30 min。再清洗一次,重悬,上机检测,运用BD FACSDIVA软件进行分析。
1.2.5 取第3代刺激后hASCs进行无菌试验、支原体检测、内毒素检测、革兰氏染色、人源特定病毒检测参照《干细胞制剂质量控制及临床前研究指导原则》和《中华人民共和国药典》2010年版三部附录进行[13-14]。
1.3 统计学方法应用SPSS20.0统计学软件包进行数据分析,采用GraphPad Prism6软件作图。首先对数据行正态性检验,若不符合正态分布,通过正态性转换后再下一步处理。组内比较采用One-way ANOVA检验方法,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 LIPUS刺激促进hASCs体外增殖LIPUS刺激hASCs体外增殖,第5天计数结果显示刺激组50 mW/cm2和60 mW/cm2强度都有促进细胞增殖的效果,其中60 mW/cm2刺激强度最明显,细胞倍增时间较对照组缩短,差异均有统计学意义(P<0.05),见图1和图2。

图1 LIPUS刺激后刺激组与对照组细胞计数结果

图2 LIPUS刺激后刺激组与对照组PDT的比较
2.2 细胞形态观察细胞培养60 h(即第2次刺激后12 h)时观察细胞发现刺激组60 mW/cm2孔中间细胞密度明显比边缘多,细胞排列紧密,涡旋式生长;对照组细胞均匀分布(见图3)。
2.3 hASCs细胞表面标志物鉴定LIPUS连续刺激4 d后取第3代hASCs流式细胞仪检测结果显示,刺激组(60 mW/cm2)与对照组细胞表面标志:CD105、CD73和HLA-ABC均高表达;CD14、CD34、CD45和HLA-DR均低表达,见图4。
2.4 无菌试验和支原体检测刺激后的第3代hASCs细胞检测,48 h均无细菌生长,检测结果均为阴性;支原体培养结果均为阴性,见图5。

图3 LIPUS刺激后细胞形态图(×100)

图4 hASCs细胞表面标志物检测
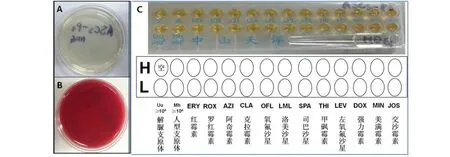
图5 LIPUS刺激后hASCs质量检测图
2.5 细胞内源致病因子的检测刺激后的第3代hASCs细胞进行实时定量PCR检测人源特定病毒包括HBV、HCV、CMV进行DNA表达量,检测结果均为阴性(<5.00E+02 copy)。
2.6 内毒素检测结果刺激后的第3代hASCs细胞通过“鲎试剂灵敏度复核试验”法检测细胞培养上清中内毒素含量,结果均为阴性,λ=0.25 EU/mL,浓度值均<2.83 EU/mL。
2.7 革兰氏染色结果刺激后的第3代hASCs细胞染色,油镜下观察,结果均无革兰氏细菌生长。
3 讨论
干细胞应用于临床治疗和再生医学的潜能已被干细胞研究者们广泛关注。而一个治疗的疗程至少需要1×107个细胞,但从患者、捐赠者身上无法获得足够的hASCs,限制了其应用[15]。有学者探索通过改变各种培养条件,如不同的细胞因子和生长因子,促进体内来源的ASCs体外扩增,目前尚未取得临床相关结论。Jie Chen团队研究发现LIPUS不仅促进人类脐带和骨髓来源的间充质干细胞(MSC)的增长和集落形成,而且促进造血祖干细胞(HSPC)增殖和分化[12],表明可利用LIPUS来获得更多MSC以用于临床[12,16]。
通过研究,笔者发现强度为60 mW/cm2的LIPUS有效促进hASCs的扩增,与对照组比较细胞数量增加约17%,细胞倍增时间缩短为对照组的0.875倍。需要的细胞数量少,且刺激时间短,是有效扩增hASCs的方法之一。本实验存在的不足是未进行更低频率刺激和延长刺激时间研究。
研究显示,LIPUS不仅能促进HSPC亦能促进hASCs有效增殖。LIPUS刺激不改变干细胞培养条件,只改变细胞微环境或能量转换使干细胞增殖,避免外源细胞因子和生长因子等影响。因此,我们的研究结果将可以为干细胞体外快速增殖和产业化提供新途径。下一步我们将验证其增殖的安全性。
[1]Qin L,Fok P,Lu H,et al.Low intensity pulsed ultrasound increases the matrix hardness of the healing tissues at bone-tendon insertion-a partial patellectomy model in rabbits[J].Clin Biomech(Bristol, Avon),2006,21(4):387-394.
[2]He R,Zhou W,Zhang Y,et al.Combination of low-intensity pulsed ultrasound and C3H10T1/2 cells promotes bone-defect healing[J]. Int Orthop,2015,39(11):2181-2189.
[3]Leung KS,Cheung WH,Zhang C,et al.Low intensity pulsed ultrasound stimulates osteogenic activity of human periosteal cells[J]. Clin Orthop Relat Res,2004,(418):253-259.
[4]Hanawa K,Ito K,Aizawa K,et al.Low-intensity pulsed ultrasound induces angiogenesis and ameliorates left ventricular dysfunction in a porcine model of chronic myocardial ischemia[J].PLoS One, 2014,9(8):e104863.
[5]Bernal A,Pérez LM,De Lucas B,et al.Low-Intensity pulsed ultrasound improves the functional properties of cardiac mesoangioblasts [J].Stem Cell Rev,2015,11(6):852-865.
[6]Padilla F,Puts R,Vico L,et al.Stimulation of bone repair with ultrasound:a review of the possible mechanic effects[J].Ultrasonics, 2014,54(5):1125-1145.
[7]dos Santos L,Santos AA,Gonçalves GA,et al.Bone marrow cell therapy prevents infarct expansion and improves border zone remodeling after coronary occlusion in rats[J].Int J Cardiol,2010,145(1):34-39.
[8]Mummery CL,Davis RP,Krieger JE.Challenges in using stem cells for cardiac repair[J].Sci Transl Med,2010,2(27):27ps17.
[9]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[10]Lee RH,Kim B,Choi I,et al.Characterization and expression analysis of mesenchymal stem cells from human bone marrow and adipose tissue[J].Cell Physiol Biochem,2004,14(4-6):311-24.
[11]Kern S,Eichler H,Stoeve J,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24(5):1294-1301.
[12]Xu P,Gul-Uludag H,Ang WT,et al.Low-intensity pulsed ultrasound-mediated stimulation of hematopoietic stem/progenitor cell viability,proliferation and differentiation in vitro[J].Biotechnol Lett, 2012,34(10):1965-1973.
[13]国家卫生计生委办公厅,食品药品监管总局办公厅.卫计委印发干细胞制剂质量控制及临床前研究指导原则(试行)通知[S].2015. http://www.nhfpc.gov.cn/qjjys/s3581/201508/15d0dcf66b734f338c31 f67477136cef.shtml.
[14]国家药典委员会.中华人民共和国药典[M].3版.北京:中国医药科技出版社,2010,附录:IX B-XIII D.
[15]Bernal A,Pérez LM,De Lucas B,et al.Low-Intensity rulsed ultrasound improves the functional properties of cardiac mesoangioblasts [J].Stem Cell Rev,2015,11(6):852-865.
[16]Xing JZ,Yang X,Xu P,et al.Ultrasound-enhanced monoclonal antibody production[J].Ultrasound Med Biol,2012,38(11):1949-1957.
A new method for efficient amplification of human adipose-derived mesenchymal stem cells in vitro.
HUANG Deng-gao1,GAO Yuan-hui2,WANG Shun-lan2,CAO Hui2,ZHENG Lin-lin2,ZHANG Shu-fang2,YU Ping1. 1.Department of Immunology,Xiangya Hospital,Central South University,Changsha 410013,Hunan,CHINA;2.Central Laboratory,Haikou People's Hospital(Affiliated Haikou Hospital of Central South University Xiangya School of Medicine), Haikou 570208,Hainan,CHINA
ObjectiveTo provide a new method for efficient amplification of clinical stem cells in vitro using low-intensity pulsed ultrasound(LIPUS)-stimulated proliferative human adipose-derived stem cells(hASCs).MethodshASCs cells growth was stimulated by LIPUS in vitro;cell counting was performed using a Scepter 2.0 handheld cell counter;cell morphology was observed by inverted fluorescence microscope;human cell surface marker was detected by flow cytometry and the preclinical quality of stem cells was measured.ResultsCells in stimulation group treated with 50 mW/cm2and 60 mW/cm2LIPUS were both promoted in proliferation,but 60 mW/cm2intensity was more effective(P<0.05),of which cell doubling time was significantly shorten compared to that in control group(P< 0.05).There was no changes in cell surface markers of the stimulation group,and stem cell quality testing met the requirements of standard after proliferation.ConclusionLIPUS stimulation may promote effective proliferation of hASCs,and low-intensity pulsed ultrasound may be used as a new method for expansion of stem cells in vitro.
Low-intensity pulsed ultrasound;Human adipose-derived mesenchymal stem cells;Cell proliferation;Quality control
10.3969/j.issn.1003-6350.2017.12.10.023
R329.2+7
A
1003—6350(2017)10—1617—04
2017-02-15)
海南省重大科技项目(编号:2013-SZK-01-039);海南省自然科学基金面上项目(编号:20168317)
张淑芳。E-mail:haikuoyiyuan@163.com;余平。E-mail:yuping1953@sina.com
