KiSS-1和VEGF在涎腺黏液表皮样癌中的表达及其对血管生成的影响
2017-06-06马赛安峰胥爱文王芹刘博
马赛,安峰,胥爱文,王芹,刘博
(河北北方学院附属第一医院口腔科1、病理科2,河北张家口075000)
KiSS-1和VEGF在涎腺黏液表皮样癌中的表达及其对血管生成的影响
马赛1,安峰1,胥爱文1,王芹1,刘博2
(河北北方学院附属第一医院口腔科1、病理科2,河北张家口075000)
目的研究肿瘤转移抑制基因KiSS-1和血管内皮生长因子(VEGF)在涎腺黏液表皮样癌(MEC)组织中的表达情况及其对血管生成的影响。方法选择河北北方学院附属第一医院口腔科2007年6月至2016年6月收治的68例MEC患者为研究对象。应用免疫组织化学SP法检测68例MEC组织、20例正常涎腺组织中KiSS-1和VEGF的表达,统计学比较其在不同临床病理特征的MEC组织中表达阳性率的差异。光镜下计数利用CD105标记的微血管密度(MVD),统计学比较不同临床病理特征的MEC组织MVD值的差异,并观察KiSS-1和VEGF的表达对MEC组织MVD值的影响。结果68例MEC组织中KiSS-1的阳性表达率为38.24%,明显低于正常涎腺组织的70.00%,VEGF的阳性表达率为70.59%,明显高于正常涎腺组织的10.00%,差异均有统计学意义(P<0.05)。KiSS-1的表达与MEC的淋巴结转移和TNM分期相关(P<0.05),VEGF的表达与MEC的病理分级、淋巴结转移和TNM分期相关(P<0.05);KiSS-1阳性组MVD值为(29.50±9.14),明显低于阴性组的(35.24±10.45),VEGF阳性组MVD值为(35.33±10.20),明显高于阴性组的(27.57±8.45),差异均有显著统计学意义(P<0.01);KiSS-1的表达与VEGF表达呈负相关(rs=-0.488,P=0.000)。结论在MEC组织中KiSS-1表达的下调可能促进VEGF的表达,从而促进了MEC组织血管的生成,促进其侵袭和转移。
涎腺;黏液表皮样癌;KiSS-1;血管内皮生长因子;细胞膜糖蛋白;微血管生成
黏液表皮样癌(mucoepidermoid carcinoma,MEC)是涎腺肿瘤当中常见的一类恶性肿瘤。研究发现,各种不同的基因能够通过不同的信号通路影响MEC的发生、发展过程。此外,与其他恶性肿瘤一样,MEC的生长、浸润、转移均离不开肿瘤的新生血管。如果能够更好地了解并有针对性地对这些影响肿瘤生物学活性的关键靶点进行检测和基因治疗,临床上将有望大幅提升对MEC的诊疗水平。肿瘤转移抑制基因(metastasis suppressor gene l,KiSS-1)作为一种转移抑制基因参与肿瘤的迁移、侵袭、转移及血管生成,在肿瘤的发生发展过程中发挥着重要作用,各种原因导致其表达水平下降或缺失,促进了恶性肿瘤的转移,影响预后[1]。血管内皮生长因子(vascular endothelial growth factors,VEGF)是一种已知的促进血管生成的强效因子,它通过促进相邻的血管内皮细胞增殖和转化迁移,促进血管的生成。本研究拟采用免疫组织化学SP法检测MEC组织中KiSS-1、VEGF的表达,比较其在不同临床病理特征的MEC组织中表达阳性率的差异,计数以CD105标记的微血管密度(microvessel density,MVD),探讨KiSS-1、VEGF的表达改变与MEC微血管生成的关系。
1 材料与方法
1.1 材料与试剂选取河北北方学院附属第一医院口腔科2007年6月至2016年6月收治的MEC患者68例为研究对象,以上病例均有完整的临床病理资料,均经手术切除肿瘤,术前均未接受放疗、化疗及免疫治疗等其他治疗,病理标本均由资深病理科医师按照WHO (1991年)涎腺肿瘤组织病理学标准进行诊断分型。同时选取癌旁正常的涎腺组织20例作为对照组。鼠抗人KiSS-1单克隆抗体购自美国Santa Cruz Biotechnology公司,鼠抗人VEGF单克隆抗体购自美国Labvision公司,鼠抗人CD105单克隆抗体购自NeoMarkers公司,免疫组化SP试剂盒购自北京中杉生物技术公司。
1.2 免疫组织化学检测所用标本均由4%甲醛浸泡固定24 h,常规石蜡包埋、切片,并贴附于1%多聚赖氨酸处理后的载玻片上,65℃烤片1 h。免疫组织化学SP法检测按试剂盒上说明的步骤进行。鼠抗人KiSS-1单克隆抗体效价为1:50,鼠抗人VEGF单克隆抗体效价为1:100,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照,用已知阳性标本作为阳性对照。
1.3 结果判定
1.3.1 KiSS-1、VEGF阳性判定方法细胞质被染成棕黄色的细胞为阳性细胞。显微镜下随机选取5个视野,根据每个视野中阳性细胞的百分比和染色程度对标本进行评分:(1)细胞计数:无阳性细胞记0分,<25%为1分,25%~50%为2分,>50%为3分;(2)染色程度:基本不着色为0分,着色淡为1分,着色适中为2分,着色深为3分。以上两项相加,得分>3分认定为阳性,≤3分认定为阴性。
1.3.2 CD105表达阳性的判定标准及标本MVD计数方法血管内皮细胞膜和(或)细胞质被染成棕黄色或棕褐色视为CD105表达阳性。根据Weidner等[2]提出的方法计数标本的MVD值:在显微镜低倍视野下(×10)先选取肿瘤微血管密度较高的区域,再在高倍视野下(×200)计数微血管的数目,每张切片选取5个高倍视野进行记数,取平均值作为该标本的MVD值。
1.4 统计学方法应用SPSS17.0统计软件进行数据分析。计数资料用百分率表示,计量资料以均数±标准差(x-±s)表示,KiSS-1、VEGF阳性表达率比较采用χ2检验,两组间样本均数比较采用t检验,相关性采用Spearman等级相关分析。均以P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中KiSS-1和VEGF的表达比较KiSS-1和VEGF主要表达于MEC组织的细胞质中(见图1~图4),68例标本中KiSS-1阳性表达率明显低于癌旁正常涎腺组织,差异有统计学意义(P<0.05);VEGF阳性表达率明显高于癌旁正常涎腺组织,差异有显著统计学意义(P<0.01),见表1。
图1 MEC组织中KiSS-1的表达情况(SP×400)

图2 MEC组织中VEGF的表达情况(SP×400)

图3 正常涎腺组织中KiSS-1的表达情况(SP×400)

图4 正常涎腺组织中VEGF的表达情况(SP×400)
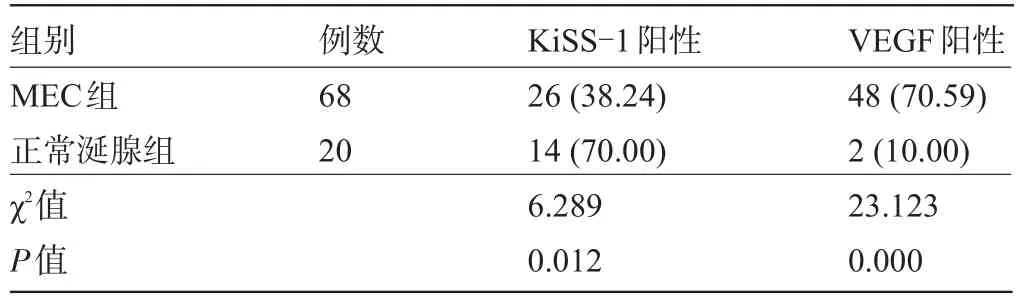
表1 不同组织中KiSS-1和VEGF的表达比较[例(%)]
2.2 不同病理特征的MEC组织中KiSS-1、VEGF的表达及MVD值比较统计分析发现,在68例MEC组织中KiSS-1的表达与肿瘤组织的TNM分期、有无淋巴结转移密切相关;TNM分期Ⅰ+Ⅱ组阳性率高于TNM分期Ⅲ+Ⅳ组,无淋巴结转移组阳性率高于有淋巴结转移组(P<0.05),差异有统计学意义(P< 0.05),而在不同年龄、性别、病变部位、病理分级组当中,KiSS-1的表达差异无统计学意义(P>0.05)。在本研究68例MEC组织中,VEGF的表达在病理分级Ⅰ+Ⅱ组中阳性率低于病理分级Ⅲ组,在TNM分期Ⅰ+Ⅱ组中阳性率低于TNM分期Ⅲ+Ⅳ组,无淋巴结转移组阳性率也低于有淋巴结转移组,差异有统计学意义(P<0.05),在不同年龄、性别、病变部位组当中,VEGF的表达差异无统计学意义(P>0.05),见表2。CD105在血管内皮细胞的细胞膜或细胞质当中阳性染色,呈条索状或环形染色,弥漫分布(见图5)。68例标本中,其阳性表达为100%。病理分级Ⅰ+Ⅱ组MVD值低于病理分级Ⅲ组,TNM分期Ⅰ+Ⅱ组MVD值低于TNM分期Ⅲ+Ⅳ组,无淋巴结转移组MVD值低于有淋巴结转移组,差异均有显著统计学意义(P<0.01),见表2。

图5 MEC组织中CD105的表达情况(SP×200)
2.3 MEC组织中KiSS-1、VEGF表达的相关性及其与MDV的关系统计结果表明,68例标本中Kissl、VEGF共同阳性表达例数为11例,共同阴性表达例数为5例,KiSS-1表达阳性、VEGF表达阴性者15例,KiSS-1表达阴性、VEGF表达阳性者37例,KiSS-1与VEGF的表达呈负相关(rs=-0.488,P=0.000)。KiSS-1阳性组MVD值为(29.50±9.14),其阴性组MVD值为(35.24±10.45),KiSS-1阴性组MVD值高于阳性组,差异有统计学意义(P<0.05)。VEGF阳性组MVD值为(35.33±10.20),其阴性组MVD值为(27.57±8.45),VEGF阳性组MVD值高于阴性组,差异有统计学意义(P<0.01)。

表2 MEC中不同病理特征KiSS-1和VEGF的表达及MVD值比较
3 讨论
涎腺MEC是口腔颌面部常见的一类唾液腺恶性肿瘤,约占涎腺上皮性恶性肿瘤的30%。任何年龄均可发病,其中又以40~60岁为发病高峰,女性多于男性。腮腺、颌下腺、腭腺、磨牙后腺等腺体均可发病,以腮腺多见。因其病灶隐匿,早期无不适症状,病史通常较长。MEC患者根据其发生部位、分化程度、有无转移、治疗方法的选择等方面的差异,其预后也有较大的差异[3-4]。目前临床上对MEC的治疗方法已无大的争议,为了进一步提高临床对MEC的治疗水平,需要临床医师在基因水平上更准确地了解、评估MEC。
KiSS-1基因首先从黑色素瘤细胞株中发现,定位于染色体1q32-q41的一种肿瘤转移抑制基因。KiSS-1抑制肿瘤转移的作用是多元性的。它可通过其基因表达产物-转移素(metastin)与其内源性受体KiSS-1R(亦称GPR54)结合,从而激活ERK信号通路;或激活metastin/AXOR12信号传导通路,产生第二信使DAG和IP3,通过释放IP3促进细胞内释放钙离子,而DAG活化了蛋白激酶C,从而使肿瘤细胞的增殖受到抑制,诱导肿瘤细胞凋亡[5-6]。KiSS-1也可以通过抑制肿瘤血管、淋巴管的生成发挥抗肿瘤的作用[7]。研究发现,KiSS-1基因表达下调或缺失的现象出现在多种上皮来源的恶性肿瘤组织中,且其表达水平与肿瘤的恶性程度、侵袭及转移等因素密切相关,严重影响预后[8-10]。由此推断,KiSS-1基因或许可以作为肿瘤患者早期诊断、判断预后的预测指标。而Kiss1在涎腺MEC组织中的表达及与肿瘤血管生成的关系如何,目前国内外相关研究较少。本研究通过回顾性研究MEC患者的病理切片发现:KiSS-1蛋白在MEC组织中的表达明显低于正常涎腺组织;肿瘤侵犯的范围越广,其阳性表达率也越低;当出现淋巴结转移时,其阳性表达率也随之降低。这说明KiSS-1在MEC当中,同样发挥着抑制肿瘤侵袭、转移的作用,其表达水平可能决定了肿瘤侵袭、转移的能力,或许可以通过检KiSS-1在涎腺MEC当中的表达水平来预测患者预后情况,或者为肿瘤的靶向治疗提供一个理想的分子靶位。
恶性肿瘤发生、发展的过程离不开新生血管的形成,而新生血管形成是一个复杂的、多基因共同参与调控的过程。VEGF是目前公认的促进肿瘤血管生成的关键性因子[11]。VEGF在恶性肿瘤细胞中高表达,促进了血管内皮细胞的增殖、新生血管的形成,为肿瘤的快速发展提供充足的养分,并且增加了肿瘤血运转移的机会[11-13]。本研究结果与以往的研究结论一致,VEGF在MEC组织中的表达明显高于正常涎腺组织,差异有统计学意义(P<0.01)。肿瘤的恶性程度越高、侵袭性越强,VEGF的阳性表达率越高;有淋巴结转移时,其阳性表达率也随之升高。
微血管密度(MVD)被认为是衡量微血管形成的定量指标。它需要用一种特异性的抗原标记血管内皮细胞后,才能在显微镜下计数微血管的数量。CD105是一种同型二聚体的细胞膜糖蛋白,在增殖旺盛的肿瘤组织血管内皮细胞上高表达。由于CD105能够更显著地标记肿瘤组织中新生的微小血管,故人们把CD105视为一种更优质、高效的血管内皮细胞增殖标记物,而根据它染色评估MVD值的方法也被认为能更好地量化肿瘤的MVD[14]。本实验通过标记CD105的方法来检测MEC组织的MVD值,结果显示CD105的阳性表达为100%。CD105-MVD与肿瘤的病理分级、TNM分期、有无淋巴结转移密切相关,差异均有统计学意义(P< 0.01)。CD105-MVD值高,很可能提示MEC的恶性程度高、侵犯范围广、转移能力强、预后较差。
以往研究显示,KiSS-1过表达对肿瘤新生血管的形成有抑制作用。其机制可能是,KiSS-1蛋白的表达抑制了小G蛋白家族RhoA介导的转录因子κβ (NF-κβ)的活性,使VEGF的表达下降,从而抑制新生血管的形成[15-16]。本研究显示,在MEC组织中Kiss1的表达与VEGF的表达呈负相关,结果与以往研究相一致;而KiSS-1阳性组MVD值较阴性组明显降低这一结论进一步印证了KiSS-1具有抑制新生血管生成的作用。以上结果提示,在MEC的发生、发展过程当中,KiSS-1表达的缺失可能直接或间接地促进了VEGF的表达,从而促进了MEC组织新生血管的形成,提高了其侵袭、转移的能力,影响了MEC的生物学活性。
综上所述,KiSS-1低表达、VEGF高表达,并伴有较高MVD值的MEC患者,可能预示着肿瘤侵犯范围广、转移率高,可能临床预后较差。临床上检测KiSS-1、VEGF的表达并计数MVD值,有助于预测涎腺MEC的生物学行为。进一步研究KiSS-1与VEGF之间如何相互作用,在这一过程中是否还有其他因子参与调控及其调控的方式,有望为MEC的治疗、预防其转移提供可靠的基因靶位,为肿瘤的精准化治疗提供科学依据。
[1]Beck BH,Welch DR.The KISS1 metastasis suppressor:a good night kiss for disseminated cancer cells[J].Eur J Cancer,2010,46(7): 1283-1289.
[2]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors [J].Breast Cancer Res Treat,1995,36(2):169-180.
[3]韦存志,蔡德丰,屈进文,等.腮腺黏液表皮样癌单纯手术和术后辅助放化疗疗效和预后因素分析[J].国际肿瘤学杂志,2015,42(10): 726-729.
[4]Xiao CC,Zhan KY,White-Gilbertson SJ,et al.Predictors of nodal metastasis in parotid malignancies:a national cancer data base study of 22,653 patients[J].Otolaryngol Head Neck Surg,2016,154(1): 121-130.
[5]Benjamin H,Welch DR.The KISSl memstasis suppressor:a good night kiss for disseminated cancer cells[J].Eur J Cancer,2010,46 (7):1283-1289.
[6]樊清波,刘红山,秦秉玉,等.Kissl在胃腺癌组织中的表达及其对胃癌细胞增殖和转移的影响[J].中华实验外科杂志,2014,31(3): 489-491.
[7]Kostakis ID,Agrogiannis G,Vaiopoulos AG,et a1.KISS1 expression in colorectal cancer[J].APMIS,2013,121(10):1004-1010.
[8]Liu M,Wang S,Pan L,et al.A new model for predicting nonsentinel lymph node status in Chinese sentinel lymph node positive breast cancer patients[J].PLoS One,2014,9(8):e104117.
[9]Sun YB,Xu S.Expression of KISS1and KISSl R(GPR54)may be used as favorable prognostic markers for patients with non-small cell lung cancer[J].Int J Oneol,2013,43(2):521-530.
[10]Wang H,Jones J,Turner T,et a1.Clinical and biological signifieance of KISSl expression in prostate cancer[J].Am J Pathol,2012,180 (3):1170-1178.
[11]刘敏,李嵩,赵运.人脑血管母细胞瘤中VEGF和bFGF的表达及与血管生成的关系[J].河北医科大学学报,2013,34(1):5-8.
[12]刘秀芳,徐浩.elF-4E与VEGF在卵巢恶性肿瘤组织中的表达及意义[J].中外健康文摘,2013,10(26):54.
[13]安峰,何薇薇,林媛媛,等.涎腺黏液表皮样癌中信号传导和转录激活因子3、血管内皮生长因子的表达及临床意义[J].河北医科大学学报,2015,36(5):540-546.
[14]钱立勇,温媛媛,徐勇飞.CDl05和信号传导及转录活化因子3在人脑胶质瘤组织中的表达及临床意义[J].中华实验外科杂志,2015, 32(12):3173-3175.
[15]Teng Y,Mei Y,Hawthorn L,et al.WASF3 regulates miR-200 inactivation by ZEB1 through suppression of KISS1 leading to increased invasiveness in breast cancer cells[J].Oncogene,2014,33(2): 203-211.
[16]Kiriakidis S,Andreakos E,Monaco C,et a1.VEGF expresson in human macmphages is NF-kappaB-dependent:studies using adenovimses expressing the endogenous NF-kappaB inhibitor lkappaBalpha and a kinase-defective form of the lkappaB kinase 2[J].J Cell Sci, 2003,116(Pt4):665-674.
Expression of KiSS-1 and VEGF in mucoepidermoid carcinoma of salivary glands and its effect on angiogenesis.
MA Sai1,AN Feng1,XU Ai-wen1,WANG Qin1,LIU Bo2.Department of Stomatology1,Department of Pathology2,the First Affiliated Hospital of Hebei North College,Zhangjiakou 075000,Hebei,CHINA
ObjectiveTo investigate the relationship of the expression of tumor metastasis suppressor gene kisspeptin-1(KiSS-1)and vascular endothelial growth factors(VEGF)with angiogenesis in mucoepidermoid carcinoma(MEC)of salivary glands.MethodsA total of 68 MEC patients,who admitted to Department of Stomatology of the First Affiliated Hospital of Hebei North College from June 2007 to June 2016,were chosen as research objects.The expression of KiSS-1 and VEGF was detected with immunohistochemical method(SP)in 68 cases of MEC tissues and 20 cases of normal salivary gland.Statistical method was used to compare the differences of expression positive rates of KiSS-1 and VEGF in different clinical pathological types of MEC.The microvessel density(MVD)was recorded under optical microscope.Statistical method was used to compare the differences of MVD in different clinical pathological types of MEC,and to observe how the expression of KiSS-1 and VEGF affect the MVD in MEC.ResultsThe positive expressions of KiSS-1 in MEC tissues was 38.24%,which was significantly lower than 70.00%in the normal salivary gland group(P<0.05).The positive expressions of VEGF in MEC tissues was 70.59%,which was significantly higher than 10.00%in the normal salivary gland group(P<0.05).The expression of KiSS-1 was correlated with lymph node metastasis and TNM staging(P<0.05);the expression of VEGF was correlated with pathological grade level,lymph node metastasis,TNM staging(P<0.05).The MVD in KiSS-1 positive expression group was(29.50±9.14),which was significantly lower than(35.24±10.45)in KiSS-1 negative expression group(P<0.05);the MVD in VEGF positive expression group was(35.33±10.20),which was significantly higher than(27.57±8.45)in VEGF negative expression group (P<0.01).The expression of KiSS-1 was negatively correlated with VEGF(rs=-0.488,P=0.000).ConclusionThe down-regulation expression of KiSS-1 in MEC of salivary glands may play a role in angiogenesis through increasing the expression of VEGF,thus promote tumor invasion and metastasis.
Salivary glands;Mucoepidermoid carcinoma(MEC);Kisspeptin-1(KiSS-1);Vascular endothelial growth factors(VEGF);Cell membrane glycoprotein;Angiogenesis
10.3969/j.issn.1003-6350.2017.10.003
R736
A
1003—6350(2017)10—1555—05
2016-11-02)
河北省医学科学研究重点课题项目计划项目(编号:20150059);河北省张家口市科学技术研究与发展指导计划项目(编号:1421128D);河北省政府(2015)资助临床医学优秀人才培养和基础课题研究项目(编号:361009)
安峰。E-mail:kq126@126.com
