GGR6浸种处理浓度对沙打旺种子活力及萌发特性的影响
2017-06-06陈士超王猛高永汪季刘宗奇王香张晓伟
陈士超, 王猛, 高永, 汪季†, 刘宗奇, 王香, 张晓伟
(1.内蒙古农业大学沙漠治理学院,010018,呼和浩特;2.乌审旗国营纳林河林场,017300,内蒙古,鄂尔多斯)
GGR6浸种处理浓度对沙打旺种子活力及萌发特性的影响
陈士超1, 王猛1, 高永1, 汪季1†, 刘宗奇1, 王香1, 张晓伟2
(1.内蒙古农业大学沙漠治理学院,010018,呼和浩特;2.乌审旗国营纳林河林场,017300,内蒙古,鄂尔多斯)
利用植物生长调节剂调节植物生长、发育和繁殖,是有效提高植物对逆境适应能力和生产能力的重要手段。为探究植物生长调节剂GGR6对沙打旺种子活力及萌发特性的影响,通过观测不同GGR6浓度(0、50、100、150和200 mg/L)浸种处理下,沙打旺种子活力及萌发特性指标,利用隶属函数法,综合分析筛选出适宜沙打旺种子萌发的GGR6处理浓度。结果表明:1)种子发芽动态呈“单峰型”,GGR6处理提高了种子发芽速度和发芽率,缩短发芽时间;2)处理浓度为100 mg/L以下时,种子活力、发芽势、发芽率、发芽指数、萌发指数和活力指数均随着GGR6浓度升高而升高,且浓度在50~100 mg/L之间,升高最为显著,高于100 mg/L后,各处理之间差异不显著(P>0.05);3)促进沙打旺种子萌发的最佳GGR6作用浓度为100 mg/L。研究对利用植物措施在荒漠化土地治理中,加速植被建设的进程和效果具有重要意义。
沙打旺; GGR6; 种子活力; 萌发特性; 隶属函数法
利用植物生长调节剂调节植物生长、发育和繁殖,增强植物对逆境的适应能力,是有效提高植物生产能力和利用植物措施进行荒漠土地治理生态建设效果的重要手段。GGR6(双吉尔6号植物生长调节剂)是一种易溶、易储和绿色无公害新型高效复合植物生长调节剂,因其具有促使植物生根,并使根系发达,从而提高植物对逆境适应能力和生产能力的效果,在农林生产实践中被逐步推广应用。GGR6能否对植物的生长发育产生作用及其作用的强弱,一方面取决于GGR6本身的特性和受体植物的敏感性,另一方面取决于GGR6在植物体内累积的剂量,而GGR6溶液的浓度对其在植物体内累积的剂量产生直接影响。许多学者曾对GGR6在不同作物上的应用效果进行研究和总结。结果表明,用适宜浓度GGR6浸种、蘸根和叶面喷施等处理,通过调控植物重要酶的活性,有利于促进作物体内营养物质的形成,提高育苗成活率和增强抗性,对其内在质量的提升也有明显效果,从而有利于提高作物的产量和经济产值[1-6]。例如:唐中杰等[3]研究表明,利用适宜浓度的GGR6溶液浸种,能促进棉花根系的发育,增加果枝数、铃重和单株结铃数,并有一定的增产作用,但效果并不显著;王建风等[5]试验表明,用50 mg/L的GGR6溶液浸种24 h,沙棘种子室内萌发时间提前3 d,发芽高峰提前7 d,发芽率提高17%;李沁[7]和薄颖生等[8]研究表明,用20 mg/kg的GGR6溶液浸种,能使油松种子出苗期提前2~3 d,出苗率提高10%~30%,且出苗集中整齐,苗全期提前4~7 d。 但综观已有研究,针对种子处理的应用研究报道,主要集中于农田和经济作物,在生态林营造过程中的应用研究报道,主要集中在栽植和扦插前期的苗木处理,而在生态林(草)营造过程中,进行种子处理的报道极少。
种子发芽期和幼苗生长期是植物生长过程中最重要的2个阶段[9],也是植物发育过程中最敏感和最脆弱的时期[10],决定着一些植物能否成功在逆境中定居[11],并对植物个体生活史、种群增殖、植被的形成及演替有着重要的作用[12]。种子是植物最重要的繁殖材料,利用播种方式进行植被恢复,是生态建设的重要组成部分。
沙打旺(AstragalusadsurgensPall.)系豆科黄芪属多年生植物,具有抗逆性强、成活率高等优良特性[13-14],是我国沙区飞播进行植被恢复的主要物种之一,多年来被广泛应用于半荒漠沙区及黄土高原的水土保持生态建设[15]。针对沙打旺开展GGR6对其种子活力及萌发特性的影响研究,探索最适于沙打旺种子萌发的GGR6作用浓度,对植被恢复与重建过程中,促进沙打旺种子萌发、提高壮苗率、增强其对逆境的抵抗和适应能力、以及加快植被建设的进程和效果,均具有重要意义。
1 材料与方法
1.1 试验材料
试验于2015年5月10日,在内蒙古农业大学生态环境学院水土保持与荒漠化防治实验室进行。选用内蒙古乌审旗国营纳林河林场提供的沙打旺种子为试验材料,种子千粒质量(1.51±0.07) g。GGR6购于中国林业科学研究院ABT研究开发中心。采用上海五一玻璃仪器制造厂生产的玻璃培养皿(90 mm)作为发芽器材。
1.2 试验方法
1.2.1 种子预处理 选取大小均匀一致、无病虫害和籽粒饱满的沙打旺种子,用细砂纸打磨种皮50次,而后用0.1% HgCl2溶液浸泡消毒10 min,再用去离子水冲洗3次,晾干备用。
1.2.2 不同浓度GGR6浸种处理 依据产品使用说明,结合已有文献报道和试验种子的特性,按照等梯度配制不同质量浓度(50、100、150、200 mg/L)的GGR6处理溶液。将预处理后的种子,在环境温度为20 ℃的暗处,用不同浓度GGR6溶液浸种24 h,以蒸馏水处理为对照(CK)。5个处理分别记作CK、G50、G100、G150和G200。
1.2.3 不同处理种子活力及发芽试验 将0.1%BTB琼脂凝胶趁热倒入25个培养皿中,使之呈均匀的薄膜,自然冷却至不烫手。取用上述溶液处理后的种子,每皿50粒,均匀的将胚向下埋于备好的琼脂培养皿中,每个处理重复5次,放入恒温30 ℃培养箱。2 h后记录胚附近出现黄色晕圈的个数,并计算种子活力(SA)[16]。
取用不同浓度GGR6溶液浸种处理后的种子,每皿50粒,均匀的置于铺有2层无菌定量湿润滤纸的培养皿中,分别对应加入10 mL处理液,每个处理重复5次,放入恒温20 ℃、相对湿度80%的光照培养箱中,12 h光照、12 h黑暗交替培养。每日定时通风3次,及时补充各处理所散失的水分,每2 d更换1次滤纸。每日定时观察种子发芽情况,依据国际种子检验规程,有明显的胚根“露白”认定为发芽。统计各个处理的发芽情况,计算其发芽率(GP)、发芽势(GE)、发芽指数(GI)和萌发指数(SI)。从每个处理随机选取5株正常芽苗,测量其胚根及胚轴的总长度,计算种子活力指数(VI)。第10 d结束发芽试验。各指标计算公式如下:
种子活力SA=M/G×100;
发芽势GE=GB/G×100;
日发芽率GD=GF/G×100;
最终发芽率GP=GA/G×100;
发芽指数GI=∑Gt/Dt;
萌发指数SI=1.0N2+0.75N4+0.5N6+0.25N8;
活力指数VI=GI×RL。
式中:SA为种子活力,%;M为黄晕圈个数,个;G为供试种子总数,粒;GE为发芽势,%;GB为发芽进程前1/3时间内发芽种子数,粒;GD为某日当日发芽率,%;GF为当日发芽种子数,粒;GP为最终发芽率,%;GA为发芽种子总数,粒;GI为发芽指数;Gt为t时间内发芽种子数,粒;Dt为相应的发芽时间,d;N2、N4、N6和N8分别为第2、4、6和8 d的种子萌发率,%;SI为萌发指数;VI为活力指数;RL为发芽t时间时胚根及胚轴的总长度,cm。
1.2.4 数据处理与分析 采用Excel 2003进行数据统计处理和作图,用SAS 9.0软件对数据进行单因素方差分析(ONE-WAY ANOVA)。其中,对百分比数据进行平方根反正弦转换后,再进行方差分析,最后用隶属函数法,对不同浓度处理下,各项指标进行综合评价,用以反映不同处理对沙打旺种子活力及萌发产生的综合影响,从而筛选出最适宜沙打旺种子萌发的GGR6处理浓度。具体评价方法是:将各指标的隶属函数值求和后,再求平均值,对最终的均值进行排序,序号越小,说明所对应的GGR6处理越好,反之亦然。各指标隶属函数值按以下公式计算。
若指标与沙打旺种子萌发能力呈正相关,则
X(U)=(X-Xmin)/(Xmax-Xmin);
若指标与沙打旺种子萌发能力呈负相关,则
X(U)=1-(X-Xmin)/(Xmax-Xmin)。
式中:X为指标的实测值;Xmax和Xmin分别指测定值的最大值和最小值。
2 结果与分析
2.1 不同浓度GGR6处理对沙打旺种子活力的影响
种子活力是衡量种子质量的主要指标之一,决定种子迅速、整齐出苗,以及幼苗高产和优质的潜在能力。如图1所示,沙打旺种子活力随着GGR6浓度的升高,而出现逐渐升高的总体趋势。GGR6质量浓度在0、50和100 mg/L处理时,种子活力随着GGR6质量浓度的升高,增幅显著(P<0.05),G100、G50分别较CK增加7.71%和17.91%。当GGR6质量浓度超过100 mg/L时,种子活力基本保持在95.20%±2.81%,且G100、G150和G200之间差异不显著(P>0.05)。说明GGR6质量浓度在100 mg/L以下时,随着浓度的升高,对提高沙打旺种子活力有较大的影响,当质量浓度在100~200 mg/L时,随着处理浓度提高,则对种子活力影响不大。
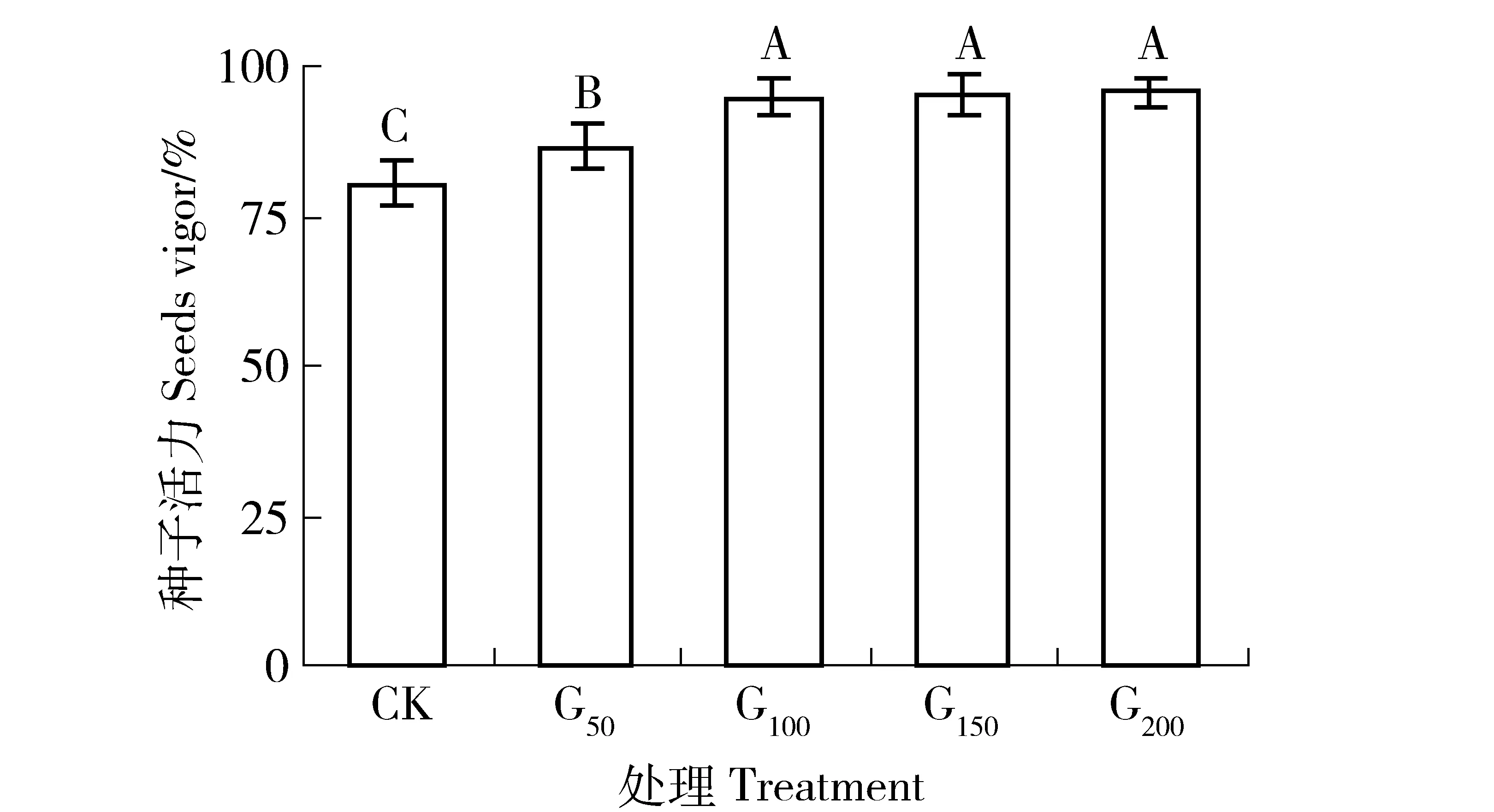
标注字母不同,表示不同处理间差异显著(P<0.05)。下同。Values with different letters are significantly different (P<0.05). CK, G50, G100, G150, and G200 respectively represent the concentration of GGR6 solution is 0, 50,100,150, and 200 mg/L. The same below. 图1 不同浓度GGR6对沙打旺种子活力的影响Fig.1 Effect of GGR6 with different concentrations on the seed vigor of Astragalus adsurgens
2.2 不同浓度GGR6处理对沙打旺种子发芽势的影响
发芽势是衡量种子发芽速度和整齐度的指标。如图2所示,发芽势在各浓度GGR6处理下的顺序是CK
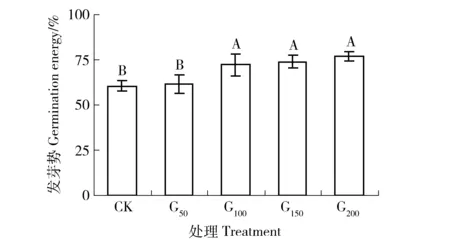
图2 不同浓度GGR6对沙打旺种子发芽势的影响Fig.2 Effect of GGR6 with different concentrations on the germination energy of Astragalus adsurgens
2.3 不同浓度GGR6处理对沙打旺种子发芽率的影响
发芽率是反映种子发芽能力的重要指标,但在发芽率相同时,发芽势越高的种子,说明种子生命力越强。日发芽率可以动态的反映种子在发芽全过程中每日发芽的情况。如图3所示,随着发芽试验的时间进程,发芽动态呈“单峰型”,且总体变化趋势一致,但不同处理变幅差异较大。第1天不同处理,种子日发芽率顺序为CK>G50>G100>G150>G200,G50、G100、G150和G200处理分别较CK下降3.80%、15.19%、29.11%和31.65%;但第2天至第4天,日发芽率顺序较第1天发生了明显变化,与第1天恰好相反,表现为CK
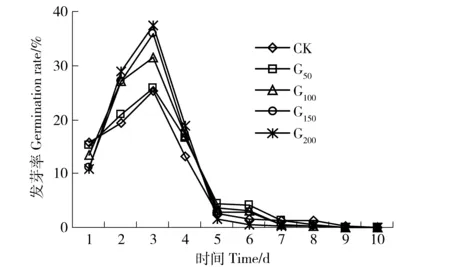
图3 不同浓度GGR6对沙打旺种子日发芽率的影响Fig.3 Effect of GGR6 with different concentrations on the daily germination rate of Astragalus adsurgens
不同发芽日数累积发芽率变化曲线见图4。随着发芽试验的时间进程,种子累积发芽率在前4 d呈近似直线型增加(yCK=19.86x-3.40,R2=0.987 3,n=4,p=0.006 4;yG50=21.54x-6.00,R2=0.993 8,n=4,p=0.003 1;yG100=25.90x-10.90,R2=0.987,n=4,p=0.006 5;yG150=27.64x-15.40,R2=0.984 5,n=4,p=0.007 8;yG200=29.24x-17.30,R2=0.985 7,n=4,p=0.007 2),在发芽前4 d里,处理浓度越大增加的速率越快,G100、G150和G200之间差异不明显,但明显大于CK与G50处理。具有发芽潜力的种子绝大部分在前4 d里均已完成发芽。第4天以后,各处理累计发芽率变化曲线趋于平缓。第10天发芽试验结束后,各处理累计发芽率顺序为CK
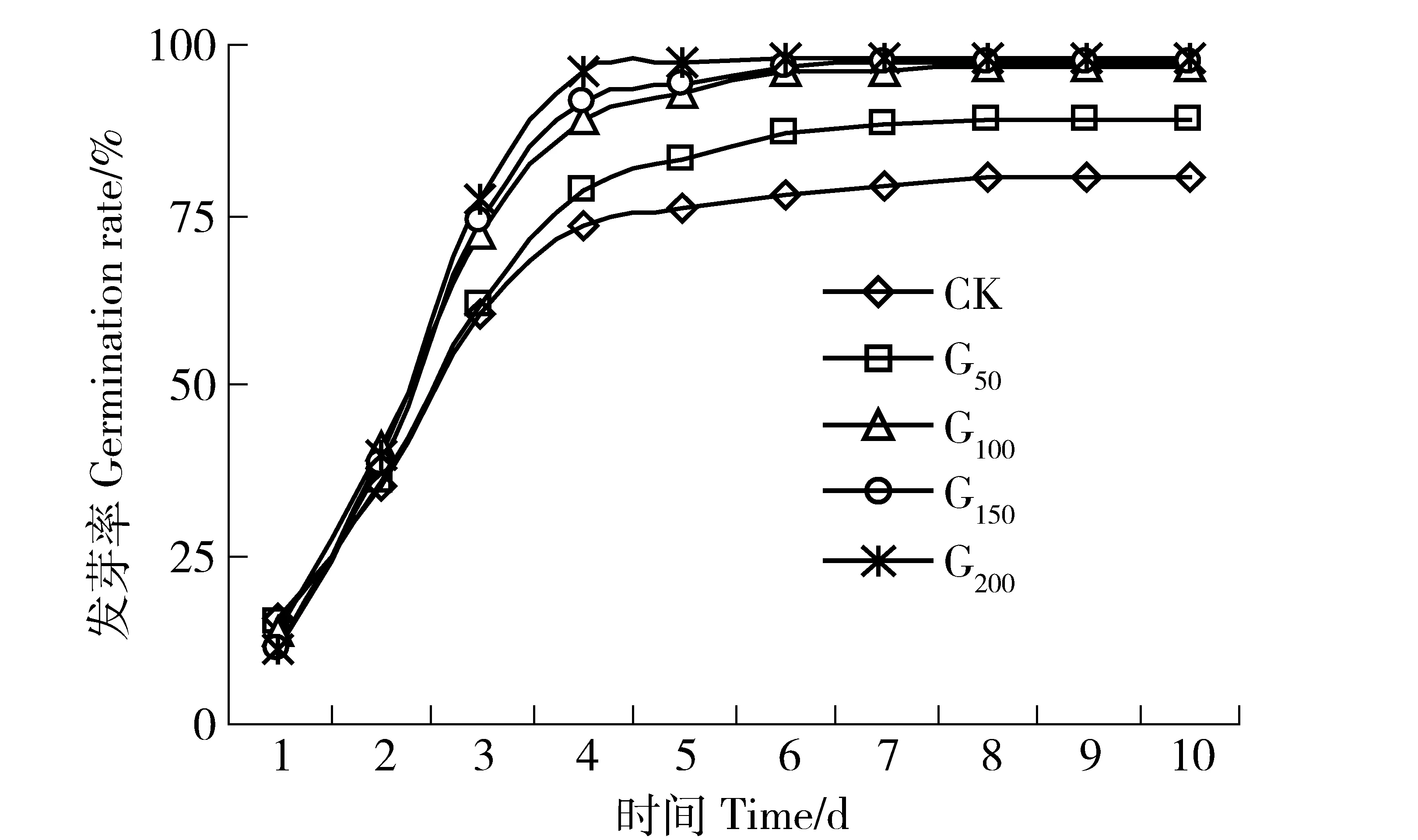
图4 不同浓度GGR6对沙打旺种子累积发芽率的影响Fig.4 Effect of GGR6 with different concentrations on the cumulative germination rate of Astragalus adsurgens
2.4 不同浓度GGR6处理对沙打旺种子发芽指数和萌发指数的影响
发芽指数和萌发指数都是用来衡量种子活力及发芽势的综合性指标。由于种子在失去发芽力之前,已发生劣变,可通过发芽势、发芽指数或萌发指数来反映。如图5和图6所示,GGR6处理可在一定程度上,提高沙打旺种子的发芽指数(10日)和萌发指数。从CK到G50处理,沙打旺种子发芽指数由38.33%提高到40.18%,萌发指数由30.40%提高到35.50%,但促进效果均不显著(P>0.05);当处理质量浓度达到100 mg/L时,发芽指数提高到43.12%,萌发指数较CK处理提高36.84%,促进作用较CK和G50处理均达到显著性水平(P<0.05);处理质量浓度超过100 mg/L时,虽然较CK仍能起到促进作用,但发芽指数随处理浓度的升高,出现缓慢降低的趋势,G100、G150和G200之间差异不显著(P>0.05),说明随处理浓度升高,发芽指数降低不明显;在处理质量浓度100 mg/L以上,虽然随着处理浓度的升高,萌发指数也有所升高,但升高并不明显,G100、G150和G200之间差异不显著(P>0.05)。
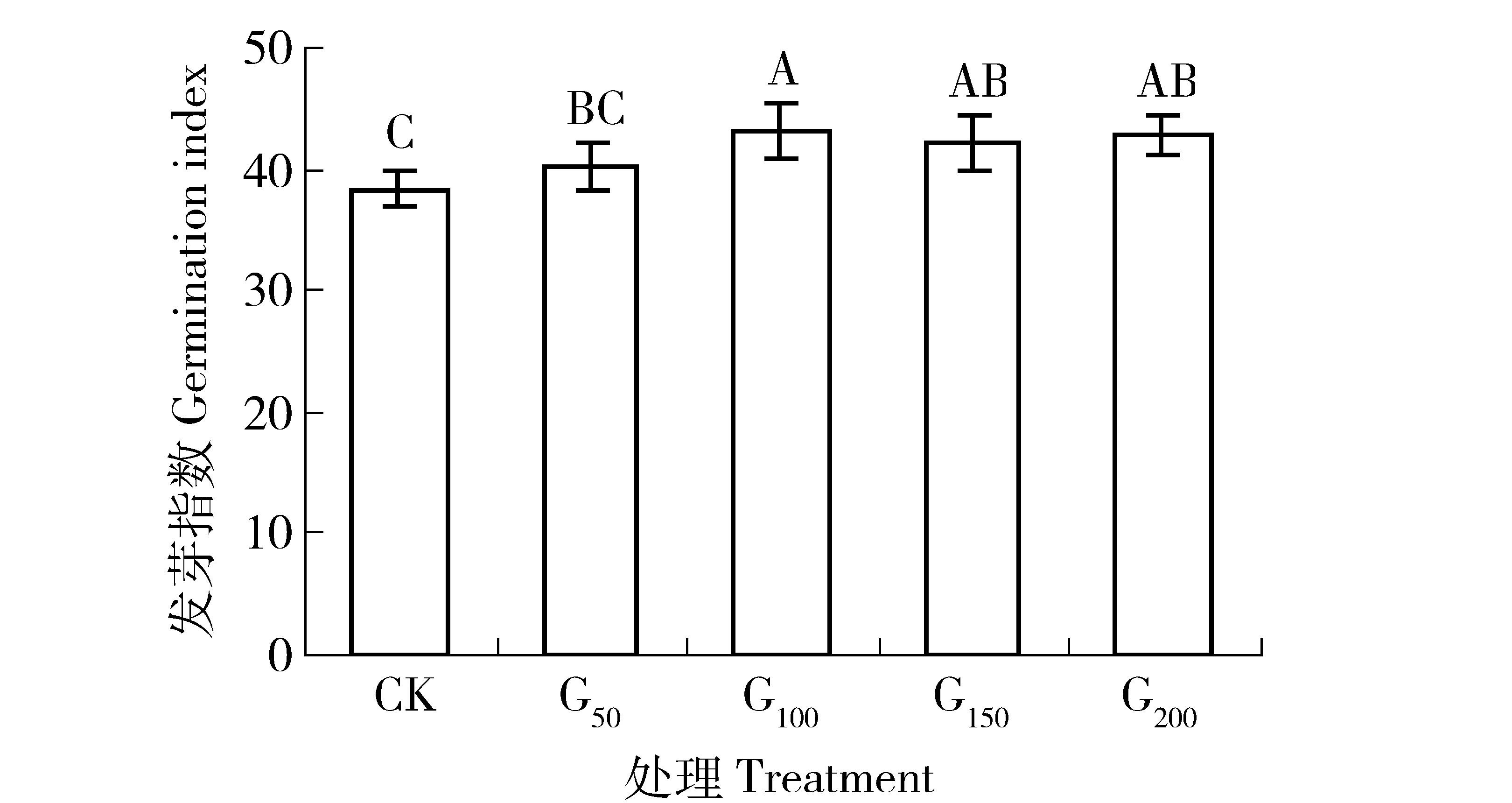
图5 不同浓度GGR6对沙打旺种子发芽指数的影响Fig.5 Effect of GGR6 with different concentrations on the germination index of Astragalus adsurgens
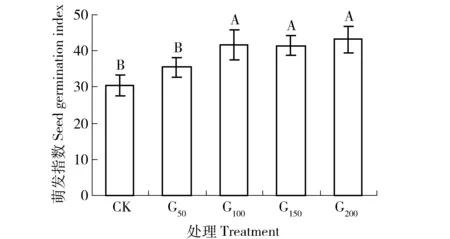
图6 不同浓度GGR6对沙打旺种子萌发指数的影响Fig.6 Effect of GGR6 with different concentrations on the seed germination index of Astragalus adsurgens
2.5 不同浓度GGR6处理对沙打旺种子活力指数的影响
种子活力指数是种子发芽速率和芽苗生长量的综合反映,是衡量种子活力的更好指标,在一定程度上体现着芽苗的生长速度。如图7所示,各处理种子活力指数顺序为CK

图7 不同浓度GGR6对沙打旺种子活力指数的影响Fig.7 Effect of GGR6 with different concentrations on the seed vigor index of Astragalus adsurgens
2.6 不同GGR6处理浓度沙打旺种子活力及萌发特性指标综合评价
种子发芽过程是种子活力及各项萌发指标的综合反映。通过分析不同GGR6处理浓度,对沙打旺种子活力及不同萌发特性指标的影响,且对其影响程度并不一致。单一指标并不能用来代表种子萌发能力的强弱,所以,选择隶属函数法对不同浓度处理下的各项指标进行综合评价,旨在得出最适宜沙打旺种子萌发的GGR6处理浓度。
由不同处理沙打旺种子活力及萌发特性指标综合评价结果(表1)可知,各指标隶属函数平均值顺序为G100>G200>G150>G50>CK,G100处理沙打旺种子活力及萌发特性的各指标隶属函数平均值最大(0.55),CK处理最小(0.45),最大值较最小值高22.23%,即GGR6质量浓度为100 mg/L处理,对沙打旺种子萌发的综合促进作用最佳。
3 讨论
种子活力是衡量种子质量的主要指标之一,发芽率、发芽势、发芽指数、活力指数和萌发指数等发芽指标是反映种子萌发特性的最直接指标,也是反映种子活力变化的可靠指标。研究结果表明,沙打旺种子日发芽动态呈“单峰型”,GGR6浸种可提高种子发芽速度和发芽率,缩短发芽进程。这与王建风等[5]得出的GGR6浸种可使沙棘种子萌发时间和发芽高峰提前和发芽率提高的结论基本一致,也与宋晓斌等[4]得出的用适宜浓度的GGR6浸种,可使油松种子提前发芽、指数增长期提前、种子全部发芽的时间提前的结论类似。但第1天种子日发芽率随GGR6处理浓度升高,呈下降趋势,原因可能为:其一,未饱和溶液渗透势随溶液浓度提高而降低,随GGR6浓度增大,渗透势逐渐减小,从而使种子吸水的难度逐渐增大,降低种子吸水的速率,较高浓度的GGR6溶液使种子不能及时具备萌发所需的水分条件,从而使萌发延迟。其二,随GGR6处理浓度增大,种子吸水速率降低,会相应降低种子对GGR6的吸收速率;所以,高浓度GGR6溶液处理下的种子,在发芽试验的第1天所吸收的GGR6剂量较小,GGR6发挥的作用也比较微弱,种子萌发的实际限制因子是吸水量,第2天至第4天,种子日发芽率随GGR6处理浓度提高,显著升高,各处理日发芽率均在第3天达到最高。说明种子通过前期吸水在第2天以后,水分已经不再是种子萌发的主要限制因子,伴随种子吸水,而被吸收的GGR6在种子内逐渐累积,并发挥作用,通过激发种子内源激素和酶活性、促进种子解除休眠、破坏抑制种子萌发的活性物质和加快细胞分裂速度等作用,增强了具有活力种子的萌发能力[2,17],使在一般条件下不具备发芽能力的种子得以萌发,另一方面提高了种子的萌发速度,并在第3天达到最佳作用效果。
笔者研究表明:在GGR6处理质量浓度为0~100 mg/L之间时,沙打旺种子活力、发芽势、发芽率、发芽指数、萌发指数及活力指数,均随着GGR6处理浓度升高而升高;处理质量浓度在50~100 mg/L之间时,各指标值显著升高,而当处理质量浓度超过100 mg/L后,随处理浓度继续升高,对种子活力、发芽势、发芽率和活力指数的促进作用不明显,相反发芽指数和萌发指数有所下降。其原因可能是:在较低的GGR6浓度处理下,随着GGR6在种子内的逐渐累积,对种子萌发各项指标表现出持续的促进作用,而在较高浓度处理下,GGR6在种子内部的大量累积,使得种子内部渗透压快速降低,导致种子内源有机酸、生物碱等萌发抑制物质,以及自身新陈代谢过程中酶解产生的萌发抑制物质很难排出[18],从而对种子萌发产生了抑制作用;相反,高浓度GGR6溶液具有较低的渗透势,种子吸水速率的降低,会相应降低对GGR6的吸收速率,在非充分浸种条件下,高浓度GGR6溶液处理下的种子所吸收的GGR6剂量实际值偏低,从而使得其发挥的作用有限。关于不同浓度下、不同浸种时间对种子萌发产生的影响有待深入研究。
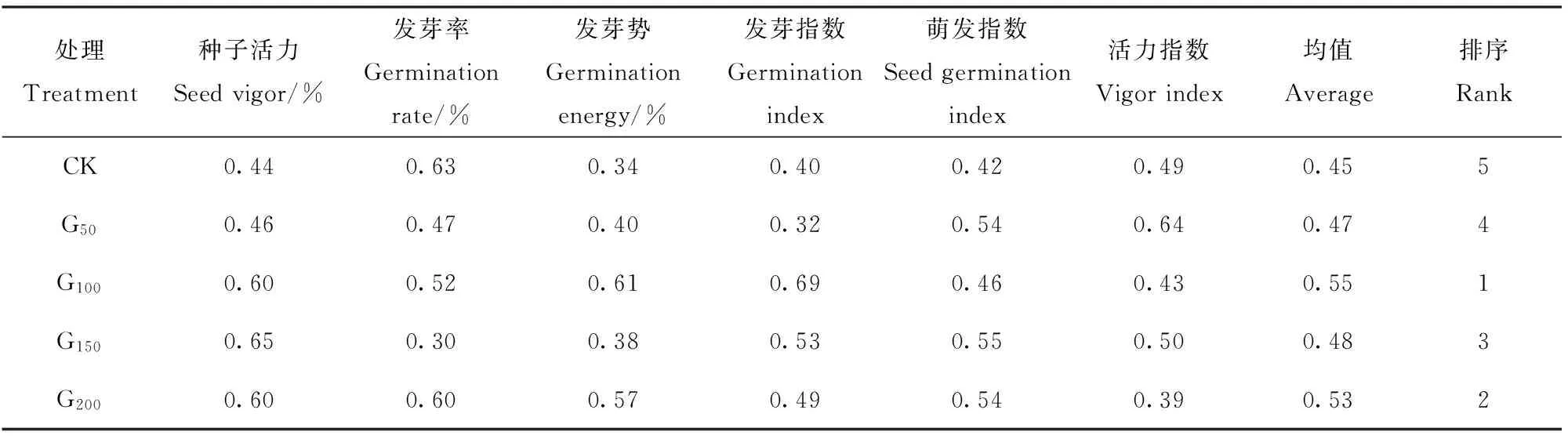
表1 不同GGR6处理浓度沙打旺种子活力及萌发特性指标综合评价结果
大量研究表明,不同种子的发芽最适GGR6处理浓度有所不同。例如:赵雪等[19]报道了在GGR6处理质量浓度为10 mg/L时,沙地海岸松种子发芽率最高;张桂阁等[2]研究表明,用GGR6溶液处理玉米种子(30 mg/L拌种+拔节期20 mg/L喷施一次)的处理效果最好。笔者研究也与已有许多研究结果有所不同。这主要是因为种子萌发能力是种子内在特性与各种外在因子相互作用,而表现出来的综合外在反映,并受多种因素的影响。如不同研究者设计的试验条件不同、种子本身的生物学特性不同、不同生物学特性的种子对外界因子的响应程度不同等[20]。
笔者测试的种子活力是具有生命力或潜在生命力的种子数,有些种子虽然具有潜在生命力,但因活力水平较低,而导致在一般条件下不能发芽,当外界条件发生变化时,可能使得种子潜在生命力得到激发,从而得以萌发;发芽率是测试种子实际发芽数的指标,发芽势是测试种子发芽速率快慢和整齐度的指标,有些种子虽然具备发芽能力,具有很高的发芽率,但由于活力水平大小不一,导致发芽速度和幼苗生长状况参差不齐;在一定程度上,发芽率高,说明具有活力的种子多,发芽率低说明具有活力的种子少,但在一般条件下的发芽率,又不能说明在特定条件下、受到激发后才能发芽的种子数;当种子良莠差别很大时,其种子活力可能存在极高和极低两个极端,活力极高的种子在前期快速发芽,使得发芽势指标提高,但由于存在较多不具备发芽能力的种子,实际发芽率却很低;发芽指数在一定程度上可动态反映在不同的规定时间内,种子发芽的平均速率,同时,在一定程度上反映种子在失去发芽力之前,已发生劣变的数量以及相对劣变的程度,劣变程度不同,受到不同外界条件激发后,其发芽速度和发芽率也会有不同变化;活力指数不但与发芽指数有关,还与芽苗生长的速度有关,由于种子萌发与芽苗生长受不同生理机制的影响(如种子吸水与幼苗吸水的机理就存在不同),导致适宜种子萌发的环境条件与适宜幼苗生长的环境条件往往不一致,所以发芽指数也就不能用来衡量活力指数。说明不同发芽指标之间存在密切联系,但又各有侧重;所以利用单一种子萌发指标,对GGR6的响应程度来衡量GGR6对种子萌发能力的综合作用是不客观的,即使是同一植物的种子,其发芽能力的强弱也与种子自身特性变异程度、外界环境因素等多种作用有关。所以,笔者采用隶属函数法,评价不同处理浓度对沙打旺种子萌发的综合促进作用,结果表明浓度为100 mg/L处理,其效果最佳。
4 结论
在GGR6浸种处理质量浓度为0~200 mg/L之间,沙打旺种子日发芽动态呈“单峰型”,并且提高种子发芽速度和发芽率,提前发芽进程。
在GGR6浸种处理质量浓度为0~100 mg/L之间,沙打旺种子活力、发芽势、发芽率、活力指数、发芽指数和萌发指数,均随着GGR6处理浓度升高而升高,处理质量浓度在50~100 mg/L之间时,各指标值显著升高;处理质量浓度超过100 mg/L后,随处理浓度继续升高,各指标值变化不明显。
在室内控制试验条件下,GGR6浸种处理质量浓度为100 mg/L时,沙打旺种子活力及萌发特性各指标隶属函数平均值最大(0.55),对沙打旺种子萌发的综合促进作用最佳。
[1] 周乾,王可,樊芬,等.生根粉在大田作物上的应用效果[J].作物研究,2014,28 (4):447. ZHOU Qian, WANG Ke, FAN Fen, et al. Application effect of rooting powder on field crops[J]. Crop Research, 2014, 28(4):447.
[2] 张桂阁,侯廷荣,吴明泉,等.植物生长调节剂GGR6号在夏玉米生产上的应用效果研究[J].玉米科学,2004,12(S1):105. ZHANG Guige, HOU Tingrong, WU Mingquan, et al. Study on the effect of plant growth regulator GGR6 using on Summer Corn[J]. Journal of Maize Sciences, 2004, 12(S1):105.
[3] 唐中杰,房卫平,孙玉堂.GGR6号在棉花上应用效果研究[J].中国农学通报, 2006,22(1):182. TANG Zhongjie, FANG Weiping, SUN Yutang. Studies on the effect of GGR6 on cotton[J]. Chinese Agricultural Science Bulletin,2006, 22(1):182.
[4] 宋晓斌,曹支敏,张学武,等.双吉尔-GGR6对油松育苗的作用[J].西北农林科技大学学报(自然科学版),2004,32(10):107. SONG Xiaobin, CAO Zhimin, ZHANG Xuewu, et al. Application of GGR6 to seedling ofPinustabulaeformisCarr. [J]. Journal of Northwest A&F University (Natural Science Edition), 2004, 32(10):107.
[5] 王建风,黄生福.植物生长调节剂GGR6在沙棘培育中的应用试验[J].安徽农业科学,2009,37(6):2477. WANG Jianfeng, HUANG Shengfu. Study on application of plant growth regulator GGR6 in sea buckthorn cultivation[J]. Journal of Anhui Agri. Sci, 2009, 37(6):2477.
[6] 何茜,李吉跃,齐涛.GGR6号和“施丰乐”溶液浸根对银杏生长、光合特性及水分利用效率的影响[J].北京林业大学学报,2006,28(S1):55. HE Qian, LI Jiyue, QI Tao. Influence of phytohormone “Shifengle” and GGR6 on the growth, photosynthetic characteristics and water use efficiency in seedlings ofGinkgobiloba[J]. Journal of Beijing Forestry University, 2006, 28(S1):55.
[7] 李沁.植物生长调节剂在油松育苗上的应用[J].东北林业大学学报,2009,37(8):13. LI Qin. Application of plant growth regulator toPinustabulaeformisseedlings[J]. Journal of Northeast Forestry University, 2009, 37(8):13.
[8] 薄颖生,韩恩贤,杨培华,等.GGR6号在油松容器育苗上的应用[J].水土保持研究,2005,12(6):23. BO Yingsheng, HAN Enxian, YANG Peihua, et al. Application of growth regulators of plant on growing seedlings ofPinustablaefomisCarr with container[J]. Research of Soil and Water Conservation, 2005, 12(6):23.
[9] TOBE K, LI X M, OMASA K. Seed germination and radicle growth of a halophyte,Kalidiumcaspicum(Chenopodiaceae)[J].Annals of Botany,2000, 85(3):391.
[10] RAJJOU L, DUVAL M, GALLARDO K, et al. Seed germination and vigor[J]. Annu Rev Plant Biol, 2012, 63:507.
[11] UNGAR I. A. Ecophysiology of vascular halophytes[M].Boca Raton: CRC Press, 1991:9.
[12] 张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106. ZHANG Yong, XUE Lingui, GAO Tianpeng, et al. Research advance on seed germination of desert plants[J]. Journal of Desert Research, 2005, 25(1):106.
[13] 徐洪雨,王英宇,宋桂龙,等.华北土石山区公路边坡常见植物根系地下分布特征[J].中国水土保持科学,2013,11(2):51. XU Hongyu, WANG Yingyu, SONG Guilong, et al. Characteristics of root system distribution of common plants on freeway slopes in earthy-rocky mountain area of North China[J]. Science of Soil and Water Conservation, 2013, 11(2):51.
[14] 赵广东,王兵,苏铁成,等.煤矸石山废弃地不同植物复垦措施及其对土壤化学性质的影响[J].中国水土保持科学,2005,3(2):65. ZHAO Guangdong, WANG Bing, SU Tiecheng, et al. Growth of different plant reclamation measures on plant growth and the effect on soil chemical properties in gangue waste land[J]. Science of Soil and Water Conservation, 2005, 3(2):65.
[15] 徐炳成,山仑,李凤民.苜蓿与沙打旺苗期生长和水分利用对土壤水分变化的反应[J].应用生态学报,2005,16(12):2328. XU Bingshan, SHAN Lun, LI Fengmin. Responses ofMedicagosativaandAstragalusadsurgensseedlings growth and water use to soil moisture regime[J]. Chinese Journal of Applied Ecology, 2005, 16(12):2328.
[16] 张志良,翟伟菩.植物生理学实验指导[M].北京:高等教育出版社,2002:206. ZHANG Zhiliang, ZHAI Weipu. The experiment guidebook of plant physiology. Beijing: Higher Education Press, 2002:206.
[17] 贾娟,姚延寿,史敏华,等.生根剂促进槭树植物扦插繁殖的研究进展[J].西北林学院学报,2010,25(4):107. JIA Juan, YAO Yanshou, SHI Minhua, et al. Advances in the researches of rooting agent in cutting propagation of Aceraceae plants[J]. Journal of Northwest A&F University,2010, 25(4):107.
[18] 孙佳,郭江帆,魏朔南.植物种子萌发抑制物研究概述[J].种子, 2012, 31(4):57. SUN Jia, GUO Jiangfan, WEI Shuonan. Overview on inhibitors of plant seed germination[J]. Seed, 2012, 31(4):57.
[19] 赵雪,李俊清,王丽辉,等.引种沙地海岸松(PinuspinasterAit.)幼苗对环境因子的响应[J].生态学报,2008,28(9):4162. ZHAO Xue, LI Junqing, WANG Lihui, et al. Response of the introduced seedling ofPinuspinasterAit.to the environmental factors in Shandong and Zhejiang provinces[J]. Acta Ecologica Sinica, 2008, 28(9):4162.
[20] 杨景宁,王彦荣.PEG模拟干旱胁迫对四种荒漠植物种子萌发的影响[J].草业学报, 2012,21(6):23. YANG Jingning, WANG Yanrong. Effects of drought stress simulated by PEG on seed germination of four desert plant species[J]. Acta Pratacultueae Sinica, 2012, 21(6):23.
Influences of the different GGR6concentrations on the seed vigor and germination characteristics ofAstragalusadsurgens
CHEN Shichao1, WANG Meng1, GAO Yong1, WANG Ji1, LIU Zongqi1,WANG Xiang1, ZHANG Xiaowei2
(1.College of Desert Control Science and Engineering, Inner Mongolia Agricultural University, 010018, Hohhot, Inner Mongolia, China; 2.Wushen Banner State-run Nalinhe Forest Farm, 017300, Ordos, Inner Mongolia, China)
[Background] Regulator for growth, development and reproduction of the plant, is an important means to improve adaptability and production capacity, and has a key impact on ecological construction of desert land management using plant measures. The seed germination ability affects directly the growth, reproduction and production of plants, determines the success of some plants settled in the adversity, and has a critical effect on the life history, population growth, the formation and succession of plants.Astragalusadsurgensis one of the main species for soil and water conservation and ecological construction in the Loess Plateau of China. Understanding the effects of plant growth regulators on seed vigor and germination characteristics ofA.adsurgensis for improving adaptive ability to adverse environment and for increasing vegetative coverage during restoration and reconstruction of vegetation. [Methods] The concentrations of 0, 50, 100, 150 and 200 mg/L plant growth regulator GGR6solution, respectively at 20 ℃ (G50, G100, G150, and G200) and dark conditions (CK) were designed to soakA.adsurgensseed for 24 hours, and the influences of GGR6on seed vigor and germination characteristics ofA.adsurgenswere observed. Seed viability test (a constant temperature of 30 ℃) and germination test (constant temperature, relative humidity of 80%, 12 h light and 12 h darkness alternating) were conducted in the artificial climate chamber for the observation of seed vigor, germination energy, germination rate, germination index and vigor index with five replications of each treatment. Excel and SAS 9.0 statistical software were used for data processing, mapping and variance analysis. The suitable GGR6concentration forA.adsurgensseed germination was selected by membership function method. [Results] 1) The seed germination ofA.adsurgenswas “unimodal type”, and the same tendency presented in the different treatments. The order of seed germination rate was CK > G50> G100> G150> G200in the first day, and peak value of germination rate (2 to 4 days) was CK < G50< G100< G150< G200. 2) Seed vigor, germination energy, germination rate, germination index, and vigor index ofA.adsurgensincreased with increasing concentration of GGR6when GGR6concentration was below 100 mg/L. The effects of the treatments on seed vigor, germination energy, germination rate, and vigor index were not obvious when the GGR6concentration was higher than that of 100 mg/L, and germination index also decreased. [Conclusions] 1) GGR6solution improved the speed and rate of seed germination ofA.adsurgens(Germination process advanced 1 day). 2) Each value increased significantly (P< 0.05) when the concentration were 50-100 mg/L. 3) The order of seed vigor and germination characteristic indexes based on the average values of membership function was G100> G200> G150> G50> CK. The optimal GGR6concentration was 100 mg/L for seed germination ofA.adsurgens.
Astragalusadsurgens; GGR6; seed vigor; germination characteristics; membership function method
2016-09-13
2017-02-10
陈士超(1977—),男,博士,讲师。主要研究方向:水土保持与荒漠化防治。Email:chenshichao2005@126.com
†通信作者简介: 汪季(1957—),男,博士,教授,博士生导师。主要研究方向:水土保持与荒漠化防治。Email:wangji1957@163.com
S714.6
A
2096-2673(2017)02-0070-09
10.16843/j.sswc.2017.02.009
项目名称: 林业公益性行业科研专项“风积沙产业化利用及其迹地植被营建技术研究”(201204205)
