碳青霉烯类耐药肠杆菌科细菌碳青霉烯及头孢菌素类抗生素耐药机制
2017-06-06孙恒彪陈佑明潘祖汉
孙恒彪,陈佑明,尤 旭,潘祖汉,肖 刚,明 月
(1 南方医科大学第三附属医院,广东 广州 510630; 2 南方医科大学检验系,广东 广州 510630)
·论著·
碳青霉烯类耐药肠杆菌科细菌碳青霉烯及头孢菌素类抗生素耐药机制
孙恒彪1,陈佑明1,尤 旭1,潘祖汉1,肖 刚1,明 月2
(1 南方医科大学第三附属医院,广东 广州 510630; 2 南方医科大学检验系,广东 广州 510630)
目的 研究碳青霉烯类耐药肠杆菌科细菌(CRE)对碳青霉烯及头孢菌素类抗生素耐药机制,为临床治疗CRE感染及医院感染的控制提供分子流行病学依据。方法 收集2014—2015年临床送检各类标本分离的细菌,使用Microscan Walkaway 40 plus进行细菌鉴定和药敏试验,对分离的CRE进行常见碳青霉烯酶的编码基因(blaNDM-1及blaKPC-2)和超广谱β-内酰胺酶编码基因(blaTEM、blaSHV、blaCTX-M-1-like、blaCTX-M-2-like、blaCTX-M-8-like及blaCTX-M-9-like)的检测,同时检测细菌多重耐药相关的I类整合子编码基因blainT-1。结果 2014—2015年共分离7株CRE,检出率为0.30%,1~6号菌株为肺炎克雷伯菌,7号菌株为弗劳地柠檬酸杆菌,7株菌株对β-内酰胺酶抑制剂复合制剂、头孢菌素类、头霉素类、碳青霉烯类抗生素均耐药,3株菌对阿米卡星及四环素敏感,2株菌对复方磺胺甲口恶唑敏感。3株菌检出blaNDM-1,2株检出blaKPC-2,5株检出blaTEM,7株均可检出blaSHV,1株检出blaCTX-M-1-like,4株检出blaCTX-M-9-like,5株检出blainT-1,未检出基因blaCTX-M-2-like及blaCTX-M-8-like。结论blaNDM-1及blaKPC-2是导致7株CRE对碳青霉烯类抗生素耐药的重要机制,blaTEM、blaSHV及blaCTX-M-9-like是导致对头孢菌素类抗生素耐药的主要原因,blainT-1在CRE多重耐药及耐药基因传播中发挥着巨大的作用。
碳青霉烯类耐药; 肠杆菌科细菌; 头孢菌素; 碳青霉烯酶; 碳青霉烯类抗生素; 多重耐药; CRE
[Chin J Infect Control,2017,16(5):404-408]
肠杆菌科细菌广泛存在于自然环境中,是人类肠道定植的最大一类正常菌群,同时也是临床最常见的病原菌,当肠道内菌群因外伤、机体免疫力下降、侵入性操作等出现移位时,可引起皮肤伤口感染、肺炎、泌尿系统感染、血流感染等。头孢菌素类抗生素是用于治疗肠杆菌科细菌感染的常用药物,产超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)是导致肠杆菌科细菌对头孢菌素类抗生素耐药的主要机制[1]。碳青霉烯类抗生素是治疗肠杆菌科细菌重症感染的一线抗菌药物,但近年来出现了产碳青霉烯酶肠杆菌科细菌,这类细菌往往对包括碳青霉烯类在内的多种不同类型抗菌药物耐药,从而导致临床治疗失败,严重威胁患者生命[2-3]。本文通过对2014—2015年分离到的碳青霉烯类耐药肠杆菌科细菌(carbapenem - resistant Enterobacteriaceae, CRE)的ESBLs、碳青霉烯酶、I类整合子检测,了解CRE对头孢菌素类及碳青霉烯类抗生素耐药机制和整合子在CRE中携带情况,为CRE的临床治疗及医院感染控制提供分子流行病学依据。
1 材料与方法
1.1 菌株来源 2014—2015年门诊及住院患者送检各类标本按照《全国临床检验操作规程》对送检培养标本进行细菌培养及抗菌药物敏感性试验,收集分离的CRE。
1.2 菌株鉴定及药敏试验 使用MicroScan Walkaway 40 plus全自动微生物鉴定药敏分析仪对分离菌株进行鉴定和药物敏感性分析。参考美国临床实验室标准化协会(CLSI)2014年版进行抗菌药物敏感性判定。质控菌株为大肠埃希菌 ATCC 25922、铜绿假单胞菌 ATCC 27853,均购自广东省临床检验中心。
1.3 CRE判定标准 肠杆菌科细菌对亚胺培南、厄他培南及美罗培南中任何一种药物耐药即判定为CRE,所有CRE均采用K-B法对这3种药物进行复核。
1.4 模板DNA提取 采用煮沸法提取细菌基因组全部DNA,挑取经分纯培养过夜菌株至双蒸水中,100℃加热煮沸15 min,冷却至室温后13 000 rpm离心10 min,取上清液作为PCR反应模板,-20℃保存备用。
1.5 引物设计 登录GenBank查找全基因组碱基序列,使用Primer premier 5.0版软件设计引物。引物序列均由上海生工生物工程有限公司合成。引物见表1。

表1 9种耐药基因引物序列
1.6 基因检测 9种耐药基因反应体系均为:总体积20 μL,其中2×PCR Master Mix 10 μL,上下游引物各0.6 μL,模板2 μL,双蒸水6.8 μL。blaNDM-1、blaKPC-2、blaTEM、blaSHV及blainT-1PCR反应条件为:94℃预变性5 min,然后94℃变性30 s,56℃退火30 s,72℃延伸45 s, 30个循环,最后72℃延伸5 min。blaCTX-M-1-like、blaCTX-M-2-like、blaCTX-M-8-like及blaCTX-M-9-like PCR反应的退火为61℃,其他反应条件与上述基因PCR反应条件相同。PCR扩增产物采用1%的琼脂糖凝胶电泳,使用凝胶成像系统拍照。
2 结果
2.1 药敏结果 2014—2015年共分离到肠杆菌科细菌2 315株,其中7株为CRE,检出率为0.30%。1~6号CRE为肺炎克雷伯菌,7号菌株为弗劳地柠檬酸杆菌,7株菌对β-内酰胺酶抑制剂复合制剂、头孢菌素类、头霉素类、碳青霉烯类均耐药,3株菌对阿米卡星及四环素敏感,2株菌对复方磺胺甲口恶唑敏感,1株菌对氨曲南敏感。
2.2 耐药基因检测结果 3株菌检出blaNDM-1,2株检出blaKPC-2,5株可检出blaTEM,7株均可检出blaSHV,1株检出blaCTX-M-1-like,4株检出blaCTX-M-9-like,5株检出blainT-1,未检出耐药基因blaCTX-M-2-like和blaCTX-M-8-like。见图1~2及表2。
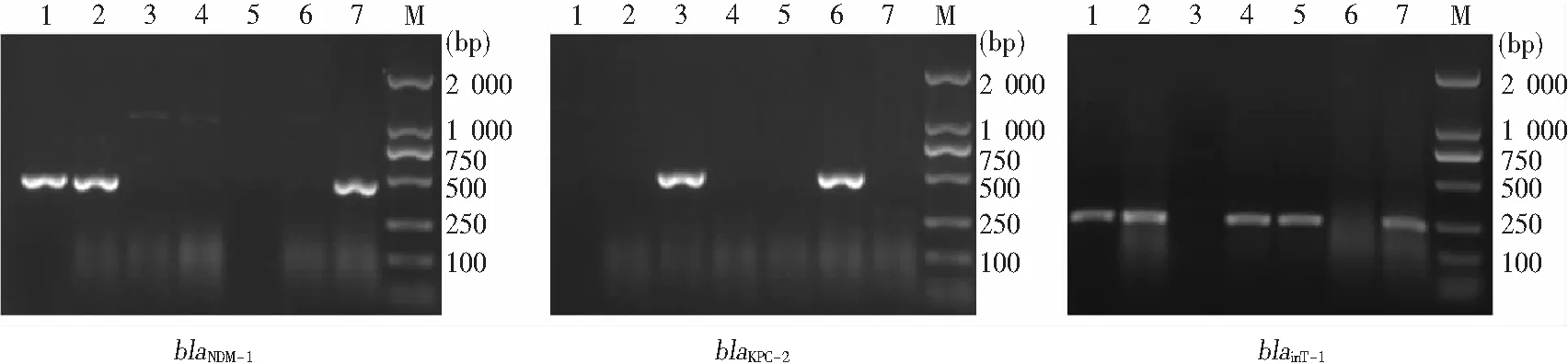
M: Marker; 1-7:为1-7号CRE菌株

M: Marker; 1-7:为1-7号CRE菌株
Table 2 Detection results of drug-resistant genes of 7 CRE strains
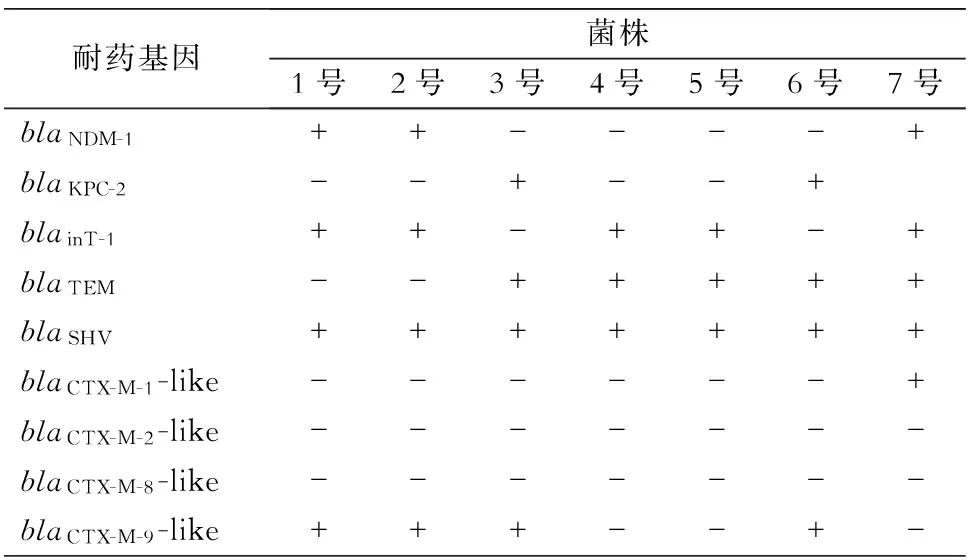
耐药基因菌株1号2号3号4号5号6号7号blaNDM-1++----+blaKPC-2--+--+blainT-1++-++-+blaTEM--+++++blaSHV+++++++blaCTX-M-1-like------+blaCTX-M-2-like-------blaCTX-M-8-like-------blaCTX-M-9-like+++--+-
+:检出;-:未检出
3 讨论
近年来碳青霉烯类抗生素在临床的使用量不断增加,这可能是导致CRE产生的原因之一,2014年中国细菌耐药监测网(CHINET)数据显示,35 788株肠杆菌科细菌对亚胺培南、美罗培南及厄他培南耐药率均超过5%[4]。肠杆菌科多个种属可检出CRE,常见CRE有肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌、变形杆菌属、弗劳地柠檬酸杆菌等[5-6]。
该院2014—2015年共分离7株CRE,其中6株为肺炎克雷伯菌,1株为弗劳地柠檬酸杆菌。4株CRE分离自重症监护病房(ICU),2株分离自神经外科,1株分离自心内科。5株分离自痰标本,2株分离自尿标本,7株CRE来源患者均存在严重的原发性疾病,如脑出血、颅脑外伤、严重的心血管疾病等,且长期接受广谱抗菌药物治疗,说明CRE可引起呼吸系统及泌尿系统感染,严重的原发疾病及广谱抗菌药物的使用是CRE感染的重要危险因素,与文献[7]报道一致。耐药数据显示,7株CRE对β-内酰胺酶抑制剂复合制剂、头孢菌素类、头霉素类、碳青霉烯类抗生素均耐药,分别有3株菌对阿米卡星及四环素敏感,提示CRE存在着复杂的耐药机制。
肠杆菌科细菌产ESBLs在各个国家地区均有报道,是细菌对头孢菌素类抗生素耐药的重要机制之一。ESBLs主要分为blaTEM、blaSHV、blaCTX-M,其中blaCTX-M根据同源性可分为多个家族,主要包括blaCTX-M-1-like、blaCTX-M-2-like、blaCTX-M-8-like及blaCTX-M-9-like[8]。细菌对碳青霉烯类抗生素主要耐药机制为产碳青霉烯酶,Ambler分类中的A、B、D类酶可水解碳青霉烯类抗生素,其中A类酶主要有GES、KPC、SME等,B类为金属酶,可被EDTA抑制,主要包括VIM、IMP、AIM、SIM、NDM-1等,D类酶即苯唑西林酶,其中的OXA-48对碳青霉烯类抗生素耐药发挥着巨大的作用[9-10]。携带有blaKPC-2的细菌对包括碳青霉烯类在内的所有β-内酰胺类抗生素耐药,同时因blaKPC-2位于可转移的耐药质粒上,极易导致blaKPC-2在不同细菌间传播,从而引起CRE医院感染的流行[11-12]。自2009年耐药基因blaNDM-1首次被报道以来,关于blaNDM-1的报道逐年增加,blaNDM-1编码的产物不但可以水解碳青霉烯类抗生素,也可水解多数头孢菌素类抗生素,携带有blaNDM-1的细菌往往同时携带有针对氨基糖苷类、喹诺酮类抗菌药物耐药基因,从而进一步加剧细菌的耐药性[13]。I类整合子是一类可主动获取耐药基因的可移动元件,在多种革兰阴性杆菌中均有检出,与细菌多重耐药性及耐药基因传播有着密切的关系[14]。本研究中1号及2号菌株同时携带有blaNDM-1、blaSHV、blaCTX-M-9-like及blainT-1,3号及6号菌株同时携带有blaKPC-2、blaTEM、blaSHV及blaCTX-M-9-like,4号及5号菌株同时携带有blaTEM、blaSHV及blainT-1,7号菌株同时携带有blaNDM-1、blaTEM、blaSHV、blaCTX-M-1-like及blainT-1,每株菌至少可检出2种ESBLs相关耐药基因,多株菌同时检出ESBLs相关耐药基因及blaNDM-1或blaKPC-2,说明携带有ESBLs相关耐药基因是7株CRE对头孢菌素类抗生素耐药的主要原因,同时也说明了多种耐药机制参与了头孢菌素类抗生素的耐药性;携带blaNDM-1及blaKPC-2是CRE对碳青霉烯类抗生素耐药的主要机制。4号及5号未检出blaNDM-1及blaKPC-2,可能是blaVIM、blaOXA-48等其他碳青霉烯耐药基因介导了对碳青霉烯类抗生素耐药[15]。7株CRE中部分菌株对氨基糖苷类、复方磺胺甲口恶唑及四环素耐药,因本研究主要了解CRE对头孢菌素类及碳青霉烯类抗生素的耐药机制,故未检测关耐药。
综上所述,CRE耐药形势严峻,结合本文耐药统计数据及文献报道,CRE感染治疗建议使用氨基糖苷类、四环素类如替加环素、多粘菌素、磷霉素等抗菌药物,美罗培南、多粘菌素及替加环素联合治疗可明显降低病死率[16]。多种不同耐药机制介导了CRE对头孢菌素类抗生素的耐药,对碳青霉烯类抗生素耐药主要机制为携带blaNDM-1及blaKPC-2。临床科室及医院感染控制部门应密切监控携带有碳青霉烯酶相关耐药基因及I类整合子的CRE,做好感染患者隔离工作,避免CRE在医院内暴发流行。
[1] Nakai H, Hagihara M, Kato H, et al. Prevalence and risk factors of infections caused by extended-spectrum β-lactamase (ESBL)-producing Enterobacteriaceae[J]. J Infect Chemother, 2016, 22(5): 319-326.
[2] Lerner A, Adler A, Abu-Hanna J, et al. Spread of KPC-producing carbapenem-resistant Enterobacteriaceae: the importance of super-spreaders and rectal KPC concentration[J]. Clin Microbiol Infect, 2015, 21(5): 470.e1-7.
[3] Ozbek B, Matarac-Kara E, Er S, et al. In vitro activities of colistin, tigecycline and tobramycin, alone or in combination, against carbapenem-resistant Enterobacteriaceae strains[J]. J Glob Antimicrob Resist, 2015, 3(4): 278-282.
[4] 胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志, 2015, 15(5):401-410.
[5] Miller BM, Johnson SW. Demographic and infection characteristics of patients with carbapenem-resistant Enterobacteriaceae in a community hospital: development of a bedside clinical score for risk assessment[J]. Am J Infect Control, 2016, 44(2): 134-137.
[6] 刘鹏飞, 陈佑明, 孙恒彪, 等.阴沟肠杆菌耐药性分析及NDM-1基因检测[J].中华医院感染学杂志, 2014, 24(21):5204-5206.
[7] 李渊婷, 金凤玲.肠杆菌科细菌对碳青霉烯类药物的耐药机制及临床治疗进展[J].中国感染控制杂志, 2015, 14(9):644-648.
[8] Nakama R, Shingaki A, Miyazato H, et al. Current status of extended spectrum β-lactamase-producingEscherichiacoli,KlebsiellapneumoniaeandProteusmirabilisin Okinawa prefecture, Japan[J]. J Infect Chemother, 2016, 22(5): 281-286.
[9] 唐小红, 朱卫民.肺炎克雷伯菌耐碳青霉烯类抗菌药的研究进展[J].国外医药抗生素分册, 2014, 35(3):115-118, 122.
[10] Galler H, Feierl G, Petternel C, et al. KPC-2 and OXA-48 carbapenemase-harbouring Enterobacteriaceae detected in an Austrian wastewater treatment plant[J]. Clin Microbiol Infect, 2014, 20(2): O132-O134.
[11] Nordmann P. Carbapenemase-producing Enterobacteriaceae: overview of a major public health challenge[J]. Med Mal Infect, 2014, 44(2): 51-56.
[12] Giani T, Arena F, Vaggelli G, et al. Large nosocomial outbreak of colistin-resistant, carbapenemase-producingKlebsiellapneumoniaetraced to clonal expansion of anmgrB deletion mutant[J]. J Clin Microbiol, 2015, 53(10): 3341-3344.
[13] Poirel L, Savov E, Nazli A, et al. Outbreak caused by NDM-1- and RmtB- producingEscherichiacoliin Bulgaria[J]. Antimicrob Agents Chemother, 2014, 58(4): 2472-2474.
[14] Canal N, Meneghetti KL, de Almeida CP, et al. Characterization of the variable region in the class 1 integron of antimicrobial-resistantEscherichiacoliisolated from surface water[J]. Braz J Microbiol, 2016, 47(2): 337-344.
[15] Barbarini D, Russello G, Brovarone F, et al. Evaluation of carbapenem-resistant Enterobacteriaceae in an Italian setting: report from the trench[J]. Infect Genet Evol, 2015, 30(2): 8-14.
[16] Morrill HJ, Pogue JM, Kaye KS, et al. Treatment options for carbapenem-resistant Enterobacteriaceae infections[J]. Open Forum Infect Dis, 2015, 2(2):ofv 050.
(本文编辑:豆清娅)
Resistance mechanisms of carbapenem-resistant Enterobacteriaceae to carbapenems and cephalosporins
SUNHeng-biao1,CHENYou-ming1,YOUXu1,PANZu-han1,XIAOGang1,MINGYue2
(1TheThirdAffiliatedHospitalofSouthernMedicalUniversity,Guangzhou510630,China; 2DepartmentofClinicalLaboratory,SouthernMedicalUniversity,Guangzhou510630,China)
Objective To study the resistance mechanisms of carbapenem-resistant Enterobacteriaceae(CRE) to carbapenems and cephalosporins, and provide molecular evidence for the treatment of CRE infection and control of healthcare-associated infection.Methods Clinically isolated bacteria in 2014-2015 were identified and performed antimicrobial susceptibility testing by MicroScan Walkaway-40 plus system, encoding genes of carbapenems(blaNDM-1andblaKPC-2) and encoding genes of extended-spectrum β-lactamases (blaTEM,blaSHV,blaCTX-M-1-like,blaCTX-M-2-like,blaCTX-M-8-like, andblaCTX-M-9-like)were detected, multidrug-resistance organism-related class I integron encoding geneblainT-1was also detected. Results Seven CRE strains were isolated in 2014-2015, isolation rate was 0.30%, strain 1-6 wasKlebsiellapneumoniae, strains 7 wasCitrobacterfreundii, all 7 strains were resistant to β-lactamase inhibitor compound, cephalosporins, cephamicins, and carbapenems, 3 strains were sensitive to amikacin and tetracycline, 2 strains were sensitive to compound sulfamethoxazole. 3, 2, 5, 7, 1, 4, and 5 strains of CRE were detected carryingblaNDM-1,blaKPC-2,blaTEM,blaSHV,blaCTX-M-1-like,blaCTX-M-9-like,andblainT-1respectively, no strain was found to carryblaCTX-M-2-like andblaCTX-M-8-like genes. ConclusionblaNDM-1andblaKPC-2are important mechanisms leading to carbapenem resistance of 7 CRE strains;blaTEM,blaSHV, andblaCTX-M-9-like are important mechanism leading to cephalosporin resistance,blainT-1plays an important role in multidrug-resistance to CRE and spread of multidrug-resistant genes.
carbapenem-resistant Enterobacteriaceae; Enterobacteriaceae; cephalosporin; carbapenemase; carbapenems; multidrug resistance; CRE
2016-06-05
孙恒彪(1986-),男(汉族),陕西省咸阳市人,主管技师,主要从事细菌耐药机制研究。
陈佑明 E-mail:cym38432@163.com
10.3969/j.issn.1671-9638.2017.05.003
R378
A
1671-9638(2017)05-0404-05
