阿托伐他汀诱导血红素氧合酶1表达对血管内皮细胞抗炎症损伤能力的影响
2017-06-05王忠庆黄维义
王忠庆,黄维义
(西南医科大学附属医院,四川泸州646000)
阿托伐他汀诱导血红素氧合酶1表达对血管内皮细胞抗炎症损伤能力的影响
王忠庆,黄维义
(西南医科大学附属医院,四川泸州646000)
目的 探讨阿托伐他汀能否通过诱导血红素氧合酶1(HO-1)表达增强血管内皮细胞抗炎症损伤的能力。方法 体外培养人脐静脉内皮细胞(HUVEC),随机分为5组,分别予以不同浓度的阿托伐他汀(0、1、2、5、10 μmol/L)孵育24 h,检测HO-1蛋白表达量和上清液胆红素浓度 。另将HUVEC随机分5组,对照组(等量纯培养基)、大剂量他汀组(阿托伐他汀10 μmol/L) 、小剂量他汀组(阿托伐他汀2 μmol/L)、HO-1阻断组(阿托伐他汀10 μmol/L+ZnPP IX 10 μmol/L)、胆红素组(胆红素5 μmol/L)孵育细胞24 h后,各组均加入终浓度为10 ng/mL 的TNF-α孵育细胞12 h。检测细胞上清液乳酸脱氢酶(LDH)、单核细胞趋化蛋白1(MCP-1)、丙二醛(MDA)、一氧化氮(NO)浓度并检测细胞活力和凋亡率。结果 与0 μmol/L浓度组比较,阿托伐他汀2、5、10 μmol/L浓度组HO-1蛋白的表达及胆红素水平增高(P<0.05或<0.01)。与对照组比较,加用阿托伐他汀或胆红素预处理组上清液MCP-1、MDA、LDH水平降低且NO水平升高,细胞活力增强,细胞凋亡率降低(P<0.05或<0.01),HO-1阻断组上述各项指标均无明显变化(P均>0.05)。结论 阿托伐他汀具有诱导HUVEC血红素氧合酶1(HO-1)表达增强血管内皮细胞抗炎症损伤的能力,且此作用可能存在剂量依赖性。
动脉粥样硬化;阿托伐他汀;血红素氧合酶-1;肿瘤坏死因子-α;炎症;细胞凋亡;脐静脉内皮细胞
已知血管内皮在维持血管稳态过程中发挥着重要作用,内皮细胞损伤与修复功能障碍是多种心、脑血管疾病的重要病理基础,内皮损伤业已被认定为动脉粥样硬化(AS)的始动环节[1]。大量研究证实,已知的致AS主要危险因素如吸烟、高血压、糖尿病、脂代谢紊乱乃至血液流变学改变等都能引起氧化应激及炎症[2],而这些正是导致内皮损伤与功能障碍的关键机制[3]。他汀是防治AS的关键药物,不仅具有强大的调脂作用,还具有诸如抗炎、抗氧化、保护内皮细胞等众多的调脂外作用。血红素氧合酶1(HO-1)是细胞内一种可诱导的重要保护酶,在拮抗氧化应激和炎症所致的组织与细胞损伤中发挥着重要作用[4]。2015年10月~2016年5月,我们采用体外培养脐静脉内皮细胞(HUVEC)进行实验研究,探讨阿托伐他汀能否通过诱导HO-1表达增强内皮细胞的抗炎症损伤能力。
1 材料与方法
1.1 材料 HUVEC购自广州吉尼欧公司;阿托伐他汀标准品购自药检所;胆红素、锌原卟啉IX((ZnPP IX)购自Sigma公司;兔抗HO-1抗体购自Abcam公司;单核细胞趋化蛋白-1(MCP-1)、丙二醛(MDA)、一氧化氮(NO)、胆红素ELISA试剂盒购自英国Abcam公司;AnnexinV-FITC/PI双染试剂盒购自凯基生物公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)购自Sigma公司;RPMI-1640培养液、0.25%胰蛋白酶-EDTA购自Hyclone公司;胎牛血清(FBS)购自杭州四季青公司。
1.2 细胞培养及分组干预 HUVEC 培养在含10% FBS的RPMI-1640培养基,置于5% CO2、37 ℃的培养箱中培养,待细胞融合达80%后,用0.25%胰蛋白酶-EDTA消化,消化适宜后加入完全培养基终止消化作用。用灭菌后的枪头将培养瓶壁上的细胞吹落形成细胞悬液,800 r/min离心5 min,按照1∶3进行传代培养,接种在6孔板中,当细胞生长至亚融合状态时换用无血清培养基培养12 h达同步化,再行分组实验。 实验一:分为5组(每组6孔),分别给予不同终浓度阿托伐他汀(0、1、2、5、10 μmol/L)孵育24 h。实验二:分为5组(每组6孔),对照组(等量纯培养基)、大剂量他汀组(阿托伐他汀10 μmol/L) 、小剂量他汀组(阿托伐他汀2 μmol/L)、HO-1阻断组(阿托伐他汀10 μmol/L + ZnPP IX 10 μmol/L)、胆红素组(胆红素5 μmol/L)孵育细胞24 h后,各组均加入终浓度为10 ng/mL 的TNF-α孵育细胞12 h。
1.3 细胞上清液 HO-1蛋白表达检测 收集实验一干预后的各组细胞,加入裂解液裂解60 min,4 ℃、14 000 r/min离心5 min,取上清液用BCA法检测蛋白浓度。以β-actin为内参,采用Quantity图像分析软件分析其相对表达量,以灰度比值表示。
1.4 细胞上清液胆红素、MDA、MCP-1、NO、LDH浓度检测 收集实验一干预后的各组细胞的上清液采用ELISA法测定胆红素浓度;收集实验二干预后的各组细胞的上清液采用ELISA法测定MDA、MCP-1、NO、LDH水平,MDA、MCP-1、NO浓度;以上测定操作步骤均按照试剂盒说明进行。LDH浓度采用全自动生化仪进行测定,所有操作步骤按照全自动生化仪的操作流程进行。
1.5 细胞增殖活力检测 采用MTT法。将含4×104/mL细胞悬液以每孔200 μL接种于96孔板中,按照实验二分组及干预结束后,每孔加入10 μL MTT液,将培养板放置于37 ℃,5% CO2的细胞培养箱中孵育4 h后,弃去培养液,每孔均加入150 μL二甲基亚砜后,放在摇床上低速振荡10 min后,用酶标仪测定490 nm处各孔OD值。OD值越大,细胞增殖活力越强。
1.6 细胞凋亡检测 收集实验二加入终浓度为10 ng/mL 的TNF-α孵育12 h后的各组细胞, Annexin V-FITC/PI双染法将样本中正常、坏死凋亡细胞区分开,采用流式细胞技术检测细胞凋亡率,所有操作按照凯基凋亡试剂盒说明进行。
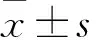
2 结果
2.1 不同浓度阿托伐他组HO-1蛋白表达及胆红素水平比较 HUVEC细胞HO-1蛋白的表达及胆红素水平随着阿托伐他汀浓度的增高而增加,与0 μmol/L浓度组比较, 2、5、10 μmol/L浓度组HO-1蛋白的表达及胆红素水平增高(P<0.05或<0.01)。见表1。
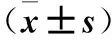
表1 不同浓度阿托伐他组HO-1蛋白表达及胆红素水平比较
注:与阿托伐他汀0 μmol/L组比较,*P<0.05,△P<0.01。
2.2 HO-1激活或阻断各组氧化应激和炎症因水平变化 与对照组比较,加用阿托伐他汀或胆红素预处理HUVEC均可明显降低上清液中MCP-1、MDA、LDH的水平并增加NO的水平(P<0.05或<0.01),HO-1阻断组上述各项指标无统计学差异(P均>0.05)。见表2。
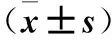
表2 HO-1激活或阻断各组氧化应激和炎症因浓度变化
注:与对照组比较,*P<0.05,△P<0.01。
2.3 HO-1激活或阻断各组细胞活力及凋亡率变化 与对照组比较,加用他汀或胆红素预处理后均可减轻TNF-α引起的HUVEC细胞损伤,升高细胞活力、降低细胞凋亡率(P<0.05或<0.01),HO-1阻断组HUVEC活力与凋亡率无统计学差异(P均>0.05)。见表3。
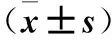
表3 HO-1激活或阻断各组细胞活力及凋亡率变化
注:与对照组比较,*P<0.05,△P<0.01。
3 讨论
众所周知,他汀自问世以来已然成为AS防治的基石,他汀对内皮细胞的保护作用则被认为是其防治AS的重要机制之一。然而他汀如何保护内皮细胞并未完全明了。近年陆续报道,诱导HO-1高表达可能是他汀拮抗AS的重要机制[5]。已知HO-1是广泛存在于哺乳动物细胞微粒体中的一种可诱导的重要抗氧化酶, HO-1的主要作用是充当关键的限速酶催化具有促氧化性质的游离血红素降解生成胆绿素、一氧化碳(CO)和游离铁,其中的胆绿素常被迅速还原成胆红素。现已明确,胆红素是细胞最强的内源性抗氧化剂之一,它能通过清除多种形式的自由基而在细胞拮抗氧化应激损伤中发挥着重要作用[6];CO则是与NO相似的细胞内气体信号分子,主要参与扩张血管、抑制炎症、调节细胞增殖与凋亡等重要作用[7], HO-1/胆红素/CO共同组成的内源性保护系统在组织细胞应对炎症与氧化应激损伤中不可或缺,合理上调HO-1表达已成为包括AS在内的多种疾病的重要防治靶点[8,9]。
阿托伐他汀是抗AS循证依据最多、临床应用最广的他汀之一,不仅具有强大的调脂作用,还具有诸如抗炎、抗氧化、保护内皮细胞等众多的调脂外作用。近年来已有多项研究显示,他汀正是HO-1的有效诱导剂(尽管不同种类的他汀诱导HO-1表达的细胞内信号转导机制有所不同)[10],他汀众多的调脂外作用正逐渐被揭示主要是通过诱导HO-1表达介导的。本实验发现,当达到一定浓度后,阿托伐他汀能呈剂量依赖性诱导体外培养的HUVEC高表达HO-1蛋白并增加胆红素的生成。已知TNF-α是由单核巨噬细胞分泌的一种促炎症因子,它可以启动炎症反应过程[11]。为此,我们给体外培养的HUVEC加入TNF-α共同孵育以模拟炎症环境,通过检测细胞培养液中MCP-1水平代表炎症反应程度,同时检测MDA、 LDH、NO水平及细胞活力和细胞凋亡率代表HUVEC遭受炎症损[12,13]伤的程度。结果显示,与对照组相比,在能诱导HO-1表达的前提下,给予小剂量(2 μmol/L)阿托伐他汀预处理即可明显减轻HUVEC的炎症损伤程度,给予大剂量阿托伐他汀(10 μmol/L)预处理所产生的抗HUVEC炎症损伤作用则更加显著,但大剂量阿托伐他汀的这一细胞保护作用却能被同时加入的ZnPPIX消除,由于ZnPPIX是HO-1的特异性阻断剂,提示阿托伐他汀抗HUVEC炎症损伤作用可能主要是通过诱导HO-1蛋白表达实现的,这一点也被胆红素组的结果所佐证,即不用他汀而用外源性胆红素也能在一定程度上起到抗HUVEC炎症损伤效果,不过单用胆红素的保护作用远不及大剂量阿托伐他汀,可能是因为后者诱导HO-1显著表达后,能起到降解清除有害的游离血红素并生成抗氧化与抗炎症的胆红素和CO,这一举三得的综合保护作用自然比单用外源性胆红素更能增强HUVEC的抗炎症损伤效果。总之,本实验的上述结果证明,足够剂量的阿托伐他汀能显著诱导HO-1表达并因此增强HUVEC的抗炎症损伤能力,而胆红素可能是该保护作用的效应分子之一。
本研究同时也发现,过低剂量的阿托伐他汀(1 μmol/L)并不能有效诱导HO-1表达。Mirjanic-Azaric等[14,15]临床试验也发现了类似结果。提示对AS患者需要强化他汀治疗才能有效显现出其调脂外作用。理解这一点,对合理应用他汀防治以炎症为基础的易损斑块所致的急性冠脉综合征尤为重要。
[1] Mannarino E, Pirro M. Endothelial injury and repair: a novel theory for atherosclerosis [J].Angiology, 2008,59(2 Suppl):69S-72S.
[2] Kunitomo M. Oxidative stress and atherosclerosis [J].Yakugaku Zasshi, 2007,127 (12): 1997-2014.
[3] Fleissner F, Thum T. Critical role of the nitric oxide/reactive oxygen species balance in endothelial progenitor dysfunction [J].Antioxid Redox Signal, 2011,15(4):933-948.
[4] Takahashi T,Morita K,Akagi R,et al. Heme oxygenase -1:a novel therapeutic target in oxidative tissue injuries [J].Curr Med Chem,2004,11(12): 1545-1561.
[5] Heeba G, Moselhy ME, Hassan M , et al. Anti-atherogenic effect of statins: role of nitric oxide, peroxynitrite and haem oxygenase-1 [J]. Br J Pharmacol, 2009,156(8):1256-1266.
[6] Ishikawa K, Maruyama Y. Heme oxygenase as an intrinsic defense system in vascular wall:implication against atherogenesis [J].J Atheroscler Thromb,2001,8(3):63-70.
[7] Zou AP, Billington H, Su N, et al. Expression and actions of heme oxygenase in the renal medulla of rats [J].Hypertension, 2000,35(8):342-347.
[8]Kirkby KA, Adin CA. Products of heme oxygenase and their potential therapeutic applications [J] .Am J Physiol Renal Physiol, 2006,290(3): F563-F571.
[9] Haines DD, Lekli I, Teissier P, et al. Role of haeme oxygenase-1 in resolution of oxidative stress-related pathologies: focus on cardiovascular, lung, neurological and kidney disorders [J].Acta Physiol (Oxf), 2012,204(4): 487-501.
[10] Hsieh CH, Jeng JC, Hsieh MW, et al. Involvement of the p38 pathway in the differential induction of heme oxygenase-1 by statins in Neuro-2Acells exposed to lipopolysaccharide [J]. Drug Chem Toxicol, 2011,34(1):8-19.
[11] Huang WY, Wang J,Liu YM,et al. Inhibitory effect of malvidin on TNF-α-induced inflammatory response in endothelial cells [J].Eur J Pharmacol, 2014,723:67-72.
[12] Barone E, Di Domenico F, Butterfield DA. Statins more than cholesterol lowering agents in Alzheimer disease: their pleiotropic functions as potential therapeutic targets [J]. Biochem Pharmacol, 2014,88(4):605-616 .
[13] Ali F, Hamdulay SS, Kinderlerer AR, et al. Statin-mediated cytoprotection of human vascular endothelial cells: a role for Kruppel-like factor 2-dependent induction of heme oxygenase-1 [J] . J Thromb Haemost, 2007,5(12):2537-2546.
[14] Mirjanic-Azaric B, Rizzo M, Jürgens G, et al. Atorvastatin treatment increases plasma bilirubin but not HMOX1 expression in stable angina patients [J].Scand J Clin Lab Invest, 2015,75(5):382-389.
[15] Hsu M,Muchova L,Morioka I,et al. Tissue-specific effects of statins on the expression of heme oxygenase-1 in vivo [J]. Biochem Biophys Res commun, 2006,343(3):738-744.
黄维义(E-mail:hwy6881@126.com)
10.3969/j.issn.1002-266X.2017.17.011
R543.5
A
1002-266X(2017)17-0034-03
2016-11-07)
