泽泻汤加味方对高盐诱导大鼠高血压肾功能损害的保护作用
2017-06-05何红梅梅爱敏田河林苏县辉赵如同康艳辉
何红梅,梅爱敏,田河林,苏县辉,赵如同,康艳辉
(河北工程大学医学院,河北邯郸056002)
泽泻汤加味方对高盐诱导大鼠高血压肾功能损害的保护作用
何红梅,梅爱敏,田河林,苏县辉,赵如同,康艳辉
(河北工程大学医学院,河北邯郸056002)
目的 观察泽泻汤加味方对高盐诱导大鼠高血压肾功能损害的保护作用。方法 选取4周龄雄性Wistar大鼠90只给予8%高盐饲料喂养18周,筛选出符合标准的高盐高血压大鼠模型40只,随机分为模型组、西药组、泽泻汤加味方高剂量组(高剂量组)、泽泻汤加味方中剂量组(中剂量组),每组10只。另选取正常组大鼠10只。5组均给予普通饲料,并施以相应的干预措施。干预8周后,采用全自动生化分析仪检测24 h尿蛋白(24 Upro)以及血尿素氮(BUN)、肌酐(Scr),放免法检测尿β2-微球蛋白(β2-MG),ELISA法检测血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)和胱抑素C(CysC)。定时测量尾动脉收缩压(SBP)。结果 药物干预8周后,与模型组比较,西药组、高剂量组、中剂量组各阶段SBP、24 h Upro、尿β2-MG、血清NGAL水平均降低(P均<0.05)。西药组与中剂量组相比,SBP水平有统计学差异(P均<0.05)。高剂量组与中剂量组相比,血清NGAL水平有统计学差异(P<0.05)。药物干预3组BUN、24h Upro及β2-MG水平差异无统计学意义(P均>0.05)。5组血清Scr及CysC水平比较无统计学差异(P均>0.05)。结论 泽泻汤加味方可降低高盐高血压大鼠的SBP并能有效保护肾功能,16.2 g/kg的高剂量对降压及肾功能损害的保护作用更佳。
高血压;肾功能损害;泽泻汤加味方;中性粒细胞明胶酶相关脂质运载蛋白;胱抑素C;尿蛋白;β2-微球蛋白;大鼠
高血压常伴有心、脑、肾、血管等靶器官的损害[1],是导致终末期肾病的重要病因之一[2]。因此,对高血压患者及时进行药物治疗及预防有重要的临床意义。2015年10月~2016年6月,我们通过给大鼠喂以8%高盐饲料的方法建立高血压大鼠肾损害模型,观察泽泻汤加味方对高血压大鼠的降压作用及高血压肾损害的保护作用。
1 材料与方法
1.1 主要材料 4周龄健康雄性Wistar大鼠100只,清洁级,体重(140±10)g,购自河北省实验动物中心(动物合格证号:1510415)。实验前适应性饲养1周。泽泻汤加味方由天津中医药大学第二附属医院孙兰军教授提供,中药饮片包括泽泻、白术、泽兰、石菖蒲,均购自河北邯郸医药大厦连锁有限公司,煎煮浓缩制成浓度为1∶2的水煎剂(即1 mL水煎剂含2 g生药),置于-40 ℃冰箱中保存备用。缬沙坦胶囊购自北京诺华制药有限公司(产品批号:X1885),氢氯噻嗪片购自天津力生制药股份有限公司(产品批号:1507012),实验时将两药研成细粉用双蒸水配置成所需浓度的溶液。另有BP-100A全自动无创血压测量仪(成都泰盟软件有限公司)、日立7180型全自动生化分析仪、FT-630G放免仪、DW-HL388型中科美菱-86 ℃超低温储存箱、BIO-RAD iMark 11586型酶标仪。β2-微球蛋白(β2-MG)放射免疫分析药盒由北京原子高科股份有限公司提供,大鼠中性粒细胞明胶酶相关脂质运载蛋白(NGAL)酶联免疫分析(ELISA)试剂盒与大鼠胱抑素C(CysC)ELISA试剂盒由北京雅安达生物技术有限公司提供。
1.2 血压测量 用全自动无创血压测量仪测量大鼠清醒安静状态时尾动脉收缩压(SBP)。将大鼠置于特制鼠笼,固定于恒温箱中,鼠尾依次套入阻断器与传感器,保持箱体温度36 ℃。待电脑屏幕上出现稳定的脉搏波后,开始测压,阻断器自动充气至200 mmHg致脉搏波完全消失,再缓慢放气,电脑屏幕上出现的第一个脉搏波对应的压力即为SBP。每只大鼠测3次,取其平均值。
1.3 模型建立与分组 将大鼠随机分为正常组10只和造模组90只。正常组给予普通饲料(0.5% NaCl、99.5%基础饲料),造模组给予8%高盐饲料(8% NaCl、92%基础饲料)。大鼠连续喂养18周,每4周测量血压一次。18周后统一测量血压,按照SBP>130 mmHg的标准筛选造模组血压达标大鼠。凡血压已达标大鼠,改饲普通饲料1周后,再次测量血压仍达标者为造模成功[3,4],筛选出符合标准的40只高盐高血压大鼠。筛选出的40只大鼠随机分为4组:模型组、缬沙坦和氢氯噻嗪组(西药组)、泽泻汤加味方高剂量组(高剂量组)和泽泻汤加味方中剂量组(中剂量组),每组10只。
1.4 给药方法 西药组给予缬沙坦(14.4 mg/kg)与氢氯噻嗪(2.25 mg/kg)的混合液,正常组和模型组给予等容量双蒸水,高、中剂量组分别给予泽泻汤加味方16.2 g/kg、10.8 g/kg。各组大鼠每日灌胃1次,连续灌胃8周。用药期间,所有大鼠均给予普通饲料。用药1、2、4、8周后各测血压1次。
1.5 尿液生化指标检测 5组大鼠普通饲料喂养并给予不同处理8周后,将每只大鼠分别置于代谢笼中,收集24 h尿量(自由饮水、禁食)。用日立7180型全自动生化分析仪定量检测24 h尿蛋白(24 h Upro),用放射免疫法检测尿β2-MG。
1.6 血清生化指标检测 25%乌拉坦0.4 mL/100 g腹腔注射麻醉大鼠,于大鼠左胸部心脏搏动最强处穿刺取血,3 000 r/min离心10 min取血清,放置-80 ℃冰箱备用。用日立7180型全自动生化分析仪检测血尿素氮(BUN)和血肌酐(Scr),用ELISA法检测血清NGAL和CysC。
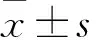
2 结果
2.1 5组大鼠用药后不同阶段尾动脉SBP变化 与模型组比较,用药后西药组、高剂量组、中剂量组大鼠SBP显著降低(P均<0.05)。与西药组比较,高剂量组SBP无统计学差异(P均>0.05),中剂量组SBP有统计学差异(P均<0.05)。见表1。
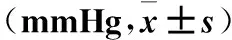
表1 5组大鼠用药不同阶段尾动脉SBP比较
注:与模型组比较,*P<0.05;与西药组比较,#P<0.05。
2.2 5组大鼠用药后24 h Upro、尿β2-MG水平比较 与模型组比较,药物干预的3组大鼠24 h Upro及尿β2-MG水平显著降低(P均<0.05),但药物干预3组间差异无统计学意义(P均>0.05)。见表2。
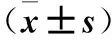
表2 5组大鼠用药后24 h Upro与尿β2-MG水平比较
注:与模型组比较,*P<0.05。
2.3 5组大鼠用药后血清BUN、Scr、NGAL及CysC水平比较 用药8周后,与模型组比较,药物干预的3组血清NGAL水平显著降低(P均<0.05)。高剂量组与中剂量组相比,血清NGAL水平降低有统计学意义(P<0.05)。药物干预3组血清BUN水平比较无统计学差异(P均>0.05);5组血清Scr、CysC水平比较无统计学差异(P均>0.05)。结果见表3。
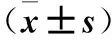
表3 5组大鼠用药后血清BUN、Scr、NGAL、CysC水平比较
注:与模型组比较,*P<0.05;与高剂量组比较,#P<0.05。
3 讨论
美国最新肾脏疾病统计数据显示,高血压是导致终末期肾病的第2位病因[2]。在我国高血压肾病则继慢性肾小球肾炎、糖尿病肾病之后,位居第3位,且有不断上升趋势。有研究表明,高血压肾损害的发病机制与交感神经系统(SNS)活性升高、肾素-血管紧张素系统异常、盐负荷、遗传或先天因素、高血压状态下肾小球前小动脉阻力增加及肾小球内高压有关[5]。钠盐摄入过多是原发性高血压发生、发展的一个重要环境因素,但也存在个体差异[6]。盐敏感高血压患者在盐负荷增加时,更容易出现肾脏泌盐能力损害、盐潴留、SNS活性升高,引起血管平滑肌收缩,血管阻力升高,导致血管肥厚等肾损害[5]。本研究连续18周给大鼠喂食8%高盐饲料,动态观察大鼠尾动脉SBP变化。发现部分大鼠SBP升高且达到筛选标准,改为普通饲料喂养8周,模型组大鼠SBP不降低。表明长期高盐饮食可诱导动物出现高血压,这与人类的高盐摄入与高血压发病有关的实际情况非常接近。
高血压可引起肾脏等靶器官的损害,肾功能受损又使血压进一步升高且难以控制,形成恶性循环,故适当控制血压可有效预防或延迟并发症的发生。目前,西药治疗高血压及其肾损害的药物较多,但不良反应明显,且部分药物价格昂贵,对终生服药治疗患者负担较重。中药则具有药性温和、价格低廉、不良反应少等特点。高血压肾损害的中医病机变化为肾虚精亏、痰瘀阻络、肾络风动及肾络成积[7]。根据中医理论,临床上主用或兼用中医祛痰化湿、活血化瘀、利水泄浊的方法,可以通过多种机制有效地降低血压,保护肾功能。《金匮要略》泽泻汤由泽泻、白术组成,以利水制水见长。泽泻归肾、膀胱经,能利水渗湿,清湿热,有利尿降压之功效;白术归脾、胃经,能健脾益气,燥湿利水,入少阴经,利腰脐间血,通水道,在气主气,在血主血。泽兰归肝、脾经,可活血祛瘀,利水消肿;石菖蒲归心、胃经,能祛痰开窍,化湿开胃,宁神益智。以泽泻汤为基本方,加用泽兰、石菖蒲组成泽泻汤加味方,对原发性高血压及高血压肾损害可发挥利水泄浊、健脾化痰、活血化瘀之功效,能有效降低血压、延缓或改善高血压肾损害。
由于肾脏有强大的储备和代偿能力,在肾小球受损早期或轻度受损时,传统肾功能检查指标BUN和Scr可能正常[8]。目前,临床普遍认为原发性高血压早期肾损害可出现血NGAL、CysC水平升高以及尿24 h Upro、β2-MG排出量增加[9~12],检测以上指标对高血压肾损害早期诊断及预防尤为重要。有研究显示,血清NGAL、CysC水平与高血压肾病患者病情严重程度均呈高度正相关,监测高血压患者血清NGAL与CysC水平比监测尿β2-MG更易更早发现肾损害[9]。本研究结果显示,给予不同药物干预后,各组大鼠血压先后出现不同程度降低,3组药物干预对高盐高血压大鼠持续的降压作用相当。同时,干预组血清NGAL水平与尿24 h Upro、β2-MG水平较模型组显著降低,表明药物干预对高盐高血压大鼠的肾损害有一定的保护作用。本研究还显示,高剂量组与中剂量组相比,血清NGAL水平有统计学差异,表明泽泻汤加味方对肾损害的保护作用呈一定的剂量依赖性;泽泻汤加味方16.2 g/kg的高剂量与西药缬沙坦联合氢氯噻嗪用药作用相当。中药泽泻汤加味方对高血压肾损害的治疗不仅仅局限于单纯降低血压,而是运用辨证论治的思想和整体治疗的观念,强调机体阴阳平衡,从而改善临床症状,促进肾损害等病理改变的恢复,保护靶器官[13]。未来如进一步将泽泻汤加味方加工浓缩制成中成药方便患者贮存、携带、服用,其降低血压、延缓或改善肾损害的应用前景更为广阔。
[1] 刘力生.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743.
[2] Foley RN, Collins AJ. The USRDS:what you need to know about what it can and can′t tell us about ESRD[J]. Clin J Am Soc Nephrol, 2013,8(5):845-851.
[3] 梅爱敏, 范文亮, 任立群, 等. 泽泻汤加味方最佳组方配伍降压作用机制的研究[J]. 山东医药, 2012, 52(8):62-64.
[4] 陈景彦, 范洪亮, 张树峰, 等. 泽泻汤加味方对高盐致高血压大鼠肾损害的预防作用[J]. 中医杂志, 2012, 53(3):234-237.
[5] 王海燕. 肾脏病学[M]. 3版. 北京: 人民卫生出版社, 2008: 1662-1668.
[6] 李伟, 周乐, 刘新辉, 等. 盐敏感性高血压发病机制再认识[J]. 中华高血压杂志, 2012, 20(10):941-945.
[7] 刘玉宁, 王耀献. 高血压肾损害病理变化的中医病机探讨[J]. 中国中西医结合肾病杂志, 2012, 13(1):1-3.
[8] 赵翠霞, 蔡武全, 闫龙. 胱抑素C、尿微量白蛋白及β2微球蛋白的检测对糖尿病肾病早期诊断的价值探讨[J]. 现代诊断与治疗, 2014, 25(18):4225-4226.
[9] 张清平, 邹长进, 张敏. 高血压肾病患者血清NGAL 与 Cys-c水平探讨[J]. 中国卫生检验杂志, 2013, 23(9):2203-2204.
[10] Bolignano D, Donato V, Coppolino G, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a marker of kidney damage [J]. Am J Kidney Dis, 2008,52(3):595-605.
[11] Mori K, Lee HT, Rapoport D, et al. Endocytic delivery of lipocalin-siderophore-iron complex rescues the kidney from ischemia-reperfusion injury[J]. J Clin Invest, 2005,115(3):610-621.
[12] Pucci L, Triscornia S, Lucchesi D, et al. Cystatin C and estimates of renal function: searching for a better measure of kidney function in diabetic patients[J]. Clin Chem, 2007,53(3):480-488.
[13] 李艳芬,孙兰军.中医药对原发性高血压靶器官损害保护作用的研究进展[J].云南中医中药杂志,2013,35(6):65-67.
河北省教育厅科技计划研究项目(ZD2015125);邯郸市科技局研究项目(1623208060-1,1523108076-12)。
何红梅(E-mail: he_hongmei@163.com)
10.3969/j.issn.1002-266X.2017.17.010
R544.1
A
1002-266X(2017)17-0031-03
2016-11-18)
