miR-451对心肌细胞缺氧再复氧损伤的保护作用及其机制
2017-06-05胡笑容谢菁马瑞松廖芫熙李雪飞江洪
胡笑容,谢菁,马瑞松,廖芫熙,李雪飞,江洪
(武汉大学人民医院,武汉430060)
miR-451对心肌细胞缺氧再复氧损伤的保护作用及其机制
·论著·
目的 探讨miR-451对心肌细胞缺氧再复氧损伤的保护作用及其心肌细胞高迁移率族蛋白1(HMGB1)表达变化。方法 培养乳鼠心室肌细胞,制备缺氧再复氧模型,并随机分为对照组(Con组)、缺氧再复氧组(AR组)、AR+Ad-GFP组(空病毒组)、AR+Ad-miR-451组(miR-451上调组)、AR+Ad-asmiR-451组(miR-451下调组)。检测五组心肌细胞存活率、凋亡率以及HMGB1 mRNA、HMGB1和激活细胞凋亡蛋白酶3(caspase-3)表达水平。利用荧光素酶检测法在HEK293细胞中进一步确认miR-451对HMGB1作用靶点。结果 与Con组比较,AR组、空病毒组、miR-451上调组、miR-451下调组心肌细胞存活率降低、凋亡率增高,心肌细胞HMGB1 mRNA、HMGB1、激活caspase-3表达增高(P均< 0.05)。与AR组比较,Ad-miR-451组心肌细胞存活率增高、凋亡率降低,心肌细胞HMGB1 mRNA、HMGB1、激活caspase-3表达降低(P均< 0.05)。miR-451识别HMGB1 mRNA的3′端非编码区并以此为作用靶点抑制HMGB1表达。结论 上调miR-451对心肌细胞缺氧再复氧损伤有保护作用,此作用是通过miR-451抑制HMGB1 mRNA表达而实现的。
心肌细胞;缺氧再复氧损伤;微小RNA-451;高迁移率族蛋白1
心肌缺血再灌注可以引起局部心肌的炎症反应、活性氧簇的产生及细胞凋亡,这些均可以导致心肌细胞损伤[1]。近期研究显示,高迁移率族蛋白1 (HMGB1)是一种新的促炎因子,由坏死或凋亡的细胞被动释放及活化的免疫细胞主动分泌,其在急性肝坏死、房颤、心肌梗死、心肌缺血再灌注损伤等炎症性疾病中发挥了重要的作用,抑制HMGB1的表达可以减轻心肌缺血再灌注损伤[2,3]。miRNAs是一组小的非编码RNA,它们通过RNA诱导的沉默复合体发挥对基因表达的负调控作用,导致其靶基因的翻译抑制或mRNA降解[4,5]。已有研究证实,miRNAs调控了疾病生理过程中所涉及到不同信号通路的关键蛋白的表达,如心肌缺血再灌注[6];在心肌缺血再灌注过程中,miR-1、 miR-21、miR-29、 miR-133、miR-320、miR-451的表达水平均有变化[6~8]。然而,miRNAs和HMGB1的相关性仍不清楚。2016年5~10月,我们就miR-451抑制HMGB1的表达及其对心肌细胞缺氧再复氧损伤的保护作用进行了研究。
1 材料与方法
1.1 腺病毒载体的构建 通过在巨细胞病毒启动子反向克隆miR-451、反义miR-451原始DNA或空质粒构建miR-451、反义miR-451和空质粒腺病毒(Ad-miR-451、Ad-asmiR-451 和 Ad-GFP)。重组病毒在HEK293细胞中扩增,通过Adeno-XTM纯化设备(Microbix, 加拿大)使其滴度达到1011 pfu/mL。
1.2 细胞培养和处理 从武汉大学实验动物中心购得出生1~3 d的SD大鼠,在同一饲养环境下饲养昼夜交替12 h,让其自由摄取水和食物。用胰酶消化法制备新生大鼠心室肌细胞[11],随机分为5组。对照组(Con组):心肌细胞在含有15 %胎牛血清的DMEM F12培养液中培养;缺氧再复氧组(AR组):心肌细胞在上述培养液中培养,缺氧4 h,再复氧2 h;AR+ Ad-GFP组(空病毒组):缺氧处理前24 h予空病毒(最终感染复数=100,转染时间=2 h)预处理,后予缺氧再复氧;AR+Ad-miR-451组(miR-451上调组):缺氧处理前24 h予Ad-miR-451(最终感染复数=100,转染时间=2 h)预处理,后予缺氧再复氧;AR+Ad-asmiR-451组(miR-451下调组):缺氧处理前24 h予Ad-asmiR-451(最终感染复数=100,转染时间=2 h)预处理,后予缺氧再复氧。
1.3 心肌细胞凋亡率检测 收集预处理后的心肌细胞,用PBS冲洗并使其悬浮于500 μL结合缓冲液,然后用5 μL膜联蛋白和5 μL碘化丙啶孵育。腺病毒成功转染细胞的标志为出现绿色荧光蛋白表达。用流式细胞仪测定染色细胞凋亡率。
1.4 心肌细胞存活率检测 根据说明书用细胞计数工具包CCK-8(Dojindo,日本)检测细胞存活率。将心肌细胞以1×105个/孔接种于96孔板并孵育4 d。用酶标仪(Bio-Rad Laboratories,Hercules,加拿大)检测每孔在490 nm处吸光度。细胞存活率=(所检测孔的平均吸光度)/(对照孔的平均吸光度)×100%。
1.5 HMGB1 mRNA表达检测 用TRIzol试剂盒(Roche,美国)提取总的RNA,并逆转录为cDNA。利用SYBR Green-based qPCR工具包(Roche, 美国)实时定量PCR检测HMGB1 mRNA表达。
1.6 HMGB1、激活细胞凋亡蛋白酶3(caspase-3)表达检测 用HMGB1抗体(1∶1 000 稀释,Sigma,美国)和caspase-3抗体(1∶1 000 稀释,cell signaling,美国)通过定量免疫印迹分析细胞提取物。以内参GAPDH蛋白条带光密度值作为标准,采用Western blotting法计算HMGB1、激活caspase-3表达的相对量。
1.7 miR-451的作用靶点检测 采用荧光素酶法检测miR-451识别HMGB1 mRNA的3′端非编码区并抑制HMGB1表达的作用靶点。荧光素酶活性以HEK 293细胞中的Renil laluciferase作为标准,结果以Fluc/Rluc比值表示。
2 结果
2.1 miR-451对心肌细胞存活率、凋亡率的影响 见表1。
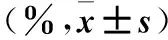
表1 五组心肌细胞存活率、凋亡率比较
注:与Con组比较,#P<0.05;与AR组比较,*P<0.05。
2.2 心肌细胞中HMGB1、激活caspase-3表达 染色结果显示,未行缺氧再复氧处理时,大多数HMGB1定位于细胞核内。在缺氧再复氧中,大部分HMGB1从细胞核迁移至细胞质内。miR-451的上调能减少HMGB1由胞核向胞质的迁移,而miR-451的下调并不影响迁移。五组心肌细胞HMGB1 mRNA、HMGB1、激活caspase-3表达差异。见表2。
2.3 miR-451的作用靶点 荧光素酶检测证实心肌细胞内HMGB1 mRNA是miR-451作用的一个靶基因。HMGB1 mRNA的3′端非编码区包含了miR-451结合序列或突变的miR-451结合序列,这个结构被克隆至荧光素酶报告基因中,并被转染至带有空质粒或表达miR-451质粒的HEK 293细胞中。miR-451可直接绑定至HMGB1 mRNA并抑制其表达。
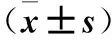
表2 五组心肌细胞HMGB1 mRNA、HMGB1和激活caspase-3表达比较
注:与Con组比较,#P<0.05;与AR组比较,*P<0.05。
3 讨论
以往研究显示,在乳腺癌、白血病、氧化应激等病理过程中miR-451对细胞的死亡及存活中发挥了重要作用[9,10]。本研究发现在心肌细胞缺氧再复氧中miR-451能抑制细胞凋亡并提高细胞的存活率。Ren等[6]发现在大鼠心肌缺血再灌注模型中,miR-451表达水平显著降低。近期研究显示,miR-144 和 miR-451过量表达均可增加心肌细胞存活,两者均可通过密码子绑定环氧合酶2途径发挥心肌缺血再灌注中心肌细胞保护作用。缺血预处理是减轻缺血再灌注损伤的一个经典有效的方法,Wang等[11]进一步发现缺血预处理并不能减轻miR-144/451基因敲除小鼠的缺血再灌注损伤。以上研究表明,过表达的miR-451在心肌缺血再灌注损伤模型中发挥保护作用。
HMGB1在肝、脑、肺、心脏缺血再灌注损伤中具有重要的作用[12]。一旦从坏死细胞或活化的免疫细胞释放出来,HMGB1可触发下游的炎症过程,并与其他促炎因子(如TNF-α、IL-6和C反应蛋白)相互作用,这些炎症因子最终导致细胞凋亡[13,14]。此外,已有研究证实,HMGB1是心肌缺血再灌注损伤早期的炎症介质,亦可以促进TNF-α、IL-6的释放[2]。HMGB1拮抗剂可以减少心肌缺血再灌注损伤并抑制TNF-α、IL-6的释放,提高心肌细胞的存活率。miRNA是基因表达的内源性调控因素。本研究显示,上调miR-451表达水平,心肌细胞HMGB1 mRNA、HMGB1、激活caspase-3表达降低,心肌细胞存活率增高、凋亡率降低。HMGB1 mRNA和蛋白水平改变水平的一致性提示,HMGB1可能是miR-451潜在的基因作用靶点,miR-451可能是通过抑制mRNA和阻碍翻译过程而抑制HMGB1的表达。本研究应用HMGB1 mRNA 3′端非编码区碎片与miR-451假定结合部位进一步证实了miR-451和HMGB1的关联性。miR-451通过抑制HMGB1的表达减轻心肌细胞缺氧再复氧损伤。
需要指出的是本研究具有以下局限性。首先,调控HMGB1是miR-451在心肌细胞缺氧再复氧损伤发挥保护作用的可能机制之一,预测软件已预测出大量miR-451调控的潜在靶点,因此需要进行更多的靶点确认实验。其次,本研究并未涉及到心肌细胞缺氧再复氧中miR-451调控HMGB1表达的分子机制,仍需更多的研究加以阐明。
[1] Zweier JL, Talukder MA. The role of oxidants and free radicals in reperfusion injury[J]. Cardiovasc Res, 2006,70(2):181-190.
[2] Andrassy M, Volz HC, Igwe JC, et al. High-mobility group box-1 in ischemia-reperfusion injury of the heart[J]. Circulation, 2008, 117(25):3216-3226.
[3]Tsung A, Sahai R, Tanaka H, et al. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion[J]. J Exp Med, 2005,201(7):1135-1143.
[4] Eulalio A, Huntzinger E, Izaurralde E. Getting to the root of miRNA-mediated gene silencing[J]. Cell, 2008,132(1):9-14.
[5] Perron MP, Provost P. Protein interactions and complexes in human microRNA biogenesis and function[J]. Front Biosci, 2008,13:2537-2547.
[6] Ren XP, Wu J, Wang X, et al. MicroRNA-320 is involved in the regulation of cardiac ischemia/reperfusion injury by targeting heat-shock protein 20[J]. Circulation, 2009,119(17):2357-2366.
[7] Cheng Y, Zhu P, Yang J, et al. Ischaemic preconditioning-regulated miR-21 protects heart against ischaemia/reperfusion injury via anti-apoptosis through its target PDCD4[J]. Cardiovasc Res, 2010,87(3):431-439.
[8] Ye Y, Hu Z, Lin Y, et al. Downregulation of microRNA-29 by antisense inhibitors and a PPAR-gamma agonist protects against myocardial ischaemia-reperfusion injury[J]. Cardiovasc Res, 2010,87(3):535-544.
[9] Bergamaschi A, Katzenellenbogen BS. Tamoxifen downregulation of miR-451 increases 14-3-3ζ and promotes breast cancer cell survival and endocrine resistance[J]. Oncogene, 2012,31(1):39-47.
[10] Lopotova T, Zackova M, Klamova H, et al. MicroRNA-451 in chronic myeloid leukemia: miR-451-BCR-ABL regulatory loop? [J]. Leuk Res, 2011,35(7):974-977.
[11] Wang X, Zhu H, Zhang X, et al. Loss of the miR-144/451 cluster impairs ischaemic preconditioning-mediated cardioprotection by targeting Rac-1[J]. Cardiovasc Res, 2012,94(2):379-390.
[12] Yang Z, Deng Y, Su D, et al. TLR4 as receptor for HMGB1-mediated acute lung injury after liver ischemia/reperfusion injury[J]. Lab Invest, 2013,93(7):792-800.
[13] Sha Y, Zmijewski J, Xu Z, et al. HMGB1 develops enhanced proinflammatory activity by binding to cytokines[J]. J Immunol, 2008,180(4):2531-2537.
[14] Xu H, Yao Y, Su Z, et al. Endogenous HMGB1 contributes to ischemia-reperfusion-induced myocardial apoptosis by potentiating the effect of TNF-α/JNK[J]. Am J Physiol, 2011,300(3):H913-921.
Protective effect of miR-451 on anoxia/reoxygenation injury in cardiomyocytes
HUXiaorong,XIEJing,MARuisong,LIAOYuanxi,LIXuefei,JIANGHong
(RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective To investigate the protective effect of microRNA-451 (miR-451) on anoxia/reoxygenation (A/R) injury in cardiomyotes and high mobility group box 1 protein (HMGB1) expression. Methods Neonatal rat ventricular cardiomyocytes were prepared and then subjected to A/R injury. Then they were divided into the control group (Con group), anoxia and reoxygenation group (AR group), AR+Ad-GFP group (empty virus group), AR+Ad-miR-451 group (miR-451 up-regulation group), AR+Ad-asmiR -451 group (miR-451 down-regulation group). We detected the cell viability, apoptosis rate, and the expression of Caspase-3 and HMGB1, HMGB1 mRNA. The luciferase assay was performed to further confirm MiR-451 targets for HMGB1.Results Compared with the Con group, the cell viability decreased, apoptosis index (AI) and the expression of Caspase-3, HMGB1 and HMGB1 mRNA increased in the other four groups (allP<0.05). Compared with AR group, cell viability increased, apoptosis index (AI) and the expression of Caspase-3, HMGB1 and HMGB1 mRNA decreased in the Ad-miR-451 group (allP<0.05). The luciferase assay confirmed that the 3'UTR of HMGB1 mRNA was a direct target of miR-451 in cardiomyocytes, which inhibited the expression of HMGB1. Conclusion The up-regulation of miR-451 could protect A/R injury-induced cardiomyocytes by inhibiting HMGB1 expression through miR-451.
cardiomyocytes; anoxia/reoxygenation injury; microRNA-451; high mobility group box 1 protein
国家自然科学基金资助项目(81370308)。
胡笑容(1981-),男,副主任医师,博士,主要研究方向为缺血性心肌病和介入心脏病学。E-mail:huxrwurm@163.com
江洪(1956-),男,主任医师,博士生导师,博士,主要研究方向为介入心脏病学和心电生理。E-mail:Jianghwurm@163.com
胡笑容,谢菁,马瑞松,廖芫熙,李雪飞,江洪
(武汉大学人民医院,武汉430060)
10.3969/j.issn.1002-266X.2017.17.001
R541.4
A
1002-266X(2017)17-0001-03
2016-09-14)
