不同预后的重症肺炎患者住院期间血清和肺泡灌洗液TLR4水平、外周血免疫细胞计数比较
2017-06-05赵丹宁睿王春艳杨国辉
赵丹,宁睿,王春艳,杨国辉
(1贵州大学医学院,贵州550000;2贵州省人民医院;3贵州省呼吸疾病研究所;4贵州医科大学附属医院)
不同预后的重症肺炎患者住院期间血清和肺泡灌洗液TLR4水平、外周血免疫细胞计数比较
赵丹1,2,3,宁睿4,王春艳4,杨国辉4
(1贵州大学医学院,贵州550000;2贵州省人民医院;3贵州省呼吸疾病研究所;4贵州医科大学附属医院)
目的 观察比较不同预后的重症肺炎患者住院期间血清和肺泡灌洗液Toll样受体4(TLR4)水平、外周血免疫细胞计数[CD3+T、CD4+T、CD8+T、CD19+%、T淋巴细胞+B淋巴细胞+NK细胞计数(T+B+NK计数)]。方法 内科ICU住院治疗的重症肺炎患者43例,根据住院28 d内的转归(存活或死亡)将患者分为生存组25例、死亡组18例。分别于入院第1、7天采用ELISA法检测血清及肺泡灌洗液中的TLR4,采用流式细胞仪检测外周血CD3+T、CD4+T、CD8+T、T+B+NK计数、CD19+%。结果 死亡组入院第7天血清、肺泡灌洗液中TLR4水平高于生存组(P均<0.05)。死亡组入院第1天CD19+%高于生存组,入院第7天CD3+T、CD4+T、CD8+T计数及CD19+%低于生存组(P均<0.05)。结论 入院28 d内死亡的重症肺炎患者较生存患者TLR4水平升高,CD3+T、CD4+T、CD8+T计数及CD19+%下降;TLR4水平升高和免疫功能下降的重症肺炎患者预后不良。
重症肺炎;Toll样受体4;免疫细胞
重症肺炎是临床常见的急危重症,可并发肺部损伤、多器官衰竭、脓毒症、全身炎症反应综合征(SIRS)等,是ICU患者死亡的重要原因之一[1]。重症肺炎高病死率与患者促炎因子/抗炎因子失衡、免疫功能低下等有关[2]。Toll样受体4(TLR4)属于Ⅰ型跨膜信号转导受体,是连接先天免疫和特异性免疫的纽带。TLR4通过识别脂多糖(LPS)等病原相关的分子模式及某些内源性配体引发信号级联反应,导致炎症反应,促进抗原呈递细胞成熟,调控获得性免疫反应[3]。研究表明,TLR4表达水平与糖尿病患者的预后有一定关联[4]。本研究观察比较了不同预后的重症肺炎患者TLR4水平、免疫细胞计数[CD3+T、CD4+T、CD8+T、CD19+%、T淋巴细胞+B淋巴细胞+NK细胞计数(T+B+NK计数)],分析重症肺炎患者TLR4水平及免疫功能对预后的影响。
1 资料与方法
1.1 临床资料 在贵州医科大学内科ICU住院治疗的重症肺炎患者43例,重症肺炎诊断参照2007年美国感染性疾病协会(IDSA)/美国胸科协会(ATS)标准[5]。基础疾病分别为医院获得性肺炎、慢性阻塞性肺疾病急性加重期、社区获得性肺炎、急性呼吸窘迫综合症、支气管哮喘急性发作。病原学检查以痰培养为主,依次为铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌、大肠杆菌、金黄色葡萄球菌等。所有研究对象家属签署知情同意书。本研究遵循贵州医科大学附属医院制定的伦理学标准,并得到伦理委员会的批准。根据住院28 d内的转归(存活或死亡)将患者分为生存组25例、死亡组18例。生存组男14例、女11例,年龄(72.8±14.3)岁;死亡组男10例、女8例,年龄(73.1±15.6)岁。两组性别、年龄差异无统计学意义。生存组和死亡组入住ICU 24 h内急性生理学及慢性健康状况(APACHE Ⅱ)评分分别为(17.34±5.28)、(24.18±4.09)分,两组相比,P<0.05。
1.2 血清、肺泡灌洗液中TLR4检测 分别于入院第1、7天取患者非抗凝的外周静脉血2 mL,右肺中叶(或影像学检查所示病灶部位)的肺泡灌洗液20 mL。
将静脉血及肺泡灌洗液3 000 r/min离心20 min,取上清液1 mL。采用ELISA法检测TLR4。
1.3 免疫细胞计数测算 分别于第1、7天取患者抗凝外周静脉血2 mL,采用流式细胞仪检测CD3+T、CD4+T、CD8+T、T+B+NK计数及CD19+%。
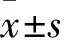
2 结果
2.1 生存组、死亡组血清及肺泡灌洗液TLR4水平比较 死亡组入院第7天血清、肺泡灌洗液中TLR4水平高于生存组(P均<0.05)。同组内第1、7天血清、肺泡灌洗液中TLR4水平差异无统计学意义。见表1。

表1 生存组、死亡组血清及肺泡灌洗液中TLR4水平比较
注:与生存组相比,*P<0.05。
2.2 生存组、死亡组免疫细胞计数比较 死亡组入院第1天CD19+%高于生存组,入院第7天CD3+T、CD4+T、CD8+T计数及CD19+%低于生存组(P均<0.05)。同组内第1、7天相比差异无统计学意义。见表2。
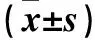
表2 生存组和死亡组CD3+T、CD4+T、CD8+T、T+B+NK计数及CD19+%比较
注:与生存组相比,*P<0.05。
3 讨论
重症肺炎引起强烈的SIRS和代偿性抗炎反应综合征(CARS),诱发多脏器功能障碍综合征(MODS)。病原菌感染是肺炎的主要病因,约占80%以上[6]。TLRs的信号传导通过MyD88依赖途径和MyD88非依赖途径,MyD88依赖途径是信号转导的经典途径,主要通过介导NF-κB和促炎细胞因子的产生激发下游炎症效应。TLR4作为天然免疫跨膜信号转导受体,与其特异性配体结合后在细胞内募集MyD88,通过其特异的接头蛋白(MAL)与MyD88桥接,接受信号蛋白IL-1受体相关激酶(IRAK),与肿瘤坏死因子受体相关因子6(TRAF6)相互作用,产生TNF-α、IL-6等多种炎症因子,导致NF-κB激活[7],触发细胞内信号传递,合成并释放一系列细胞因子和炎性介质,诱发炎症反应[8]。王婷等[9]研究发现,重症肺炎导致肾衰竭患者外周血TLR4水平高于正常。本研究中死亡组入院第7天血清、肺泡灌洗液中TLR4水平明显升高,考虑与机体重症感染时天然免疫跨膜信号转导受体表达上调,导致下游促炎因子大量释放,进一步加重病情有关。
重症肺炎时致病微生物引起肺部上皮细胞及间质的结构、功能损害,另一方面机体防御反应过度,可出现代偿性免疫功能障碍,通过多因素、多环节改变引发瀑布级联反应,后者是患者死亡的重要原因[10]。细菌感染可导致CD4+T细胞分化成为Th1细胞,激活并放大免疫反应[11]。T细胞的免疫调节作用主要通过CD4+T细胞、CD8+T细胞完成。CD3+T细胞分布于所有成熟的T细胞膜上,协助T细胞抗原受体转导抗原信息,活化T细胞。CD19在B细胞活化过程中不消失,其表达水平代表B细胞功能水平。研究[12]报道,重症肺炎患儿的CD3+T、CD3+CD4+T及CD3+CD8+T计数下降显著。本研究结果显示,重症肺炎死亡患者CD3+T、CD4+T、CD8+T、T+B+NK计数均下降,CD19+%下降。CD4+T细胞减少时介导细胞免疫及局部炎症效应减弱,清除细胞内病原体的能力下降。CD8+T细胞减少后,抑制细胞毒性的作用减弱,引起更严重的病理损害。CD3+T细胞减少,T细胞活化减少,机体细胞免疫功能进一步降低。CD19+%下降说明合并体液免疫功能减弱。同时,病原菌不断激活TLR4,T细胞诱导共刺激分子(ICOS)表达上调[13],免疫偏移[14],病情进一步恶化。
局部TLR4的激活可引发适度而协调的炎症反应,使感染局限。TLR4表达缺陷或反应低下可导致机体对革兰阴性细菌易感,但TLR4强烈激活则会引起瀑布级联反应[15]。研究[16]表明,肺炎克雷伯菌感染可以上调气道上皮TLR2、TLR4的表达。本研究结果显示,重症肺炎患者死亡组入院第7天血清及肺泡灌洗液中TLR4水平明显升高,考虑重症肺炎状态下TLR4识别革兰阴性菌的磷壁酸、热休克蛋白(HSP)60、呼吸道合胞病毒的融合蛋白等多种内源性和外源性配体[17],TLR4强烈激活,释放大量的炎症因子(TNF-α、IL-1、IL-6等)、脂质炎性介质(血栓素、血小板激活因子、白三烯等)、一氧化氮、氧自由基等,从而加重细胞和组织损伤,加剧病情,预后不良[18]。
综上,重症肺炎患者TLR4水平升高、细胞免疫功能下降,往往导致预后不良。抑制TLR4介导的炎症瀑布效应,提高患者细胞免疫及体液免疫功能,对减少重症肺炎病死率、改善预后具有重要意义。但本研究入选患者数有限,检测的免疫指标较少,结论难免有局限性,期待进一步研究证实。
[1] 王霞,蒋红信,国丹,等.气管镜下给药治疗64例重症肺炎的临床效果观察[J].吉林医学,2014,35(20):4506-4506.
[2] Rocca YS, Roberti MP, Arriaga JM, et al. Altered phenotype in peripheral blood and tumor-associated NK cells from colorectal cancer patients[J]. Innate Immun, 2013,19(1):76-85.
[3] Wasaki A, Medzhitov R. Toll-like receptor control of the adaptive immune responses[J]. Nat Immunol, 2004,5(10):987-995.
[4] 陈海英,安伶,叶盛开,等.阿托伐他汀对2型糖尿病患者外周血单核细胞TLR-4表达的影响[J].临床军医杂志,2012,40(2):347-350.
[5] Mandell LA, Wtmderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guide-lines on the management of community-acquired pneumonia in adults [J]. Clin Infect Dis, 2007,44(Suppl 2):S27-S72.
[6] Crooks N, Rose T, Grant S, et al. A severe pneumonia due to methicillin resistant Staphylococcus aureus clone USA 300:implications of vertical transmission[J]. West Indian Med J, 2012,61(2):145-147.
[7] McIsaac SM, Stadnyk AW, Lin T. Toll-like receptors in the host defense against Pseudomonas aeruginosa respiratory infection and cystic fibrosis[J]. J Leuk Biol, 2012,92(5):977-985.
[8] Heumann D, Roger T.Initial responses to endotoxins and Gram-negative bacteria[J]. Clinica Chimca Acta, 2002,323(1-2):59-72.
[9] 王婷,张燕,李保华.联系肾脏替代治疗对重症肺炎所致急性肾损伤患者TLR2和的影响TLR4的表达[J].新疆医科大学学报,2017,40(2):188-191.
[10] 魏莉,白洁,王丽,等.免疫治疗对重症肺炎患者免疫功能指标的影响研究[J].中华医院感染学杂志,2014,24(12):2871-2873.
[11] Bruhn KW, Pantapalangkoor P,Nielsen T, et al. Host Fate is Rapidly Determined by Innate Effector-Microbial Interactions During Acinetobacter baumannii Bacteremia[J]. J Infect Dis, 2015,211(8):1296-1305.
[12] 龙思琪,马莉,陈敏,等.婴幼儿重症和非重症肺炎淋巴细胞亚群的差异分析[J].中国免疫学杂志,2016,32(3):401-404.
[13] Shalaby KH, Jo T, Nakada E, et al. ICOS-expressing CD4 T cells induced via TLR4 in the nasal mucosa are capable of inhibiting experimental allergic asthma[J]. J Immunol, 2012,189(6):2793-2804.
[14] 王瑜,丁晓霞,胡孝彬,等.CHB患者CD4+T细胞ICOS表达及其与干扰素治疗的相互关系[J].中华微生物学和免疫学杂志,2012,32(2):124-127.
[15] Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo veritas[J]. J Clin Invest, 2012,122(3):787-795.
[16] Regueiro V, Moranta D, Campos MA, et al. Klebsiella pneumoniae increases the levels of Toll-like receptors 2 and 4 in human airway epithelial cells[J]. Infect Immun, 2009,77(2):714-724.
[17] Glasser SW, Maxfield MD, Ruetschilling TL, et al. Persistence of LPS-induced lung inflammation in surfactant protein-C-deficient mice[J]. Am J Respir Cell Mol Biol, 2013,49(5):845-854.
[18] Starkhammar M, Larsson O, Kumlien Georén S, et al. Toll-like receptor ligands LPS and poly (I:C) exacerbate airway hyperresponsiveness in a model of airway allergy in mice, independently of inflammation[J]. PLoS One, 2014,9(8):e104114.
贵阳市科技合作计划资助项目(2011103)。
杨国辉(E-mail: guohuiy2006@126.com)
10.3969/j.issn.1002-266X.2017.15.030
R563.1
B
1002-266X(2017)15-0096-03
2017-01-05)
