宫颈癌切除术患者术后羟考酮静脉自控镇痛效果及免疫功能观察
2017-06-05林颖卢建华陈霞
林颖,卢建华,陈霞
(广西医科大学第四附属医院暨柳州市工人医院,广西柳州545005)
宫颈癌切除术患者术后羟考酮静脉自控镇痛效果及免疫功能观察
林颖,卢建华,陈霞
(广西医科大学第四附属医院暨柳州市工人医院,广西柳州545005)
目的 观察羟考酮静脉自控镇痛的宫颈癌切除术患者术后镇痛情况及免疫功能。方法 60例择期行腹腔镜下宫颈癌根治术的宫颈癌患者,随机分为观察组和对照组各30例。两组均行腹腔镜下宫颈癌根治术。术后观察组采用羟考酮静脉自控镇痛,对照组采用芬太尼静脉自控镇痛,共治疗2 d。分别于术后12、24、48 h时采用视觉模拟疼痛评分(VAS)评价两组术后疼痛情况。分别于术前30 min、术后24 h、术后48 h、术后72 h采集两组外周静脉血4 mL,采用流式细胞法检测两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比;采用ELISA法检测两组血清干扰素γ(IFN-γ)、白细胞介素10(IL-10)。结果 术后12、24、48 h时观察组VAS评分分别为(3.50±0.51)、(3.07±0.67)、(2.96±0.62)分,对照组分别为(3.17±0.38)、(2.93±0.58)、(2.80±0.48)分,术后12 h观察组VAS评分高于对照组,P<0.05。术后48、72 h观察组外周血 CD4+、CD8+T细胞百分比高于对照组(P均<0.05),术后24、48、72 h观察组外周血NK细胞百分比高于对照组(P均<0.05)。术后48、72 h观察组血清IFN-γ水平低于对照组(P均<0.05)。术后24、48、72 h观察组血清IL-10水平高于对照组(P均<0.05)。结论 宫颈癌切除术患者术后羟考酮静脉自控镇痛效果较好。羟考酮静脉自控镇痛可改善患者术后免疫功能,减轻炎症反应。
宫颈癌;宫颈癌切除术;术后镇痛;羟考酮静脉自控镇痛
宫颈癌是最常见的妇科恶性肿瘤之一,手术切除是最主要的治疗方法。但宫颈癌术后易出现转移和复发,严重影响患者预后。研究[1]认为,宫颈癌术后转移复发除了与肿瘤组织病理学、病理分期相关以外,还与肿瘤患者围术期的免疫功能密切相关。手术应激情况、麻醉因素[1]均与围术期免疫抑制有关。麻醉因素包括麻醉方式、麻醉药物和术后镇痛药物,麻醉镇痛药物可通过间接免疫抑制,影响肿瘤的复发和转移。羟考酮是一种新型阿片类镇痛药物,具μ、κ受体双重激动作用,主要作用于中枢神经系统及平滑肌,可有效缓解内脏疼痛,是多模式镇痛的基础用药[2]。近来研究[3]认为羟考酮术后镇痛可促进术后机体免疫功能的恢复。目前关于羟考酮静脉自控镇痛在宫颈癌中的应用相关报道较少。我们观察了宫颈癌切除术患者术后羟考酮静脉自控的镇痛效果及其对患者免疫功能的影响。现将结果报告如下。
1 资料与方法
1.1 临床资料 选择我科收治的择期行腹腔镜下宫颈癌根治术的患者60例,均经术后病理学检查证实为宫颈癌,术前均未接受任何放、化疗治疗。60例患者采用随机数字表法随机分为观察组和对照组各30例。观察组年龄(51.43±7.65)岁,肿瘤分期为Ⅰa期10例、Ⅰb期13例、Ⅱa期5例、Ⅱb期2例;对照组年龄(53.33±6.34)岁,肿瘤分期为Ⅰa期12例、Ⅰb1期14例、Ⅱa期3例、Ⅱb期1例。两组年龄、肿瘤分期等临床资料具有可比性。两组均行腹腔镜下宫颈癌根治术。麻醉诱导方法:咪达唑仑0.08 mg/kg,丙泊酚1.5~2.5 mg/kg,罗库溴铵库铵0.6 mg/kg,舒芬太尼 0.5~0.6 μg/kg,待患者血压心率平稳后行气管内插管并固定,机械通气呼吸参数8~10 mL/kg,呼吸频率10~15次,吸呼比1∶2,维持呼气末二氧化碳分压在35~45 mmHg。麻醉维持:BIS值40~60,根据BIS值监测,控制丙泊酚血浆靶浓度2.0~4.0 μg/mL,瑞芬太尼2.0~6.0 ng/mL,予顺阿曲库铵0.03 mg/kg。本研究经本院伦理委员会批准同意,所有患者知情同意并签署知情同意书。
1.2 术后镇痛方法 观察组采用羟考酮静脉自控镇痛,盐酸羟考酮注射液5 mg溶于生理盐水5 mL,术后1~2 min静脉推注完成,可重复给药至患者 VAS 评分≤4分,开启镇痛泵,配方为羟考酮20 mg+生理盐水注射液,共计150 mL,2 mL/h,给药间隔10 min。对照组采用芬太尼静脉自控镇痛,静脉推注芬太尼注射液 0.1 mg,可重复给药至患者VAS 评分≤ 4 分,开启镇痛泵,配方为芬太尼0.01 mg/kg+生理盐水注射液,共计150 mL,2 mL/h,给药间隔 10 min。两组术后均连续镇痛2 d。
1.3 观察指标及方法 分别于术后12、24、48 h时采用视觉模拟疼痛评分(VAS)评价两组术后疼痛情况。0分表示无痛,1~4分为轻度疼痛但对患者睡眠质量无影响,10分表示剧烈的难以忍受的疼痛。分别于术前30 min、术后24 h、术后48 h、术后72 h采集两组外周静脉血4 mL,采用流式细胞法检测两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比;采用ELISA法检测两组血清干扰素γ(IFN-γ)、白细胞介素10(IL-10)。所有操作均严格按照使用说明书进行。观察记录两组镇痛过程中不良反应发生情况,如呼吸抑制(呼吸时SpO2<90%或PR<8次/min),恶心、呕吐、头晕、瞌睡及皮肤瘙痒等。
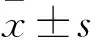
2 结果
2.1 两组VAS评分比较 术后12、24、48 h时两组VAS评分比较见表1。

表1 术后12、24、48 h时两组VAS评分比较(分
注:与对照组比较,#P<0.05。
2.2 两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比比较 不同时间两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比比较见表2。
2.3 两组血清IFN-γ、IL-10水平比较 不同时点两组血清IFN-γ、IL-10水平比较见表3。
2.4 不良事件发生情况 治疗中观察组共发生呼吸抑制9例、恶心呕吐2例、头晕8例、嗜睡2例、皮肤瘙痒3例,对照组分别为4、9、11、13、11例,观察组不良事件发生率低于对照组,P<0.05。
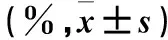
表2 不同时间两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比比较
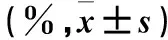
表2 不同时间两组外周血 CD3+、CD4+、CD8+T细胞和NK细胞百分比比较
注:与对照组同时点比较,#P<0.05。

表3 不同时间两组血清IFN-γ、IL-10水平比较
注:与对照组同时点比较,#P<0.05。
3 讨论
阿片类受体是一种G蛋白偶联型受体,广泛存在于中枢和外周神经系统,且在多种组织中也有表达,其在痛觉生理中发挥重要作用[4,5]。阿片受体有三种受体亚型:μ受体、δ受体和κ受体,这三种受体亚型的内源性配体各不相同,其中μ受体的镇痛效应最显著,其内源性配体属于内啡肽,在镇痛的同时还能显著抑制呼吸与心率[6],而δ受体的内源性配体是脑啡肽,尽管其镇痛效果不明显,但是却能促进心脏的缺血性预适应[7];κ受体的内源性配体则是强啡肽,镇痛效果较强,具有一定的致焦虑效应,但是对呼吸抑制的作用较弱[8]。巨噬细胞、T淋巴细胞、多核白细胞等人体免疫系统细胞均存在阿片受体[9]。阿片类药物可以直接通过免疫细胞表面的阿片类受体影响免疫功能,因而表现出免疫调控和抗炎特性[10,11]。内源性和外源性阿片类物质的免疫调节作用不同,这可能是由于不同阿片类物质与不同阿片类受体的亲和力不同。由免疫细胞分泌产生的阿片肽能够与阿片受体发生结合而产生免疫性镇痛作用,这类包括吗啡和芬太尼等的药物所产生的镇痛机制主要是通过外源性或内源性阿片肽的激活从而在外周和中枢神经系统中产生较强的镇痛作用,特别是在机体有炎症的情况下镇痛效应更为明显[12]。
芬太尼是一种人工合成的阿片类镇痛药物,其镇痛强度约是吗啡的80倍,目前广泛的作为麻醉用药和术后镇痛药物[13]。研究[14]发现,大剂量芬太尼对免疫细胞的活性有明显的抑制作用,甚至在术后48 h,NK细胞仍未恢复到术前水平。既往研究[15,16]认为,吗啡和芬太尼等阿片类药物抑制疼痛和调节免疫系统的机制与一系列神经内分泌和应激系统相关,其中最重要的是下丘脑-垂体-肾上腺轴系统的活化,该轴的活化与下丘脑、垂体和肾上腺之间存在相互作用的关系,通过产生神经内分泌激素调节机体的反应应激程度,从而对免疫系统发挥抑制效应。而后续研究发现,免疫细胞中存在阿片受体,阿片肽可结合免疫细胞中阿片受体,直接调控免疫应答过程中的细胞功能[17,18],从而实现免疫抑制效应。羟考酮是一种新型的阿片类药物,具μ、κ受体双重激动作用,主要作用于中枢神经系统及平滑肌[2],对内脏痛镇痛效果确切,本研究结果也证实了羟考酮具有明显的镇痛效果,尽管在术后12 h时观察组VAS评分高于对照组,但均为轻度疼痛。柏刚等[19]通过对60例接受肱骨骨折切开复位内固定的患者进行研究,发现与吗啡相比,羟考酮可明显增加肱骨内固定术患者术后血清IL-2水平,提示其能提高机体免疫功能。有研究表明,羟考酮超前镇痛能够显著抑制肱骨骨折手术患者术后血清TNF-α、IL-6水平的升高,减轻静脉血CD4+T细胞和CD8+T细胞百分比,具有减少炎症损伤,保护免疫功能的作用[3]。胡建等[20]研究发现,术前静脉注射羟考酮0.15 mg/kg可促进强效免疫抑制性细胞因子IL-10的释放,调节细胞因子水平和免疫功能,维持促炎与抗炎细胞因子平衡,减轻术后炎症反应。本研究发现,术后48、72 h观察组外周血 CD4+、CD8+T细胞百分比高于对照组,术后24、48、72 h观察组外周血NK细胞百分比高于对照组。术后48、72 h观察组血清IFN-γ水平低于对照组,术后24、48、72 h观察组血清IL-10水平高于对照组。说明观察组体内炎症反应较轻,且观察组不良反应发生情况轻于对照组。
综上所述,宫颈癌切除术患者术后羟考酮静脉自控镇痛效果较好。羟考酮静脉自控镇痛可提高患者术后免疫功能,减轻炎症反应。
[1] Beilin B, Rusabrov Y, Shapira Y, et al. Low-dose ketamine affects immune responses in humans during the early postoperative period[J]. Br J Anaesth, 2007,99(4):522-527.
[2] 吴周全,邹志清,陈勇,等.不同剂量羟考酮对腹部手术后急性疼痛的抑制作用[J].临床麻醉学杂志,2015,31(2):161-163.
[3] Boland JW, Foulds GA, Ahmedzai SH, et al. A preliminary evaluation of the effects of opioids on innate and adaptive human in vitro immune function[J]. BMJ Support Palliat Care, 2014,4(4):357-367.
[4] 杨欢,鲍静影,蒋苗苗,等. 阿片受体激动剂的镇痛作用及其靶点通路研究进展[J].安徽医药,2017,21(02):211-215.
[5] 杨杰,雷跃昌,金健,等.开胸手术术后镇痛方法研究进展[J].山东医药,2016,56(6):96-98.
[6] 李擎,刘勇,于洋,等.μ阿片受体A118G基因多态性预测盐酸羟考酮的镇痛效果[J]. 医药导报,2016,35(05):481-484.
[7] 李玖玲,孔庆宏,郁洁,等. 阿片受体三重激动剂KUST201的大鼠镇痛、耐受与戒断反应研究[J].中国药理学通报,2016,32(05):652-658.
[8] 徐建国.盐酸羟考酮的药理学和临床应用[J].临床麻醉学杂志,2014,30(5):511-513.
[9] Odunayo A, Dodam JR, Kerl ME, et al. Immunomodulatory effects of opioids[J]. J Vet Emerg Crit Care, 2010,20(4):376-385.
[10] Bidlack JM. Detection and function of opioid receptors on cells from the immune system[J]. Clin Diagn Lab Immunol, 2000,7(5):719-723.
[11] Kapitzke D, Vetter I, Cabot PJ, et al. Endogenous opioid analgesia in peripheral tissues and the clinical implications for pain control[J]. Ther Clin Risk Manag, 2005,1(4):279-297.
[12] 王晶,陈涛,万信念,等.阿片受体-阿片肽的免疫镇痛作用[J].中国疼痛医学杂志,2013,19(12):747-750.
[13] Ding Z, Wang K, Wang B, et al. Efficacy and tolerability of oxycodone versus fentanyl for intravenous patient-controlled analgesia after gastrointestinal laparotomy: A prospective, randomized, double-blind study[J]. Medicine (Baltimore), 2016,95(39):4943.
[14] Yardeni IZ, Beilin B, Mayburd E, et al. Relationship between fentanyl dosage and immune function in the postoperative period[J]. J Opioid Manag, 2008,4(1):27-33.
[15] Kershaw SG, Della M, Vedova CB, et al. Acute opioid administration induces hypothalamic- pituitary-adrenal activation and is mediated by genetic variation in interleukin (Il)1B[J]. Pharmacol Biochem Behav, 2015,138(15):9-13.
[16] Valverde-Filho J, ,Cunha D,Neto MB, et al. Chronic spinal and oral morphine-induced neuroendocrine and metabolic changes in noncancer pain patients[J]. Pain Med, 2015,16(4):715-725.
[17] Mosińska P, Zielińska M, Fichna J. Expression and physiology of opioid receptors in the gastrointestinal tract[J]. Curr Opin Endocrinol Diabetes Obes, 2016,23(1):3-10.
[18] Galligan JJ, Sternini C. Insights into the Role of Opioid Receptors in the GI Tract: Experimental Evidence and Therapeutic Relevance[J]. Handb Exp Pharmacol, 2017,239(7):363-378.
[19] 柏刚,郭绍明,李锋,等.羟考酮对肱骨骨折术后镇痛的影响[J].临床麻醉学杂志,2015,31(5):469-471.
[20] 胡建,许建峰,刘耿,等.不同剂量羟考酮术前用药对腹腔镜胆囊切除术后疼痛及炎症细胞因子的影响[J].临床麻醉学杂志,2015,31(10):941-944.
广西壮族自治区卫生和计划生育委员会自筹经费科研课题(z2016186)。
卢建华(E-mail: lllyyy-lover@163.com)
10.3969/j.issn.1002-266X.2017.19.018
R614.1
B
1002-266X(2017)19-0060-03
2016-12-07)
