微电场通过非整合素途径活化粘着斑激酶促进滋养细胞迁移/侵袭研究
2017-06-05张娟李明勇贺元白怀范平
张娟,李明勇,贺元,白怀,范平
(1.四川省医学科学院·四川省人民医院检验科,四川成都610072; 2.四川大学华西第二医院/西部妇幼医学研究院,四川成都610041)
微电场通过非整合素途径活化粘着斑激酶促进滋养细胞迁移/侵袭研究
张娟1,李明勇1,贺元1,白怀2,范平2
(1.四川省医学科学院·四川省人民医院检验科,四川成都610072; 2.四川大学华西第二医院/西部妇幼医学研究院,四川成都610041)
目的 探讨生理性微电场促进体外培养的人胎盘滋养细胞迁移/侵袭功能是否与滋养细胞表面整合素(integrin)表达有关。方法 用150 mV/mm的直流微电场刺激滋养细胞,时间分别为5、10和15 h,测定其迁移情况并观察细胞形态变化。Western blot检测刺激前后1 h内粘着斑激酶FAK活化情况和细胞表面integrinα1、integrinα5、integrinαV和integrinα1蛋白表达水平。结果 在含有10%胎牛血清的培养基中,150 mV/mm电场刺激下滋养细胞向负极定向迁移,迁移速度和距离较对照组明显增加(P= 0.021),胞体拉长,垂直于电场方向排列;胞内FAKTyr397位点于刺激后5、10、30、60 min内迅速活化并逐渐加强(P<0.05);刺激前后滋养细胞表面integrinα1、integrinα5、integrinαV、和integrinα1蛋白表达水平无明显改变(P> 0.05)。结论 生理性直流微电场可能通过非整合素途径活化FAK从而促进滋养细胞迁移/侵袭功能,但其详细机制仍需进一步研究。
微电场;滋养细胞;整合素;粘着斑激酶;迁移/侵袭
生物电现象是生命活动的基本属性,在机体的一切生命活动中都伴随着生物电的产生[1]。研究结果显示,生理强度的直流微电场(direct current electric field,DCEF)可介导包括微血管内皮细胞、大血管内皮细胞、骨髓间充质干细胞等在内的多种细胞的定向迁移。关于细胞对微电场的应激反应,可能与细胞表面相关受体重排、离子通道开放、胞内骨架蛋白及细胞器极化排列以及胞内多条信号传导通路活化密切相关,但不同类型的细胞应答特性有所不同[2~4]。我们前期的研究结果发现[5~7],微电场中培养的滋养细胞在常氧和缺氧条件下均能产生定向运动和垂直于电场方向排列的应答反应,提示微电场可能作为一种重要的信号促进滋养细胞的迁移/侵袭等功能。
整合素是细胞表面一种重要的粘附分子和跨膜蛋白大家族,由α和β两种亚基构成的异二聚体。相关研究发现,滋养层细胞早期侵入子宫内膜与细胞表面特异性整合素的表达密切相关[8~10]。黏着斑激酶(focal adhesion kinase,FAK)是一种非受体蛋白酪氨酸激酶,在生长因子和整合素介导的细胞黏附和迁移以及信号转导途径中起着关键的作用[5~7],但微电场促进滋养细胞的迁移/侵袭功能是否与滋养细胞表面整合素表达相关,国内外尚未见其它报道。因此,本实验拟研究微电场刺激是否通过滋养细胞表面整合素途径活化FAK进而促进滋养细胞的迁移/侵袭功能。
1 材料与方法
1.1 材料与试剂 人胎盘滋养细胞HTR-8/Svneo,由四川大学华西二院彭冰教授惠赠。RPMI-1640培养基、胎牛血清、100 U/ml青霉素、100 μg/ml链霉素均购自GIBCO公司,兔抗人integrinα1、integrinα5、integrinαV和integrinα1单克隆抗体均购自博士德公司,兔抗人总FAK抗体、兔抗人磷酸化FAK 397位点(p-FAKTyr397)抗体、兔抗人磷酸化FAK 576/577位点(p-FAK pY576/577) 抗体、兔抗人磷酸甘油醛脱氢酶(GAPDH)抗体和辣根过氧化物酶(HRP) 标记的羊抗兔Ig G(H + L) 二抗均购自Cell Signaling 公司。FITC-Phalloidin和DAPI均购自Sigma公司。十二烷基硫酸钠(SDS)、甘氨酸、二硫苏糖醇(DTT) 以及RIPA裂解液、BCA 法蛋白质定量测定试剂盒、电场组装相关材料(3140胶,Dow Corning硅酮胶、万用电表、电线、铜丝、银丝、2 mL空针、盖玻片、细胞培养皿) 均购自溶海生物公司。DYY-2C 型直流电泳仪(北京六一仪器厂),E200 光 学 显 微 镜 (Nikon公司),Quantity one 凝胶成像仪(Bio-Rad 公司) 。
1.2 实验方法
1.2.1 滋养细胞的培养及加电 具体操作方法同文献[5]所述。在本实验中,对培养小室内HTR-8/SVneo细胞以150 mV/mm微电场分别刺激5、10和15 h作为实验组,FAK的活化水平检测电刺激时间分别为5、10、30、60 min。以同样培养条件下不加电组作为对照组。加电完成后收集细胞,BCA法测定蛋白浓度。
1.2.2 Western blot 具体操作方法同文献[6]所述。此次 Western blot 时蛋白质上样量均为30μg,经10% SDS-PAGE 70 V 恒压电转移至聚偏二氟乙烯(PVDF)膜上,50 g/L 脱脂奶粉震荡封闭1 h,然后分别加入兔抗人integrinα1、integrinα5、integrinαV和integrinα1抗体(均为 1∶500稀释),4 ℃孵育过夜,清洗,HRP 标记的羊抗兔Ig G(H + L) 二抗(1∶1 000 稀释) 室温震荡孵育2 h,清洗,化学发光ECL显色试剂盒显色,放入凝胶成像仪扫描显色条带并拍照存档,Quantity one 软件分析计算各条带的灰度比值,以GAPDH 或总FAK表达量作为内参照。整合素相对表达量=目的蛋白灰度值/GAPDH 灰度值,FAK相对活化值=FAK磷酸化灰度值/FAK总灰度值。
1.3 统计学方法 采用SPSS 20.0统计学软件进行数据分析。计量资料以均数±标准差表示。组间比较采用t检验或单因素方差分析。P< 0.05为差异有统计学意义。
2 结果
2.1 微电场对滋养细胞迁移行为的影响 课题组前期研究结果显示[5~7],在含有10%胎牛血清的培养基中应用150 mV/mm的直流电场刺激滋养细胞,滋养细胞呈现特定的应答反应,比如,细胞由正极向负极定向迁移,经不同迁移时间统计分析,滋养细胞的迁移距离和迁移速度明显高于同样条件下未加电场刺激的对照组细胞(P= 0.021)。在电场分别刺激10 h后,滋养细胞形态发生了明显改变,比如胞体明显拉伸延长,且随电刺激时间延长细胞纵轴/横轴比值增大。对胞内骨架蛋白和细胞核分别用FITC- Phalloidin和DAPI染色后结果显示,电场刺激后滋养细胞骨架蛋白F-actin逐渐由无序随机排列转为垂直于电场方向排列,未加电场刺激组细胞迁移方向随机,无上述反应,见图1。

图1 微电场对滋养细胞迁移行为的影响 a:电刺激前细胞形态;b:电刺激10 h后细胞垂直于电场方向排列;c:电刺激前细胞荧光染色图;d:电刺激后细胞荧光染色图
2.2 微电场对滋养细胞迁移/侵袭相关FAK磷酸化活性的影响 研究表明,FAK在介导整合素与胞内信号通路活化中起着关键性作用。本研究采用western blot 对微电场刺激滋养细胞胞内FAK的活化水平进行了检测。首先对FAK的主要磷酸化位点,即自主磷酸化FAK Tyr397位点进行检测,结果显示,该位点对电场反应迅速,于5 min内开始出现磷酸化,在10、30、60 min各时间点磷酸化水平迅速升高,条带灰度值与总FAK相比分别为(4.76±0.04)、(6.89±0.05)、(9.20±0.10)、(10.21±0.10),差异均有统计学意义(t值分别为2.34、3.67、5.01、5.96,均P< 0.05)。此外,我们还对FAK另一个活化位点 FAK pY576/577位点磷酸化水平也进行了检测。结果表明,在上述对应时间点该位点磷酸化相对表达量分别为(0.91±0.02)、(1.25±0.03)、(1.26±0.03)、(1.29 ± 0.04)、(1.31 ± 0.05),总FAK及GAPDH表达水平在两组内及组间差异均无统计学意义(P> 0.05)。在常氧和缺氧条件下微电场对滋养细胞迁移/侵袭相关FAK磷酸化活性的影响结果相似,见图2。
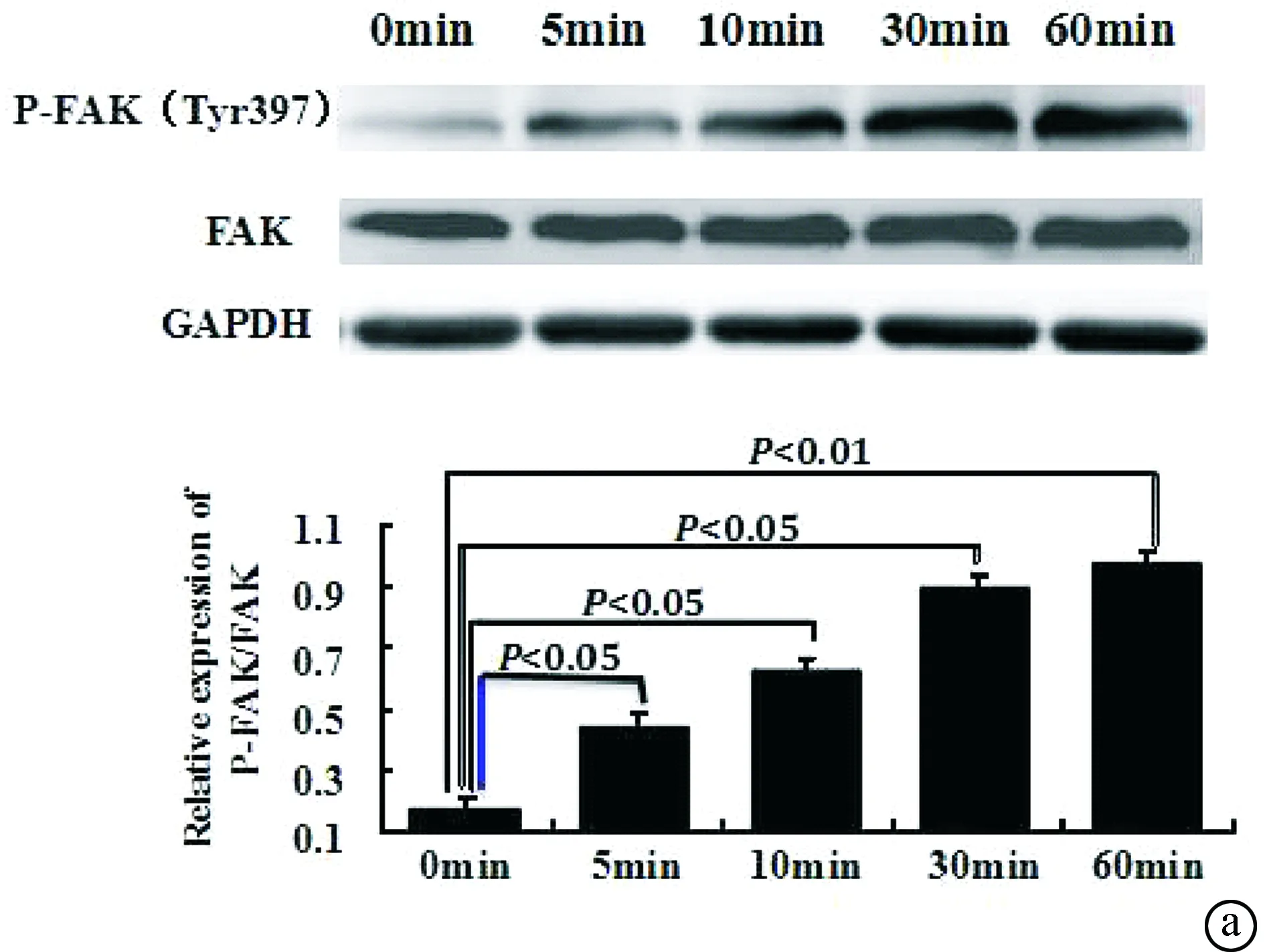
2.3 微电场对滋养细胞表面整合素integrin表达的影响 整合素对于细胞内外信号传导具有重要作用。已有研究显示,滋养细胞表面integrin的活化可以通过激活胞内FAK而影响细胞的迁移/侵袭功能。本研究应用Western blot对微电场刺激下滋养细胞integrin α1﹑α5﹑αV 和β1的表达分别进行了分析,结果显示,微电场刺激滋养细胞5、10和15 h后未见上述相关分子在各时间点表达水平发生明显改变,差异无统计学意义(P> 0.05)。见图3。E代表加电组,C代表对照组。

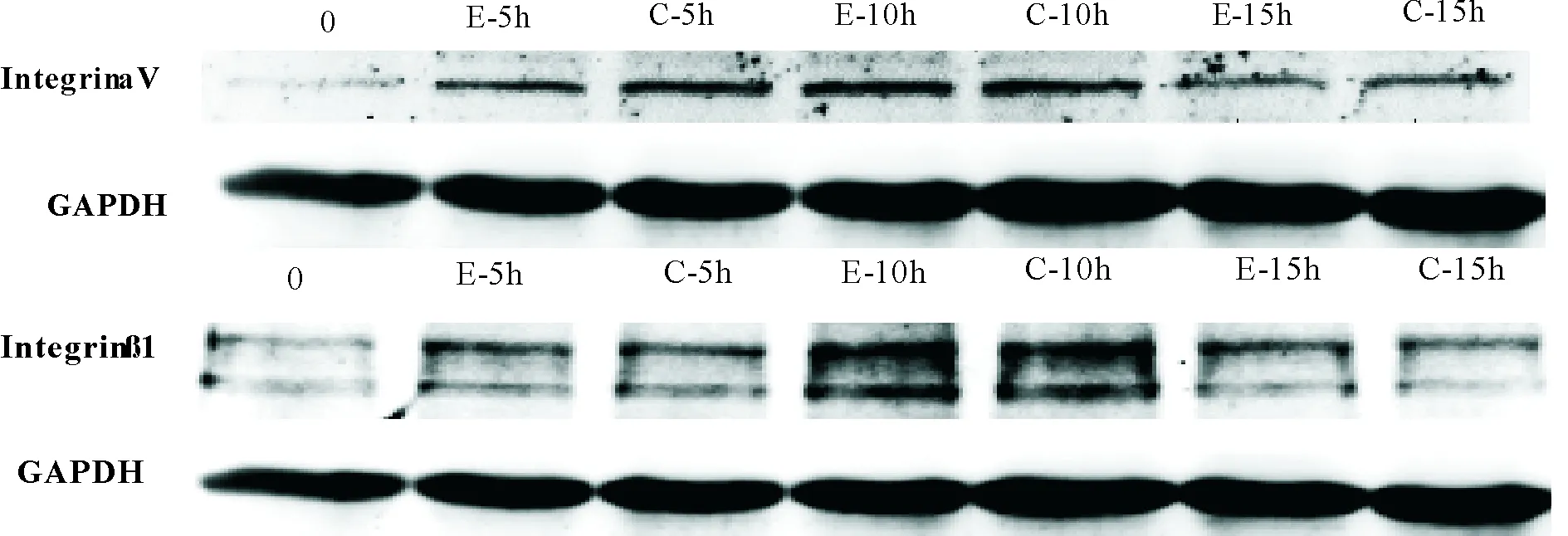
图3 微电场刺激对滋养细胞integrinα1,α5,αV和β1的表达影响
3 讨论
现有研究表明[7~10],妊娠胚胎植入早期,滋养层细胞的增殖、分化、侵入子宫蜕膜和血管是胚胎着床及胎盘形成过程中的一个重要环节。滋养层细胞的侵袭能力受到精确地调控,过强可能与滋养细胞肿瘤发生有关,过弱则可能导致一系列产科异常结局,因此,绒毛外滋养细胞适度地侵入子宫内膜是维持妊娠和胎儿发育的重要前提条件。
滋养细胞侵入子宫内膜由粘附、定植、降解细胞外基质等环节构成。整合素是细胞表面一种由α和β两种亚基构成的异二聚体,是重要的粘附分子和跨膜蛋白大家族,可将胞外的基质分子与细胞内的骨架蛋白连接起来形成焦点粘附物,构成整合素信号传导的结构基础。相关研究发现[8~10],整合素在滋养层细胞的表达具有显著的时空分布性,且滋养层细胞的侵袭过程可能与滋养层细胞膜上的特异性整合素的表达密切相关。Furmento等[8]发现,粒细胞集落刺激因子(G-CSF) 能通过上调β1整合素的表达,活化胞内PI3K 和 MAPK 信号通路从而介导滋养细胞的迁移功能;Lim等[9]发现,垂体肿瘤转化基因-1可通过整合素/Rho家族信号通路调节滋养层细胞侵袭功能;Liao等[10]发现,β-1,4-半乳糖基转移酶III可通过糖基化修饰β1整合素从而抑制滋养细胞的侵袭功能;而刘万钱等[11]发现整合素β1参与了滋养层细胞与血管内皮细胞间的黏附并调控了滋养层细胞的迁移行为。本研究发现微电场刺激能促进滋养细胞向负极定向迁移,但未发现微电场刺激促进滋养细胞的迁移功能与细胞表面整合素β1以及α1、α5和αV的表达水平密切相关,说明微电场刺激促进滋养细胞的迁移/侵袭功能可能通过非整合素途径来完成。关于细胞在直流微电场中定向迁移的机理,迄今尚未完全阐明。一些特定细胞的实验结果显示,可能与细胞在电场作用下其胞膜生长因子受体表达和分布发生改变有关,如角膜上皮细胞在电场中迁移与表皮生长因子受体(EGFR)、转化生长因子-β受体(TGF-βR)、成纤维细胞生长因子受体(FGFR)等聚集在细胞迁移方向的阴极侧,引起下游的信号通路活化,从而促进细胞发生定向移动[12,13]有关。直流微电场诱导滋养细胞定向迁移/侵袭功能是否也与细胞表面特定生长因子受体的重新分布及相关信号通路的活化有关或有其他机制参与,值得进一步研究。
FAK是一种非受体蛋白酪氨酸激酶,参与滋养层细胞侵袭能力的调节,在生长因子和整合素介导的细胞黏附和迁移以及信号转导途径中起着关键的作用[5~7]。本课题组前期研究结果表明[5~7],微电场刺激能促进常氧及缺氧培养条件下滋养细胞胞内FAK Tyr397 位点于5 min内磷酸化水平迅速升高,随加电时间延长,60 min内各时间检测点磷酸化水平逐渐加强,而对FAK另一活化位点FAK pY 576/577位点则影响不明显。不同浓度FAK抑制剂PF-573 228作用于滋养细胞后,微电场刺激下滋养细胞的迁移/侵袭功能受到不同程度地抑制,提示微电场可能主要通过介导FAK Tyr397 位点发生自主磷酸化而激活下游信号分子。关于FAK在滋养细胞迁移/侵袭中的作用早已被广泛证实,如Tang等[14]发现环孢素A 可通过活化FAK 通路从而促进人滋养细胞的体外迁移生长;张曦倩等[15]发现 FAK 可通过调节ERK信号通路从而介导滋养层细胞的侵袭作用;而在人鳞癌细胞系(SSc)的研究也发现,整合素β1能通过FAK磷酸化而激活MAPK信号通路介导细胞的迁移,这些发现都与我们的研究结果基本一致。但是,我们的研究未发现微电场刺激下整合素β1以及α1、α5和αV的表达水平与FAK的活化存在必然联系。鉴于FAK的活化存在非整合素途径,我们推测微电场刺激对滋养细胞FAK的活化可能通过非整合素途径实现,具体机制有待进一步探讨。
在FAK上游除了整合素及其它一些已知的信号环节有所报道外,尚有很多较详细的信号调控点及其相关功能尚未阐明,微电场调控滋养细胞迁移/侵袭功能的上游机制尚待进一步研究。
[1] Wu SY,Hou HS,Sun YS,et al.Correlation between cell migration and reactive oxygen species under electric field stimulation[J].Biomicrofluidics,2015,9(5):54120.
[2] Fei L,Tunan C,Shengli H,et al.Superoxide Mediates Direct Current Electric Field Induced Directional Migration of Glioma Cells through the Activation of AKT and ERK[J].PLOS ONE,2013,8(4):e61195.
[3] Bai H,Forrester JV,Zhao M.DC electric stimulation up regulates angiogenic factors in endothelial cells through activation of VEGF receptors[J].Cytokine,2011,55(1):110-115.
[4] Zhao M,Chalmers L,Cao L,et al.Electrical signaling in control of ocular cell behaviors[J].Prog Retin Eye Res,2012,31(1):65-88.
[5] 张娟,李明勇,贺元,等.微电场对滋养细胞迁移/侵袭相关MMPs/TIMPs表达的影响[J].重庆医学杂志,2016,45(7):869-872.
[6] 张娟,李明勇,贺元,等.微电场通过活化粘着斑激酶信号通路促进缺氧培养滋养细胞的迁移/侵袭[J].临床检验杂志,2015,33(11):813-817.
[7] Zhang J,Ren RM,Luo XF,et al.A Small Physiological Electric Field Mediated Responses of Extravillous Trophoblasts Derived from HTR8/SVneo Cells:Involvement of Activation of Focal Adhesion Kinase Signaling[J].PLOS ONE,2014,3(9):e92252.
[8] Furmento VA,Marino J,Blank VC,et al.Granulocyte colony-stimulating factor (G-CSF) upregulates β1 integrin and increases migration of human trophoblast Swan 71 cells via PI3K and MAPK activation[J].Exp Cell Res,2016,342(2):125-134.
[9] Lim SM,Jang HY,Lee JE,et al.Alteration of Pituitary Tumor Transforming Gene-1 Regulates Trophoblast Invasion via the Integrin/Rho-Family Signaling Pathway[J].PLoS One,2016,11(2):e0149371.
[10]Liao WC,Liu CH,Chen CH,et al.α-1,4-Galactosyltransferase III suppresses extravillous trophoblast invasion through modifying β1-integrin glycosylation[J].Placenta,2015,36(4):357,364.
[11]刘万钱,管章委,邓小燕,等.整合素β1对人体滋养层细胞黏附和迁移行为的影响[J].生物医学工程学杂志,2010,27(1):67-70.
[12]Zhao M,Pu J,Forrester JV,et al.Membrane lipids,EGF receptors,and intracellular signals colocalize and are polarized in epithelial cells moving directionally in a physiological electric field[J].Faseb J,2002,16(8):857-859.
[13]Forrester JV,Lois N,Zhao M,et al.The Spark of Life:the role of electric fields in regulating cell behaviour using the eye as a model system[J].Ophthalmic Res,2007,39(1):4-16.
[14]Tang CL,Zhao HB,Li MQ,et al.Focal adhesion kinase signaling is necessary for the Cyclosporin A-enhanced migration and invasion of human trophoblast cells[J].Placenta,2012,33(9):704-711.
[15]张曦倩,陈士岭,邢福祺.黏着斑激酶对ERK 介导的滋养层细胞侵袭行为的调节作用[J].中南大学学报(医学版),2011,36(6):559-564.
Micro-electrical field may activate FAK through non-integrin pathway to promote trophoblast cells migration/invasion
ZHANGJuan1,LIMing-yong1,HEYuan1,BAIHuai2,FANPing2
(1.ClinicalLaboratory,SichuanAcademyofMedicalScience&SichuanProvincialPeople’sHospital,Chengdu610072,China; 2.WestChinaSecondHospitalSchoolofClinicalMedicineSichuanUniversity,Chengdu610041,China)
Objective To investigate whether the effect of physiological micro-electrical field on migration/invasion of trophoblast cells in vitro was associated with integrins expression of the cells.Methods The trophoblast cells were exposed to the direct current electrical field (DC-EF) at 150 mV/mm for 5,10 and 15 hours.Cell images and migration distance were recorded with continuous photographing and analyzed by image analyzer.The activation of FAK at 5,10,30 and 60 min of DC-EF stimulation were measured and the expression levels of integrinα1,integrinα5,integrinαV and integrinα1 were detected by using Western blot assay.Results The application of 150 mV/mm DC electrical stimulation,trophoblast cells cultured in media containing 10% calf serum showed a cathode migration.The migration velocity and distance were obviously increased when compared to the control group without EF stimulation (P= 0.021).The cells exposed to the EF also showed elongation and perpendicular orientation,while control cells that were not subjected to EF showed no such responsiveness.Compared with the non-EF stimulation controls,trophoblasts under EF stimulation had a quickly activation of FAKTyr397 location within 60 min (P< 0.05),while no significant changes in expressions of integrinα1,integrinα5,integrinαV and integrinα1 were observed (P> 0.05).Conclusion The physiological direct current electrical field may activate FAK by non-integrin pathway to promote trophoblast cell migration/invasion function.However,its detailed mechanism needs further studies.
Electrical field,EF; Trophoblast cells; Integrin; Focal adhesion kinase,FAK; Migration/invasion
国家自然科学基金资助项目(编号:30872774/H0418):四川省卫生和计划生育委员会科研基金资助项目(编号:140071、16PJ469);四川省人民医院博士基金资助项目(编号:2015BS18)
R394.2
A
1672-6170(2017)03-0020-04
2016-09-23;
2016-11-24)
