呋喃唑酮代谢物间接竞争化学发光酶免疫法的建立
2017-06-05黄登宇高文静黄种乾高丽霞杨秀松
黄登宇,高文静,黄种乾,高丽霞,冯 敏,杨秀松
(1.山西大学生命科学学院,山西太原 030006; 2.山西大学食品药品快检技术中心,山西太原 030006;3.国家食品药品监督管理总局高级研修学院,北京 100073)
呋喃唑酮代谢物间接竞争化学发光酶免疫法的建立
黄登宇1,2,高文静1,黄种乾1,高丽霞1,冯 敏1,杨秀松3,*
(1.山西大学生命科学学院,山西太原 030006; 2.山西大学食品药品快检技术中心,山西太原 030006;3.国家食品药品监督管理总局高级研修学院,北京 100073)
建立快速检测动物源性食品中呋喃唑酮代谢物AOZ的间接竞争化学发光酶免疫法。利用对醛基苯甲酸(4-CBA)将AOZ衍生化为CPAOZ,利用活化酯法将CPAOZ与卵清蛋白(OVA)偶联,生成完全抗原CPAOZ-OVA。对包被原与抗体的最佳稀释倍数、封闭液浓度、竞争时间、酶标二抗稀释倍数进行优化,建立标准曲线,同时对方法的特异性进行评价。结果表明:包被抗原最佳稀释倍数为2000倍,抗体的最佳稀释倍数为20000倍、封闭液为2%脱脂乳粉、竞争时间为2 h、二抗最佳稀释倍数为4000倍;线性范围是0.075~7.396 ng/mL,半抑制浓度IC50为0.74 ng/mL,对呋喃唑酮原药的交叉反应率为23.4%,与其他结构类似物及衍生化试剂的交叉反应率均小于0.1%。该方法灵敏度高、特异性好,可为监管部门对于快速检测动物源性食品中AOZ提供依据。
呋喃唑酮,间接竞争化学发光酶免疫法,动物源性食品,快速检测
呋喃唑酮为硝基呋喃类药物[1],是一种广泛用在人类和动物中的抗菌药物[2],动物服用之后,迅速代谢为3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone,AOZ),AOZ长期稳定存在于动物体内[3-4]。由于其对人体有潜在的致癌、致突变作用[5],美国、欧盟和日本等国家禁止在动物源食品中检测出呋喃唑酮[6],2002年至今我国农业部公告第235号文件《动物性食品中兽药最高残留限量》也将呋喃唑酮列入禁用名单。但是由于此类药物使用效果好,价格低廉,仍然被不法商贩使用[7]。
目前呋喃唑酮代谢物AOZ的检测多采用仪器分析法,如液相色谱-紫外联用法(LC-UV)、液相色谱-串联质谱法(LC-MS、LC-MS/MS)[8],有较高的准确性和灵敏度[9-10],但是前处理复杂,价格昂贵,无法对样品大量快速筛查[11]。而免疫分析法如胶体金免疫层析法[12]、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)[13]和化学发光酶免疫分析法(chemiluminescence enzyme immunoassay,CLEIA)[14-15]操作简便,分析时间短,具有较高的选择性和灵敏度,在兽药残留分析中具有十分广阔的前景[16]。其中CLEIA法将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,与ELISA相比,灵敏度更高[17]。近几年CLEIA法在食品安全方面得到应用,但此方法易受实际样品干扰、在小分子检测过程中精密度有限[18],迄今为止市面上在销试剂盒仍旧没有统一的标准,因此对于此方法的优化研究很有必要。
本实验人工合成并检测得到衍生化半抗原CPAOZ、包被抗原CPAOZ-OVA,建立了用于检测AOZ间接竞争CLEIA法,为开发AOZ快速检测试剂盒奠定了良好的基础。
1 材料与方法
1.1 材料与仪器
3-氨基-2-恶唑烷酮(AOZ)、卵清蛋白(OVA)、辣根过氧化物酶(HRP)、二甲基甲酰胺(DMF)、N-羟基琥珀酰亚胺(NHS)、N,N-二环乙基碳酰亚胺(DCC)、3-(2-硝基苯亚甲基)-氨基-2-恶唑烷酮(NPAOZ)、2-硝基苯亚甲基-氨基脲(NPSEM)、5-(4-吗啉基)-3-(2-硝基苯亚甲基)-氨基-2-恶唑烷酮(NPAMOZ)、1-(2-硝基苯亚甲基)-氨基乙内酰脲(NPAHD)、鲁米诺 美国Sigma公司;AOZ单克隆抗体 北京艾旗斯德科技有限公司;脱脂乳粉 伊利乳业;对醛基苯甲酸(4-CBA) 国药集团;其他化学试剂均为国产分析纯。
UV-1600PC紫外分光光度计 上海美谱达仪器有限公司;AVANCE 600 MHZ超导核磁共振波谱仪 德国Bruker公司;透析袋(截留分子量8000~14000) 北京索莱宝科技有限公司;INFINITE M200 PRO酶标仪 瑞士Tecan公司;96孔可拆卸化学发光板、PowerDry PL3000冷冻干燥机 美国Thermo公司;高速离心机 珠海博迈杰生物科技有限公司;8道微量可调移液器 德国Eppendorf公司;BSD-100恒温培养箱 上海博迅实业有限公司。
化学发光液(现用现配):5 mL Tris-盐酸缓冲液、3.5 mL对碘苯酚溶液、200 μL鲁米诺溶液和50 μL过氧化氢脲溶液混匀[19]。
1.2 实验方法
1.2.1 合成半抗原CPAOZ 利用对醛基苯甲酸(4-CBA)将AOZ衍生化为半抗原CPAOZ。取70 mg AOZ快速溶解于1 mL 1 mol/L HCl中,为A液;65 mg 4-CBA加入2 mL超纯水,逐渐加入DMF,直至4-CBA完全溶解,为B液;将A、B液混匀,室温反应48 h。5000 r/min离心10 min,弃上清,将沉淀用乙醇洗涤三次,每次洗涤后重复上述离心。将沉淀物-80 ℃冷冻12 h,真空干燥,得到白色粉末CPAOZ。通过核磁共振法对CPAOZ进行鉴定[20]。
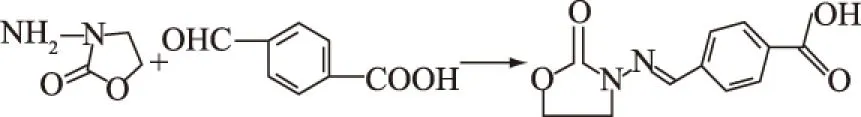
图1 半抗原CPAOZ的合成示意图Fig.1 The symthesis process of CPAOZ
1.2.2 合成包被原CPAOZ-OVA 利用活化酯法将CPAOZ与卵清蛋白(OVA)偶联,合成包被抗原CPAOZ-OVA[21]。取4.0 mg CPAOZ,2.1 mg NHS,4.2 mg DCC,溶解于300 μL DMF,4 ℃反应过夜,5000 r/min离心10 min,取上清,为A液;30.0 mg OVA溶解于5 mL 0.01 mol/L pH7.4 PBS中,为B液;将A、B液混匀,4 ℃反应8 h,5000 r/min离心10 min,取上清。将上清透析5 d,每8 h换一次PBS透析液。透析结束后,5000 r/min离心10 min,取上清,加入等体积甘油于-20 ℃下保存备用。通过UV-Vis法鉴定。
1.2.3 AOZ间接竞争CLEIA法操作步骤 用碳酸盐缓冲液(pH9.6,0.05 mol/L)将包被原CPAOZ-OVA稀释,每孔100 μL加入到化学发光板中,孵育一定时间;将各孔包被液甩出,用PBST溶液(含0.05% Tween-20,pH7.4,0.01 mol/L的PBS)洗涤2 min,洗涤5次,每次甩干后拍干;每孔加入200 μL脱脂乳粉,37 ℃封闭2 h,洗板3次;每孔加入50 μL梯度稀释的标品NPAOZ溶液和50 μL稀释后单克隆抗体,每个浓度做三个平行;空白对照组,用标品稀释液PBS代替,37 ℃孵育,洗版3次;每孔加入100 μL稀释后的酶标二抗,37 ℃反应1 h,洗板4次;每孔加入现配发光液100 μL,室温下避光反应4 min,用酶标仪检测各孔化学发光强度(relative unit,RLU)[22]。
1.2.4 间接竞争CLEIA 法条件优化 包被原与抗体的最佳稀释倍数由棋盘法来确定。设置包被原稀释倍数为1000、2000、4000、8000、16000、32000,抗体稀释倍数为10000、20000、40000、80000、160000、320000,封闭液用1%的脱脂乳粉,封闭时间2 h,竞争药物NPAOZ的浓度为100 ng/mL,竞争时间为1 h,酶标二抗稀释倍数为4000倍,按照1.2.3节的步骤测定RLU值,同时做阴性对照(不加标品NPAOZ),每个实验做3组平行,取平均值,通过考察添加标品NPAOZ的RLU值(B)与不添加标品NPAOZ的RLU值(B0)的比值(B/B0)确定最佳稀释倍数。
通过单因素实验确定封闭液浓度、竞争时间、酶标二抗稀释倍数。分别设置0.5%、1%和2%脱脂乳粉3种不同封闭液;3组不同的竞争时间:0.5、1、2 h;3个不同的酶标二抗稀释倍数:4000、6000、8000倍,按照1.2.3节的步骤分别测定化学发光强度RLU值,每组做3个平行,竞争物NPAOZ系列浓度梯度为100、20、4、0.8、0.16、0.032 ng/mL。
1.2.5 建立标准曲线 根据上述实验确定的最佳反应条件,按照1.2.3节的步骤在浓度梯度为100、20、4、0.8、0.16、0.032 ng/mL的NPAOZ溶液下进行操作,测定RLU值,每个质量浓度做3组平行,绘制标准曲线,得出线性方程,计算IC50(IC50为B/B0为0.5时相对应的NPAOZ质量浓度)和线性范围(IC20~IC80)[23]。
1.2.6 方法特异性 特异性的强弱可通过酶标抗原(或特异性抗原)和结构类似物在与抗体结合时的交叉程度来反映,以交叉反应率(cross reactivity,CR)衡量,CR越小,该方法的特异性越好。利用呋喃唑酮原药、AOZ衍生物NPAOZ及其他代谢物衍生物NPSEM、NPAMOZ、NPAHD作为竞争药品,分别采用间接竞争CLEIA和间接竞争ELISA方法进行交叉实验,并按照下式计算各个药品的交叉率CR。
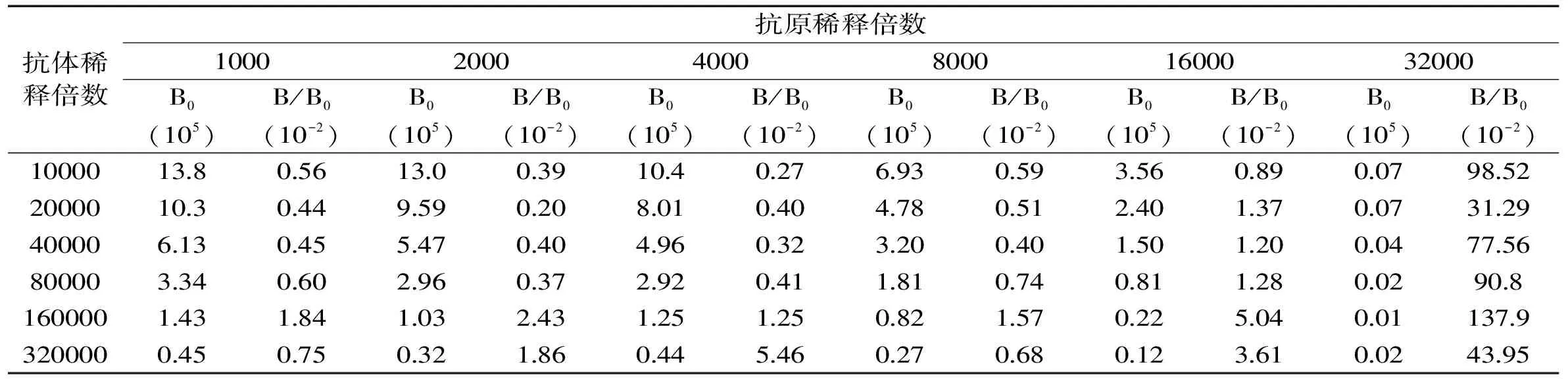
表1 不同包被原和抗体稀释倍数下的B/B0值
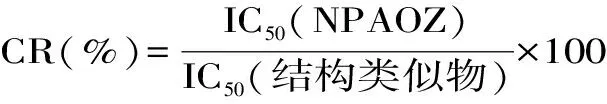
1.3 数据分析
以NPAOZ浓度的对数值为横坐标,以B/B0值为纵坐标,利用excel软件分别绘制各条件下标准曲线,取标准曲线中线性范围较好的一段得出线性方程,计算每条曲线的IC50和RLUmax/IC50(RLUmax为每一条件下不同NPAOZ浓度中最大化学发光值)。利用origin软件画出每个条件下的IC50和RLUmax/IC50双纵轴线,以IC50和RLUmax/IC50作为确定最佳条件的依据,双纵轴线中IC50越小,RLUmax/IC50越大,灵敏度越高[23-24]。
2 结果及分析
2.1 鉴定半抗原CPAOZ
1H NMR(600 Hz,DMSO-d6)(13.07(s,1H),8.01(d,J=8.4 Hz,2H),7.89(s,1H),7.84(d,J=8.4 Hz,2H),4.52(t,J=7.8 Hz,2H),3.97(t,J=7.8 Hz,2H)。说明合成了半抗原CPAOZ。

图2 CPAOZ的1H NMR谱图Fig.2 The 1H NMR spectrum of CPAOZ
2.2 鉴定包被原CPAOZ-OVA
由图3可见,载体蛋白OVA的最大紫外吸收峰在280 nm处,半抗原CPAOZ的最大紫外吸收峰在293 nm处,包被原 CPAOZ-OVA的最大吸收峰在283 nm处。包被原CPAOZ-OVA相对于载体蛋白OVA和半抗原CPAOZ的最大吸收峰发生了明显的偏移,且吸收曲线同时也发生了变化,说明包被原CPAOZ-OVA合成成功。
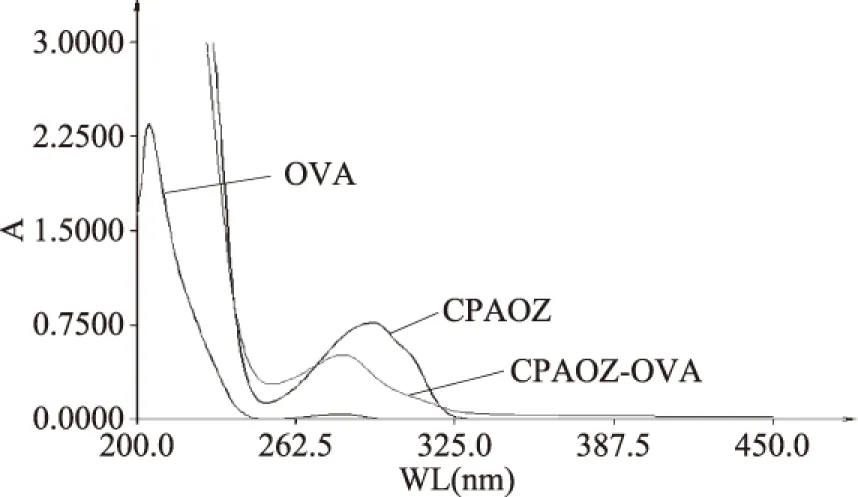
图3 CPAOZ、OVA和CPAOZ-OVA紫外扫描图谱 Fig.3 The UV spectrum of CPAOZ,OVA and CPAOZ-OVA
2.3 确定最优条件
2.3.1 确定包被原与抗体稀释倍数 由表1可见,包被原稀释倍数为2000倍,抗体稀释倍数为20000倍时,B/B0最小,为0.20×10-2。在竞争化学发光酶免疫反应中,B/B0越小,灵敏度越高,所以最后选择包被原稀释倍数为2000倍,抗体稀释倍数为20000倍。
2.3.2 确定封闭液 由图4中三条曲线的线性方程算出各自的IC50值,进而计算出各自的RLUmax/IC50值,计算结果如图5。2%脱脂乳粉的IC50值小于1%脱脂乳粉和0.5%脱脂乳粉,同时2%脱脂乳粉的RLUmax/IC50值最大,根据IC50越小,RLUmax/IC50越大,灵敏度越高,选择最佳封闭液为2%的脱脂乳粉。
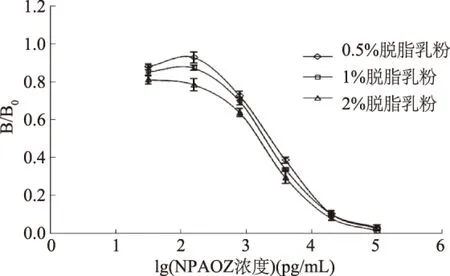
图4 AOZ ic-CLEIA封闭液优化Fig.4 Optimization of blocking liquid for ic-CLEIA of AOZ
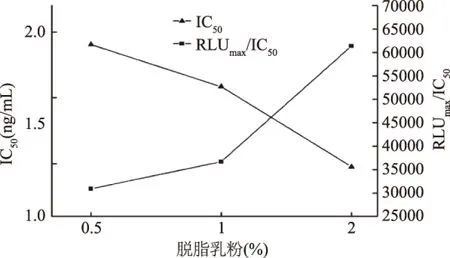
图5 封闭液优化实验IC50与RLUmax/IC50结果Fig.5 The result of IC50 and RLUmax/IC50in the blocking buffer optimal experiment
2.3.3 确定竞争时间 同理,由图6和图7可知,竞争2 h的IC50值小于1 h和0.5 h的,同时竞争2 h的RLUmax/IC50值最大,因此,选择最佳竞争时间为2 h。
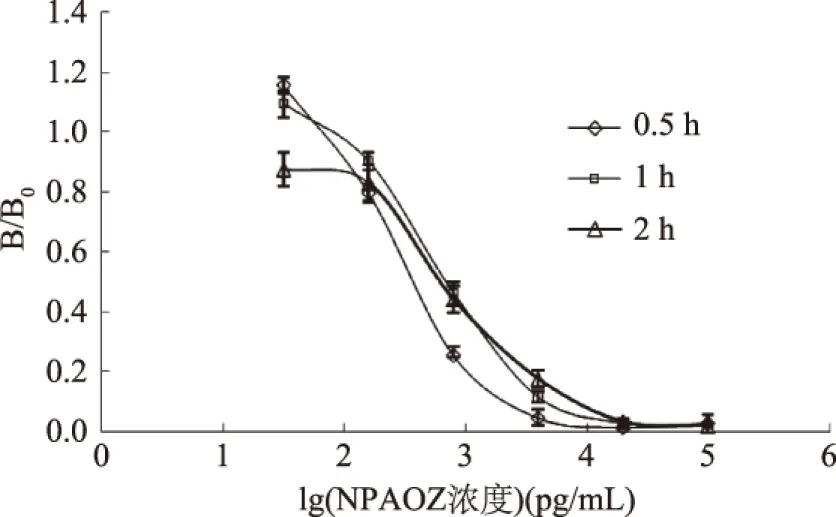
图6 AOZ ic-CLEIA竞争时间优化Fig.6 Optimization of competitive reaction time for ic-CLEIA of AOZ
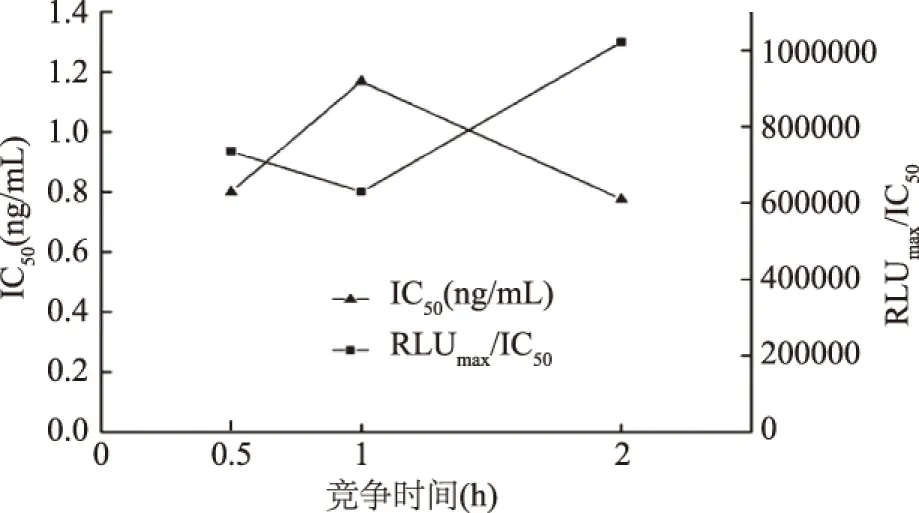
图7 竞争时间优化实验IC50与RLUmax/IC50结果Fig.7 The result of IC50 and RLUmax/IC50in the competitive reaction time optimal experiment
2.3.4 确定酶标二抗稀释倍数 同理,由图8和图9可知,稀释4000倍、6000倍与8000倍的IC50值差距不大,但稀释4000倍的RLUmax/IC50最大,因此,选择二抗最佳稀释倍数为4000倍。

图8 AOZ ic-CLEIA酶标二抗稀释倍数优化Fig.8 Optimization of second antibody for ic-CLEIA of AOZ

图9 酶标二抗稀释倍数优化实验IC50与RLUmax/IC50结果Fig.9 The result of IC50 and RLUmax/IC50in the dilution multiple of second antibody optimal experiment
2.4 方法学评价
2.4.1 建立标准曲线 绘制出的标准曲线为免疫法典型的倒“S”曲线,如图10所示,线性方程为y=-0.30082x+1.364,R2=0.91428,得出的IC50为0.74 ng/mL,线性范围是0.075~7.396 ng/mL。
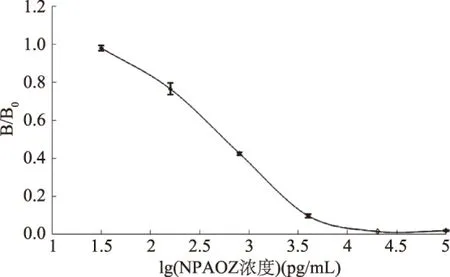
图10 AOZ ic-CLEIA标准曲线Fig.10 Standard curve of AOZ by ic-CLEIA
2.4.2 特异性测定结果 由表2可知,AOZ间接竞争CLEIA法对呋喃唑酮原药的CR为23.4%,AOZ间接竞争ELISA法对呋喃唑酮原药的CR为32.1%,两种方法与其他结构类似物均交叉反应率小于0.1%,但是呋喃唑酮进入动物组织后,迅速代谢为AOZ,因此动物体内并无呋喃唑酮原药与抗体竞争,所以两种方法的特异性都比较强。

表2 ic-CLEIA法与ic-ELISA法的特异性测定结果
3 结论
本实验成功合成了包被原CPAOZ-OVA,为间接竞争CLEIA法的建立提供基础。通过对包被原与抗体稀释倍数、封闭液浓度、竞争时间、酶标二抗稀释倍数等条件进行优化,最终确定此方法的灵敏度IC50为0.74 ng/mL,线性范围是0.075~7.396 ng/mL,达到相关检测限量要求[24],最后通过交叉反应验证了该方法特异性强。根据丁锴[14]建立的此方法得出,该方法批间回收率范围在83%~103%之间,批内回收率范围在78%~113%之间,批间变异系数在5%~27%之间,批内变异系数在4%~18%之间,从而说明该方法的重复性好,准确度和精密度高。
虽然本实验灵敏度与任海涛[25]等建立的间接竞争ELISA方法相比并没有显著提高,间接竞争CLEIA方法的研究也比较常见,但是由于目前国内对此方法以及试剂盒的研制仍然没有统一的标准,需要学者们更加深入研究下去。本实验从人工抗原的合成到间接竞争CLEIA方法的建立组成了一个比较完整的体系,因此,可作为呋喃唑酮代谢物检测的理论基础,为研制快速检测试剂盒提供依据。
[1]Deyong Kong,Bin Liang,Hui Yun,et al. Electrochemical degradation of nitrofurans furazolidone by cathode:Characterization,pathway and antibacterial activity analysis[J]. Chemical Engineering Journal,2015,262:1244-1251.
[2]J Raipulis,M M Toma,P Semjonovs. The effect of probiotics on the genotoxicity of furazolidone[J]. International Journal of Food Microbiology,2005,102:343-347.
[3]刘围. 呋喃妥因和呋喃唑酮在食品中残留的酶联免疫测定法的研究[D]. 山东:山东大学,2008:6-7.
[4]Kevin M Cooper,Anthony Caddell,Christopher T. Elliott,et al. Production and characterisation of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone,a metabolite of the nitrofuran furazolidone[J]. ScienceDirect,2004,520(1-2):79-86.
[5]李子颖,郑婷,袁志刚,等. 呋喃唑酮代谢物AOZ的抗体制备及初步应用[J]. 食品科技,2013,38(4):309-312,316.
[6]Nobuo Sasaki,Tomoyuki Matsumoto,Yoshinori Ikenaka,et al. Furazolidone induces the activity of microsomal enzymes that metabolize furazolidone in chickens[J]. Pesticide Biochemistry and Physiology,2011,100(2):135-139.
[7]李军. 畜禽饲料中硝基呋喃类药物快速检测技术研究[D]. 河北:河北农业大学,2011:1-8.
[8]A Conneely,A Nugent,M O’Keeffe,et al. Isolation of bound residues of nitrofuran drugs from tissue by solid-phase extraction with determination by liquid chromatography with UV and tandem mass spectrometric detection[J]. Analytica Chimica Acta,2003,483(1-2):91-98.
[9]刘正华,杨娟,李拥军,等. 高效液相色谱-串联质谱法测定猪肝中硝基呋喃类代谢物残留[J]. 广东农业科学,2012,(4):87-89.
[10]郭无瑕,李肖斐. 液相色谱-串联质谱联用法测定干海参中硝基呋喃代谢物残留量[J]. 大连海洋大学学报,2013,28(6):614-616.
[11]徐伟,程凤科,孟银,等. 酶联免疫吸附法在兽药残留检测中的应用[J]. 中国家畜,2013,35(12):49-50,52.
[12]刘爱春,刘超,赵芸,等. 免疫胶体金法快速检测水产品中硝基呋喃类代谢物的研究[J]. 浙江农业学报,2013,25(1):95-102.
[13]李敏. 动物性食品中呋喃唑酮代谢物残留酶联免疫检测方法研究[D]. 广东:华南理工大学,2012.
[14]丁锴. 呋喃唑酮、呋喃妥因和加替沙星的化学发光酶免疫吸附检测法的建立[D]. 山东:山东大学,2009.
[15]李亚楠,王瑞,李涛,等. 直接竞争化学发光酶免疫法检测呋喃妥因代谢物[J]. 食品科学,2016,37(8):231-235.
[16]李娜,祁克宗. 免疫分析法在兽药残留分析中的应用[J]. 动物医学进展,2006,27(2):13-16.
[17]何方洋. 兽药残留检测技术研究[J]. 北京工商大学学报:自然科学版,2012,30(1):17-19.
[18]肖勤,林金明. 化学发光免疫分析方法的应用研究进展[J]. 分析化学,2015,43(6):929-938.
[19]吕月霞,王瑞,黄登宇,等. 呋喃它酮代谢物直接竞争化学发光酶免疫分析法的建立[J]. 食品工业科技,2015,36(22):71-75,86.
[20]常超,伍金娥,袁宗辉. 呋喃唑酮残留标示物人工抗原合成与抗体制备[J]. 食品科学,2008,29(12):444-448.
[21]贾慧勤,丁焕中,刘晓云,等. 呋喃唑酮代谢物人工抗原的合成及抗体的制备[J]. 中国兽药杂志,2013,47(6):20-23.
[22]范艳,孟玮,朱立鑫,等. 化学发光酶联免疫法检测苏丹红Ⅰ[J]. 食品科学,2015,36(12):209-212.
[23]戴尽波,徐振林,刘凤银,等. 化学发光酶免疫分析测定鱼肉中呋喃它酮代谢物方法研究[J]. 分析化学,2015,43(6):871-875.
[24]国家质量监督检验检疫总局.SN/T 3380-2012 出口动物源食品中硝基呋喃代谢物残留量的测定:酶联免疫吸附法[S].
[25]任海涛,沈玉栋,徐振林,等. 呋喃唑酮代谢物单克隆抗体制备及酶联免疫吸附分析方法[J]. 分析化学,2015,40(5):745-751.
Synthesis of furazolidone metabolite artificial antigen and development of indirect competitive chemiluminescence enzyme immunoassay
HUANG Deng-yu1,2,GAO Wen-jing1,HUANG Zhong-qian1,GAO Li-xia1,FENG Min1,YANG Xiu-song3,*
(1.School of Life Science,Shanxi University,Taiyuan 030006,China; 2.Food and Drug Fast Inspection Center of Shanxi University,Taiyuan 030006,China; 3.China Food and Drug Administration Institute of Executive Development,Beijing 100073,China)
An indirect competitive chemiluminescence enzyme immunoassay(ic-CLEIA)was used for determination and identification of the furazolidone metabolite in animal-derived food. AOZ can be translated into hapten CPAOZ by derivative reaction. CPAOZ-OVA,as the coating antigen,was prepared by activated ester method. After optimizing the dilution multiple of coating antigen and anti-body,blocking buffer,competitive reaction time and the dilution multiple of second antibody,a standard curve was established,and finally the specificity of the method was evaluated. The results indicated that,the optimum dilution multiple of coating antigen was 2000-fold,the anti-body was 20000-fold. Blocking buffer was dried skim milk at the concentration of 2%. The competitive reaction time was 2 h,and the ideal dilution multiple of secondary antibody was 4000-fold. The linearity range was 0.075~7.396 ng/mL,and half-inhibitory concentration(IC50)value was 0.74 ng/mL. The cross-reactivity value between AOZ and furazolidone original drug was 23.4%,and cross reactivity value with other analogues and derivatives was <0.1%. The method with demonstrated excellent sensitivity and specificity can provide the basis for rapid detection of AOZ content in animal-derived food for supervision department.
furazolidone;indirect competitive chemiluminescence enzyme immunoassay;animal-derived food;rapid detection
2016-11-18
黄登宇(1968-),男,博士,副教授,研究方向:食品安全检测,E-mail:Huangdy1110@126.com。
*通讯作者:杨秀松(1975-),男,硕士,副教授,研究方向:食品科学与食品安全,E-mail:yxs@cfdaied.org。
TS207.3
A
1002-0306(2017)09-0294-06
10.13386/j.issn1002-0306.2017.09.048
