红曲菌发酵对广式腊肠颜色和蛋白质降解的影响
2017-06-05金二庆王倩倩吴建中
金二庆,廖 顺,彭 聪,王倩倩,吴建中
(暨南大学食品科学与工程系,广东广州 510632)
红曲菌发酵对广式腊肠颜色和蛋白质降解的影响
金二庆,廖 顺,彭 聪,王倩倩,吴建中*
(暨南大学食品科学与工程系,广东广州 510632)
采用GIM3.439紫红曲菌发酵广式腊肠,研究红曲菌发酵对广式腊肠的色泽、pH、氨基酸态氮含量和感官品质的影响;运用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和高效液相色谱(HPLC)等方法对广式腊肠中蛋白质、肽、游离氨基酸进行检测,分析红曲菌发酵过程中广式腊肠蛋白质的降解,初步研究了红曲菌发酵对广式腊肠中游离氨基酸的影响。结果表明:红曲菌发酵能够加深广式腊肠的红色;在发酵6 h时,发酵组氨基酸态氮含量达0.14%;电泳结果表明,红曲菌发酵对水溶性和盐溶性大分子蛋白降解均有促进作用,能够增加产品中小分子肽及游离氨基酸的总量;游离氨基酸总量由580 mg/100 g增加到930 mg/100 g。红曲菌发酵不仅使产品色泽更加诱人,而且使发酵后腊肠滋味更加丰富、浓郁,提高了腊肠的感官品质和营养价值。
红曲菌,发酵,广式腊肠,蛋白质,降解
广式腊肠是广东三大传统特色食品之一,其制作工艺特点是将瘦肉绞碎,肥肉切丁,配以辅料后灌入肠衣中,经过干燥而成,每年的消费量超过中国腊肠总销量的50%[1-2]。传统的广式腊肠多采用自然发酵,生产周期长、受天气影响较大、产品质量不稳定[3]。目前工业生产上多采用太阳能、热风干燥等相对密封的方式进行干燥,提高了生产效率,缩短了生产周期,但也导致腊肠产品的发酵时间短,缺乏传统自然接种和发酵的工艺过程,产品滋味不及传统腊肠丰富[4]。现代肉制品加工业通过精选优质菌种,制备肉品发酵剂,用人工控制的微生物发酵来替代传统的天然发酵,达到改善产品色泽,促进风味物质的生成,抑制腊肠天然发酵中杂菌滋生等不良状况,延长腊肠的保藏期[5]。
目前,用于肉制品发酵的菌种主要有乳酸菌、小球菌、葡萄球菌和红曲菌等[6-7]。其中红曲菌是人类使用的传统发酵霉菌,在我国酿酒、酿醋、腐乳和酱油等的生产中,红曲菌已有1000多年的应用历史[8-9]。我国明朝宋应星撰写的《天工开物》中就有红曲制法的详细记载。目前红曲菌在发酵肉制品中的应用,主要集中在利用红曲菌发酵或直接添加红曲色素来改善肉制品的色泽,抑制腐败菌的生长等方面,涉及红曲菌发酵对发酵肉制品风味影响的很少,涉及红曲菌对腊肠产品风味影响的研究尚未见到。红曲菌发酵有助于肉品原料中蛋白质成分的降解,产生一些小分子物质,如肽、氨基酸、醛、有机酸和胺类,并进一步发生美拉德反应,生成一系列的风味物质,进而对发酵肉制品滋味产生很大的影响[10-11],因此,深入研究红曲菌发酵对发酵肉制品中蛋白质、氨基酸等相关成分的影响是很有必要的。
目前,红曲菌在发酵肉制品中的应用,主要集中在代谢产物红曲色素的研究上,如通过添加红曲色素来代替亚硝酸盐发色,改善鲜肉制品的色泽[12];同时利用红曲菌来抑制肉制品中腐败菌的生长,延长肉制品的保质期[13-14]。但以红曲菌自身为发酵剂接入传统肉制品中进行发酵的研究较少。
本研究选用一种对乙醇有较强耐受力的GIM3.439紫红曲菌,接种于广式腊肠中进行发酵。研究红曲菌发酵对广式腊肠色泽、感官指标的影响基础上,确定合适的发酵时间,进一步研究红曲菌发酵对广式腊肠pH、氨基态氮指标的影响,并采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳技术(SDS-PAGE)和高效液相色谱法(HPLC)对腊肠中蛋白质及其降解产物和游离氨基酸含量进行了分析,揭示红曲菌发酵对广式腊肠蛋白质降解及其产物的影响,为发酵广式腊肠的生产工艺改进提供参考。
1 材料与方法
1.1 材料与仪器
猪腿肉和背膘、盐、白砂糖、稻花香52°白酒、东北大米 暨南大学兴安超市;标准蛋白 宝生物工程(大连)有限公司;GIM3.439紫红曲菌(Monascuspurpureus) 广东省微生物菌种保藏中心;马铃薯葡萄糖琼脂(PDA) 广东环凯微生物科技有限公司;其它试剂均为国产分析纯。
DYY型电泳仪 北京市六一仪器厂;1260型高效液相色谱仪 安捷伦科技(中国)有限公司;YZB型高速冷冻离心机 赛默飞世尔科技(中国)有限公司;YXQ型手提式压力蒸汽灭菌锅 上海华线医用核子仪器有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;90-2型定温恒时磁力搅拌器 上海沪西分析仪器厂有限公司;JYL-B050型料理机 九阳股份有限公司;SW-CJ-1F型超净工作台 苏州安泰空气技术有限公司;SPX型智能生化培养箱 宁波江南仪器厂;DZQ400-2D型单室真空包装机 依利达包装器材有限公司;JA-6灌肠机 北京利仁科技有限责任公司;pH计 上海精密科学仪器有限公司;WSD-3C全自动白度计 北京康光仪器有限公司。
1.2 实验方法
1.2.1 红曲菌发酵剂制备流程 取大米100 g打成粉末状,按如下配方制备红曲菌扩大培养基:米粉6 g、大豆蛋白1.2 g、硫酸镁0.1 g、磷酸二氢钾0.05 g、蒸馏水100 mL混匀,高压灭菌。
取冷冻干燥保藏的红曲菌菌种,接入121 ℃高压灭菌后的PDA 试管斜面,30 ℃条件培养7~10 d,观察红曲菌生长情况与颜色变化,直至孢子成熟变成红褐色,取出放入4 ℃冰箱保存,每隔1个月后移接一次,以延长其使用期(移接代数不超过3代)。
吸取5 mL无菌水注入斜面中,振摇15 min,将红褐色的孢子洗入灭菌后的红曲菌扩大培养基中,于35 ℃、150 r/min 摇床培养4 d,得到深红色均匀的红曲菌种子液;称取大米90 g平均分装3个三角瓶中,按大米∶蒸馏水10∶9比例添加蒸馏水到每个三角瓶中,高压灭菌后放置超净工作台中至室温得大米培养基;取无菌水、红曲菌种子液、大米培养基按3∶4∶20比例接入大米培养基,并搅拌均匀,30 ℃培养2 d得到深红色的红曲米,无菌条件下打浆得红曲菌发酵剂[15-16]。
1.2.2 广式腊肠的制备 参考GB/T 23493-2009 中式香肠国家标准中制作方法并加以改进。

发酵组:将猪背膘肉预先在-18 ℃条件下冷冻2 h,取出,切成3 mm×3 mm的小块作为肥肉原料;另取猪前腿肉作为瘦肉原料,绞碎,按照8∶2的比例将瘦肉糜和肥肉丁混合均匀。其他配料按混合后的肉重计,加入食盐2%、白砂糖4%、白酒2%和蒸馏水10%,混合均匀。接入5%红曲菌发酵剂,搅拌均匀后灌入蛋白肠衣中,扎孔放气,放于30 ℃条件下发酵,分别经过0、3、6、9、12 h取出腊肠样品放入4 ℃冰箱中,直至最后一批完成,取全部腊肠放入热泵干燥器中干燥到水分含量为20%左右,干燥完成后,真空包装,-18 ℃条件下保存,得到红曲菌发酵广式腊肠发酵组。
对照组:将猪背膘肉预先在-18 ℃条件下冷冻2 h,取出,切成3 mm×3 mm的小块作为肥肉原料;另取猪前腿肉作为瘦肉原料,绞碎,按照8∶2的比例将瘦肉糜和肥肉丁混合均匀。其他配料按混合后的肉重计,加入食盐2%、白砂糖4%、白酒2%和蒸馏水10%,混合均匀后,不添加红曲菌发酵剂,直接灌入蛋白肠衣中,扎孔放气,同样在30 ℃条件下经过0、3、6、9、12 h取出腊肠样品放入4 ℃冰箱中,直至最后一批完成,取全部腊肠放入热泵干燥器中干燥到水分含量为20%左右,干燥完成后,真空包装,-18 ℃条件下保存,得到广式腊肠对照组。
1.2.3 色泽的测定 采用WSD-3C全自动白度计,以标准白板作为对照,对样品的L*、a*、b*进行测定,每组测定3个样品,每个样品进行3次平行测定,结果取平均值。测定广式腊肠在发酵过程中的颜色变化情况。
1.2.4 pH的测定 参考GB/T 9695.5-2008肉与肉制品pH测定。分别取两组腊肠各10 g,加90 mL蒸馏水,静置30 min后抽滤,收集滤液,测定pH。
1.2.5 氨基酸态氮含量的测定 参考GB/T 5009.39-2003酱油卫生标准的测定方法,测定食品中氨基态氮含量。将腊肠除去脂肪,绞碎均匀,称取约10 g,加水定容到100 mL,不时震摇,浸渍30 min后离心提取上清液,放冰箱备用。分别测定两组腊肠中氨基态氮的含量。
1.2.6 腊肠中总蛋白质的SDS-PAGE分析 电泳用分离胶浓度为12%,浓缩胶浓度为5%,上样量为10 μL,采用恒流12 mA进行电泳分离。电泳结束后用考马斯亮蓝R250染色20 min,脱色12 h后分析电泳条带[17]。
称取腊肠10 g,加入75 mL的0.03 mol/L磷酸盐缓冲溶液(pH=7.0),在料理机中匀浆5 min,4 ℃条件下磁力搅拌浸提90 min,离心(10000 r/min,20 min,4 ℃),收集上清液,将所得沉淀分散于75 mL的0.03 mol/L磷酸盐缓冲溶液(pH=7.0)中,重复上述操作,合并两次离心后的上清液,分别取1 mL分装于1.5 mL离心管,-18 ℃冷冻保存,即为水溶性蛋白(肌浆蛋白)。
将上述沉淀分散于35 mL的磷酸盐缓冲液(0.1 mol/L,pH=7.4,含1.1 mol/L的KCl)中,在匀浆机中匀浆5 min,4 ℃下浸提18 h,并不时搅拌,离心(10000 r/min,20 min,4 ℃),所得上清液为盐溶性蛋白。将提取得到的盐溶性蛋白放置于-18 ℃冷冻后,取出放于4 ℃冰箱解冻,最先解冻出来的溶液即是脱盐的盐溶性蛋白,分别取1 mL分装于1.5 mL离心管于-18 ℃冷冻保存,即为盐溶性蛋白[18-19]。
1.2.7 游离氨基酸的分析 运用12.5 mol/L pH7.20的磷酸盐缓冲液+5 mL四氢呋喃做流动相A,12.5 mol/L pH7.20的磷酸盐缓冲液+350 mL甲醇+150 mL乙腈做流动相B,运用HP Hypersil ODS 5 μm(125 mm×4.0 mm)的色谱柱,柱温:40 ℃。将样品中游离氨基酸经HPLC反相分离后,用紫外检测,参考《实用食物营养成分分析手册》测定游离氨基酸含量[20]。
1.2.8 感官评价 依据GB/T 22210-2008肉与肉制品感官评定规范,于暨南大学食品科学与工程系教师及学生中,挑选7名感官评价人员,男女比例(3男,4女),以气味、滋味、外观和组织状态作为感官评定的指标,重点在于对比腊肠发酵前后及不同发酵时间对广式腊肠食用价值的影响。感官评价实验在感官评价研究室中进行,采用评分检验法。

表1 感官评价标准
1.3 数据处理与统计分析
采用SPSS 17.0(美国SPSS公司)软件对数据进行统计、分析,所有数据取三次重复的平均值;Origin 7.5软件(美国OriginLab公司)对数据进行拟合以及图形化处理。
2 结果与讨论
2.1 发酵时间对广式腊肠色泽的影响
分别取两组真空包装好的腊肠各40 g,绞碎后进行L*、a*、b*测定,结果如图1所示。
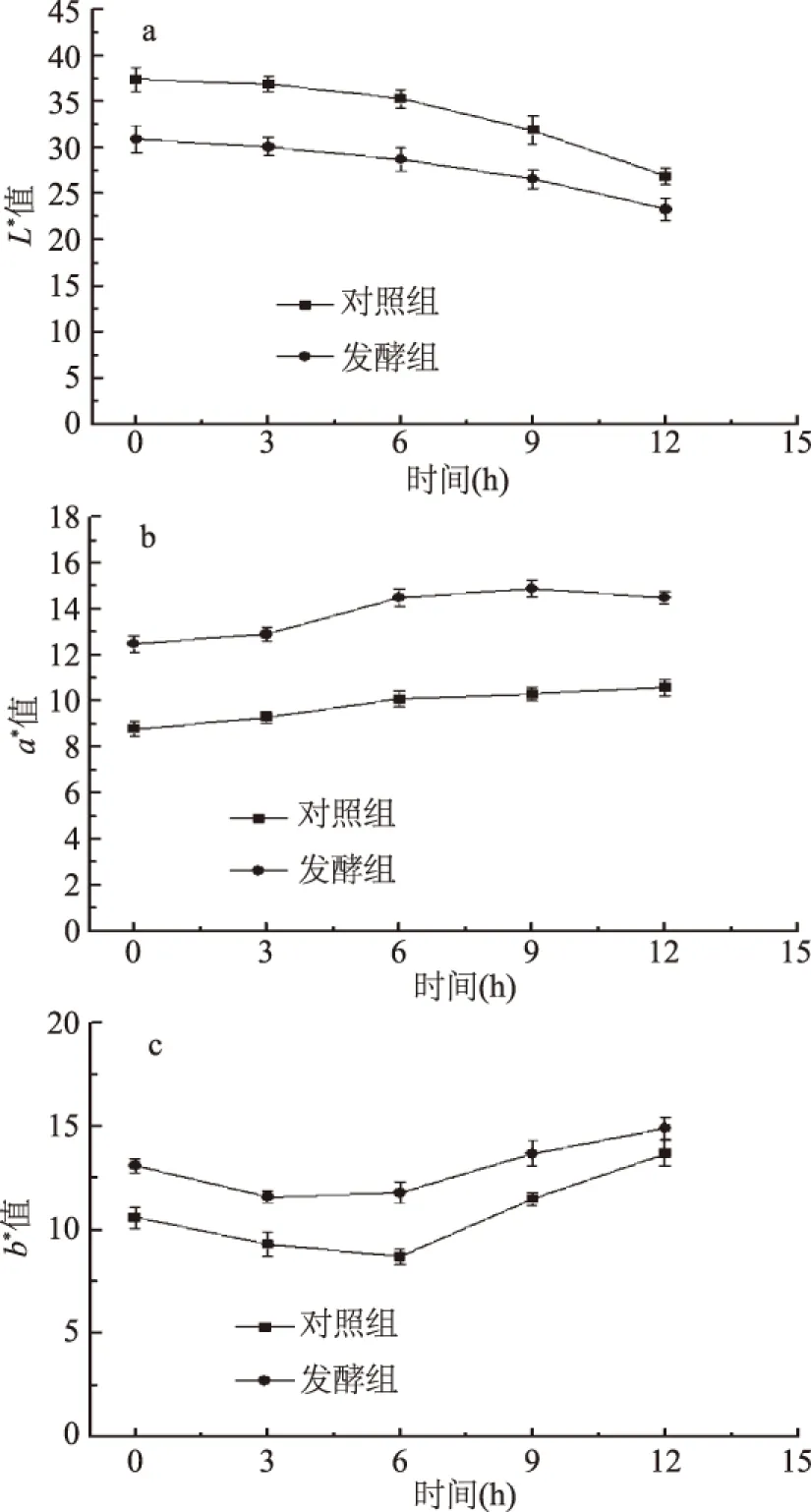
图1 红曲菌发酵对广式腊肠L*、a*、b*值的影响Fig.1 Influence of Monascus fermentation on the L*、a*、b* value of the Cantonese sausage
L*代表亮度,表示亮度由(L=100)到黑暗(L=0)之间变化;a*表示红色度,表示颜色由绿色(-a)到红色(+a)之间变化;b*代表黄色度表示蓝色(-b)到黄色(+b)之间的变化。
由图1中a、b、c可知,两组腊肠L*值均逐渐下降,且对照组的L*始终高于发酵组样品,发酵12 h后,两组L*差距变小,分析原因为红曲菌在发酵的过程中降低了腊肠的水分含量,致使两组腊肠的亮度随着发酵时间的延长而降低,发酵6 h后对照组显著下降(p<0.05),分析原因为对照腐败菌大量繁殖,使腊肠趋于腐败;两组腊肠a*呈一直升高的趋势,且发酵组远高于对照组,原因为红曲菌发酵降低了腊肠的水分含量,进而加深了腊肠的红色;6 h后,发酵组a*达到(14.73±0.43),对照组为(10.01±0.21);b*均随时间的变化是先减小后增大,发酵组始终高于对照组。由于红曲色素色调柔和、蛋白质着色性强,且对pH稳定,故在腊肠发酵期间,发酵组样品的色泽远优于对照组。
2.2 发酵时间对广式腊肠感官品质的影响
由图2可知,对照组腊肠色泽较浅,滋味一般,于6 h后开始出现色泽暗淡、腐臭等异味,9 h 后彻底腐败变质,无法食用;发酵组于3 h后,腊肠呈枣红色,外表有光泽;有腊香和醇香味,滋味较好,6 h 后腊香味纯正浓郁,具有中式香肠(腊肠)固有的风味,滋味鲜美,感官评价远优于对照组,9 h 后发酵味(类似于豆腐乳的味道)过重,开始出现异味,但滋味较鲜美。12 h后颜色进一步变差、出现腐臭味,因此未进行滋味评价。由此可知,红曲菌发酵能够有效改善广式腊肠的感官品质,改善腊肠保水性,使腊肠有较好的质构,发酵6 h后,广式腊肠不仅在色泽方面有很大改善,而且与未发酵广式腊肠比较,腊肠滋味更加鲜美、醇厚、无异味。为探究红曲菌发酵对广式腊肠滋味的影响,分别研究了红曲菌发酵广式腊肠pH、氨基酸态氮含量、蛋白质、肽、游离氨基酸等随发酵时间的变化情况。
2.3 发酵时间对广式腊肠氨基态氮含量和pH的影响
由图3可知,0~9 h内,红曲菌发酵组pH呈稳定的下降趋势,前3 h内pH下降较对照组慢,分析原因可能是红曲菌菌丝体在发酵前期有一定的抑菌作用,抑制了腐败菌的繁殖产酸,发酵6 h时pH为(5.62±0.24),此时腊肠坚实有弹性,发酵9 h时pH达到(5.27±0.12),之后开始上升;对照组腊肠在6 h内pH降低至(5.39±0.07),之后开始升高。在发酵初期,微生物利用糖类、脂肪等物质经过发酵产生乳酸、醋酸等有机酸,使腊肠的pH降低,发酵6 h后,当糖类物质逐渐减少,微生物转而利用蛋白质及其他含氮物质分解产生氨基酸,这些物质进一步生成胺类等碱性物质,导致腊肠的pH升高。

图3 红曲菌发酵对广式腊肠氨基态氮含量和pH的影响Fig.3 Influence of Monascus fermentation on the AAN content and pH value of the Cantonese sausage
在开始阶段,两组腊肠氨基态氮含量稍有差别,说明红曲菌发酵剂的加入带入了少量氨基态氮,但并不影响总体的趋势;随着发酵时间的增加,两组腊肠氨基肽含量均先升高后降低,发酵组氨基态氮含量在发酵3 h后远高于对照组,发酵组在前3 h内氨基态氮含量增加速度较快,可能是因为红曲菌产生的蛋白酶作用于大分子蛋白,使其分解为小分子多肽和游离氨基酸;6 h时,发酵组氨基态氮含量达到(0.139%±0.002%),远高于对照组(0.097%±0.004%),红曲菌发酵对广式腊肠中氨基酸含量有显著影响(p<0.05),而后续速度逐渐减慢直到9 h后开始减少,原因有可能是由于发酵后期脂肪氧化产生较多的醛、酮类物质,这些物质继而与氨基酸进行美拉德反应,进而产生更多的风味物质。由此可知,红曲菌发酵有助于腊肠蛋白质的降解,改善了腊肠的滋味,提高了腊肠的营养价值。
2.4 广式腊肠在发酵过程中总蛋白的SDS-PAGE分析
以分子量为10~170 kDa的marker为标准蛋白样品,分别取对照组和发酵组腊肠的水溶性和盐溶性蛋白,利用SDS-PAGE电泳技术测定两组样品中蛋白质质量分布的变化情况。
图4中a、b代表两组腊肠水溶性蛋白质分子量随着发酵时间的变化的分布情况,水溶性蛋白中的肌浆蛋白是主要成分,包括清蛋白、糖酵解酶、肌酸激酶、肌红蛋白等。在SDS-PAGE图谱上可清晰分辨出10~20条蛋白条带,对比对照组0 h和发酵组0 h的电泳条带可知,红曲菌发酵剂的添加并未带入新的水溶性蛋白质片段;对照组中分子质量为170 kDa的蛋白条带一直存在,分子质量为100 kDa的蛋白条带,经过9 h后消失,分子量40~55 kDa的蛋白条带逐渐变淡;发酵组中分子质量为170 kDa的蛋白条带于6 h后消失,分子质量为100 kDa的蛋白条变化不大,分析原因有可能是红曲菌抑制了其它杂菌生长,而其本身分解此类蛋白能力不强,分子量40~55 kDa的蛋白条带逐渐变淡,且降解速度明显快于对照组,分子质量在15 kDa的蛋白质条带在发酵3 h后消失,产生了分子质量为10 kDa的蛋白质片段;两组中分子量在35~40 kDa的蛋白片段比较稳定,很难降解;水溶性蛋白是存在于肌肉细胞肌浆中的水溶性蛋白质的总称,含有很多与物质代谢有关的酶蛋白,主要影响肉的呈味特性和色泽[21-22],由以上可知,红曲菌发酵广式腊肠其水溶性大分子蛋白总体有下降的趋势,红曲菌发酵有利于广式腊肠产生更多的小分子多肽,对广式腊肠的滋味方面有很大改善作用。
图4中c、d代表两组腊肠盐溶性蛋白质分子量随着发酵时间的变化的分布情况,典型的盐溶性蛋白肌是肌原纤维蛋白,主要成分是肌动蛋白、肌球蛋白及一些小分子量蛋白。对比对照组0 h和发酵0 h的电泳条带可知,红曲菌发酵剂的添加带入少许100~70 kDa蛋白片段,这与2.3中发酵时间对广式腊肠氨基态氮含量的影响结果一致;对照组腊肠170 kDa的蛋白片段于6 h后消失,40~55 kDa的蛋白片段于6 h后逐渐变淡;发酵组分子量170 kDa的蛋白片段于3 h后消失,产生了130 kDa的蛋白片段,40~55 kDa的蛋白片段于3h后逐渐消失,而分子量在35~40 kDa之间的蛋白质比较稳定,两组都无变化,分子量在15~25 kDa的片段对照组和发酵组变化差异较明显;盐溶性蛋白是由肌球蛋白、肌动蛋白、肌动球蛋白和肌钙蛋白等形成的复合体,与肉的持水性、乳化性和凝胶性有密切的联系,是肌肉中重要的蛋白质[23],由以上可知发酵组盐溶性蛋白在红曲菌的发酵作用下,大分子蛋白逐渐减少,小分子蛋白有增多,红曲菌发酵能加快广式腊肠盐溶性蛋白质的降解速度。

图4 对照组和发酵组腊肠发酵过程中水溶性蛋白和盐溶性蛋白的SDS-PAGE图谱Fig.4 SDS-PAGE pattern of water-soluble proteins and salt-soluble proteins throughout the fermenting in two groups注:a是对照组的水溶性蛋白,b是发酵组的水溶性蛋白,c是对照组的盐溶性蛋白,d是发酵组的盐溶性蛋白。
2.5 红曲菌发酵对广式腊肠中游离氨基酸含量变化的影响
由以上实验结果为依据,选择未发酵0 h组、发酵0 h组和发酵6 h组广式腊肠进行HPLC分析,测定发酵前后游离氨基酸含量的变化情况,结果见表2。

表2 红曲菌发酵广式腊肠游离氨基酸含量的变化
由表2中未发酵0 h组和发酵0 h组可知,红曲菌发酵剂的添加带入少部分游离氨基酸,但小于发酵6 h后产生的游离氨基酸含量,红曲菌发酵使腊肠蛋白发生一定程度的降解,产生游离氨基酸,对腊肠滋味具有很大增强作用,广式腊肠经过红曲菌发酵后游离氨基酸总量显著增加(p<0.05),发酵6 h后其总量氨基酸增加到930 mg/100 g;各类呈味氨基酸含量均有增加,使发酵组滋味更加丰富、浓郁,其中含量最高的为食品鲜味谷氨酸,增加了2倍,具有花香气味的丙氨酸高居第二,含量大幅度增加,具有肉香味的亮氨酸和甜味的脯氨酸依次排列,天冬氨酸增加了2倍,是腊肠鲜味的主要贡献者;呈甜味的丝氨酸、甘氨酸、苏氨酸、丙氨酸和丙氨酸都有1~2倍的增加幅度,使红曲发酵腊肠味道更加甘甜,这几种氨基酸对腊肠制品最终的特征风味有重大影响[24]。游离氨基酸含量增加,有助于改善腊肠的风味,肉中内源酶分解和微生物发酵均会使游离氨基酸含量增加[25-26],由此可见,广式腊肠经过红曲菌发酵后游离氨基酸总量显著增加,使发酵组滋味更加丰富、浓郁。
3 结论
红曲菌发酵能够加深广式腊肠的红色、增加氨基酸态氮含量,使产品色泽更加诱人,滋味更加醇厚;红曲菌发酵对广式腊肠中水溶性蛋白质及盐溶性蛋白质中的大分子蛋白降解均有促进作用,增加了产品中小分子肽及游离氨基酸的总量,游离氨基酸总量增加到930 mg/100 g,其中谷氨酸、丙氨酸、肉香味的亮氨酸和甜味的脯氨酸含量都有显著增多(p<0.05)。改善了广式腊肠的滋味,提高了广式腊肠的营养价值。
[1]夏文水. 肉制品加工原理与技术[M]. 北京:化学工业出版社,2005:195-213.
[2]吴燕涛,穆同娜,李蓓,等. 我国广式腊肠研究进展[J]. 食品科学,2011,32(1):246-250.
[3]Zeng W,Wen W,Deng Y,et al. Chinese ethnic meat products:Continuity and development[J]. Meat Science,2016,120:37-46.
[4]刘成国,龙昊,娄爱华,等. 热风干燥条件对中式腊肠微生物及质构特性的影响[J]. 食品与机械,2012(4):42-46.
[5]张文龙,杜明,洛铁男,等. 肉品发酵剂的研究发展现状[J]. 食品工业科技,2012,33(19):377-381.
[6]李湘丽,袁廷香,闫吉美. 乳酸菌在发酵香肠生产过程中的应用研究进展[J]. 食品与机械,2014(6):233-237.
[7]王恺,慕妮,李亮,等. 不同发酵剂对发酵香肠挥发性风味物质的影响[J]. 食品工业科技,2013,34(14):177-181.
[8]傅金泉.中国红曲实用技术[M]. 北京:中国轻工业出版社,1997:1-23.
[9]Shen F,Wang C L,Shyu Y T. Fermentation ofMonascuspurpureus on Bacterial Cellulose-nata and the Color Stability of Monascus-nata Complex[J]. Journal of Food Science,2000,65(2):342-345.
[10]Liu D C,Wu S W,Tan F J. Effects of addition of anka rice on the qualities of low-nitrite Chinese sausages[J]. Food Chemistry,2010,118(2):245-250.
[11]Kim D W. Quality characteristics of sausage added red yeast rice[J]. Korean Journal of Food Preservation,2013,20(6):805-809.
[12]Vendruscolo F,Buhler R M M,De Carvalho J C,et al.Monascus:a Reality on the Production and Application of Microbial Pigments[J]. Applied Biochemistry and Biotechnology,2016,178(2):211-223.
[13]周文斌,贾瑞博,李燕,等. 红曲色素组分,功效活性及其应用研究进展[J]. 中国酿造,2016,35(7):6-10.
[14]Yu X,Wu H,Zhang J. Effect ofMonascusas a nitrite substitute on color,lipid oxidation,and proteolysis of fermented meat mince[J]. Food Science and Biotechnology,2015,24(2):575-581.
[15]Chen W,He Y,Zhou Y,et al. Edible filamentous fungi from the speciesMonascus:early traditional fermentations,modern molecular biology,and future genomics[J]. Comprehensive Reviews in Food Science and Food Safety,2015,14(5):555-567.
[16]Nimnoi P,Lumyong S. Improving solid-state fermentation ofMonascuspurpureus on agricultural products for pigment production[J]. Food and Bioprocess Technology,2011,4(8):1384-1390.
[17]Hughes M C,Kerry J P,Arendt E K,et al. Characterization of proteolysis during the ripening of semi-dry fermented sausages[J]. Meat Science,2002,62(2):205-216.
[18]Yin L J,Lu M C,Pan C L,et al. Effect ofMonascusfermentation on the characteristics of mackerel mince[J]. Journal of Food Science,2005,70(1):S66-S72.
[19]索化夷,骞宇,阚建全. 传统发酵永川毛霉型豆豉蛋白质提取方法比较与降解规律研究[J]. 食品科学,2013,34(23):180-183.
[20]杨月欣. 实用食物营养成分分析手册[M]. 北京:中国轻工业出版社,2006:47-52.
[21]Joo S T,Kauffman R G,Kim B C,et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat Science,1999,52(3):291-297.
[22]Gallagher S R. One-Dimensional SDS Gel Electrophoresis of Proteins[J].Current Protocols in Protein Science,2012,10:A.3F.1-A.3F.38.
[23]Sun W,Zhou F,Sun D W,et al. Effect of Oxidation on the Emulsifying Properties of Myofibrillar Proteins[J]. Food & Bioprocess Technology,2013,6(7):1703-1712.
[24]石琳,尹园,王帅,等. 红曲霉发酵高温豆粕高产可溶性多肽[J]. 食品科学,2015,36(19):137-142.
[25]Lopez C M,Bru E,Vignolo G M,et al. Identification of small peptides arising from hydrolysis of meat proteins in dry fermented sausages[J]. Meat Science,2015,104:20-29.
[26]Demasi T W,Wardlaw F B,Dick R L,et al. Nonprotein Nitrogen(NPN)and free amino acid contents of dry,fermented and nonfermented sausages.[J]. Meat Science,1990,27(1):1-12.
Effect ofMonascusfermentation on color and proteolysis of Cantonese sausage
JIN Er-qing,LIAO Shun,PENG Cong,WANG Qian-qian,WU Jian-zhong*
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
The effects of GIM3.439Monascusfermentation on the Cantonese sausage was determined during fermentation conditions by comparing the color,pH,amino acidic nitrogen and sensory quality. The SDS-polyacrylamide gelelectrophoresis(SDS-PAGE)and high performance liquid chromatography(HPLC)were used to study the changes of protein,peptide and free amino acid(FAA)during fermentation in Cantonese sausage. The results showed that the color of the fermented sausages is much redder than the control group. The content of amino acidic nitrogen of fermented sausages increased to 0.14%. SDS-PAGE pattern of water-soluble proteins and salt-soluble proteins throughout the fermenting in two groups indicated that fermentation ofMonascuscan promote the degradation of water-soluble and salt-soluble macromolecule proteins,and increase the total amount of small peptide and free amino acid in the product. The total amount of free amino acids increased from 580 mg/100 g to 930 mg/100 g.Monascusfermentation not only makes the product more attractive color,but also enriched the free amino acid content of sausage,and improve the sensory quality and nutritional value of sausage.
Monascus;fermentation;Cantonese sausage;protein;proteolysis
2016-11-17
金二庆(1992-),女,硕士研究生,研究方向:肉制品与蛋白质,E-mail:JIN132491@163.com。
*通讯作者:吴建中(1964-),男,博士,副教授,研究方向:农副产品的深加工及综合利用,E-mail:wjzxlyx@sina.com。
农业部农业科技成果转化项目(2014GB2E000037);广东省星火计划科技计划项目(2013B020503051)。
TS251.5
A
1002-0306(2017)09-0139-06
10.13386/j.issn1002-0306.2017.09.018
