桦树叶黄酮提取物对人脐静脉内皮细胞抗氧化活性的研究
2017-06-05苗欣宇文连奎
刘 玥,苗欣宇,文连奎
(吉林农业大学食品科学与工程学院,吉林长春 130118)
桦树叶黄酮提取物对人脐静脉内皮细胞抗氧化活性的研究
刘 玥,苗欣宇,文连奎*
(吉林农业大学食品科学与工程学院,吉林长春 130118)
本实验对白桦叶黄酮提取物是否具有体外抗氧化作用以及是否能够预防HUVEC(Human Umbilical Vein Endothelial Cells,人脐静脉内皮细胞)细胞的氧化损伤进行了研究。通过测定白桦叶黄酮提取物清除DPPH自由基、羟基自由基、ABTS自由基、还原能力以及培养细胞SOD、GSH-PX活力、T-AOC总抗氧化能力,研究白桦叶黄酮提取物的体外抗自由基作用和对细胞损伤的预防作用。实验结果表明:白桦叶黄酮提取物浓度为0.20 mg/mL时,DPPH自由基清除率为86.89%;浓度为0.18 mg/mL时,ABTS自由基清除率为96.26%;黄酮提取物浓度为1.9 mg/mL时,羟基自由基清除率为71.18%。当白桦叶黄酮提取物浓度为10 μg/mL时可极显著增强细胞的SOD活力、GSH-PX活力以及提高细胞中活性氧水平和总的抗氧化能力(p<0.01)。实验结果表明白桦叶黄酮提取物具有明显的抗自由基作用和预防细胞氧化损伤作用。
桦树叶,黄酮提取物,体外抗氧化,HUVEC
白桦(Betula platyphylla Suk.)系桦木科桦属乔木,产于东北、华北、河南、陕西、宁夏、甘肃、青海、四川、云南、西藏东南部。适应性强,分布广[1]。叶厚纸质,三角状卵形,三角状菱形,三角形,少有菱状卵形和宽卵形,叶片中含有黄酮类、三萜皂苷类和酚酸类物质,具有利尿作用[2]。
黄酮类化合物是在植物中分布广泛的一类化合物,它存在于高等植物及羊齿植物的根、茎、叶、花、果实等中,不仅数量种类繁多,而且结构类型复杂多样[3]。研究表明黄酮类化合物具有良好的生物活性功能,如抗病毒、抗菌、抗肿瘤、抗疲劳、以及清除自由基和抗氧化的作用[4]。
目前对于白桦叶的研究主要在精油的抑菌和抗氧化方面,王素娟等人对白桦叶的化学成分进行了分析,从白桦叶中分离得到了9个化合物,并根据理化性质和波谱数据确定了相应的成分[5];段晓玲等人对白桦叶精油的抑菌和抗氧化的活性成分进行研究,通过气相色谱-质谱(GC-MS)法分析其挥发性化学成分[6]。而有关白桦叶中黄酮类化合物的体外抗氧化作用还未见报道。本实验研究白桦叶黄酮提取物的抗氧化作用,为其药理研究以及相关产品研发提供理论依据。
1 材料与方法
1.1 材料与仪器
桦树叶黄酮提取物(实验室自制:采用超声波法提取、NKA-9大孔吸附树脂纯化,经芦丁标准曲线法测定黄酮类化合物含量为68.5%)。HUVEC细胞株 上海中乔新舟生物科技有限公司;无水乙醇(分析纯) 天津市富宇精细化工有限公司;95%乙醇(分析纯)、甲醇(分析纯)、浓盐酸(分析纯) 北京化工厂;FeCl3(分析纯)、TCA(三氯乙酸)、氢氧化钠(分析纯) 天津市博迪化工股份有限公司; 硝酸铝(分析纯) 天津市致远化学试剂有限公司; K2S2O8(分析纯) 西陇化工股份有限公司;KH2PO4(分析纯)、Na2HPO4(分析纯)、NaH2PO4(分析纯)、Na2EDTA(分析纯) 天津市北晨方正试剂厂; 抗坏血酸(VC)、铁氰化钾(分析纯)二叔丁基对甲酚 Aladdin(阿拉丁);H2O2(分析纯) 天津市福晨化学试剂厂;TBA(硫代巴比妥酸) 上海展云化工有限公司; DPPH 南京奥多福尼生物科技有限公司;ABTS、PBS溶液 天津市瑞金特化学品有限公司;DMSO(分析纯) 天津市恒兴化学试剂制造有限公司;1640培养基 Hyclone;胎牛血清(500 mL)MTT(噻唑兰)Sigma(分)芦丁标准品 酷尔化学科技(北京)有限公司;NKA-9大孔吸附树脂 天津市光复精细化工研究所;T-AOC试剂盒 南京建成生物工程研究所;GSH-PX试剂盒、SOD试剂盒 南京建成生物工程研究所。
pH计 梅特勒-托利多仪器(上海)有限公司;高速离心机 Eppendorf公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;酶标仪 Thermo Scientific公司;CO2培养箱 Thermo Scientific公司;倒置显微镜 上海波爱姆光学仪器制造有限公司。
1.2 实验方法
1.2.1 DPPH自由基清除实验 采用李熙灿教授方法[7],部分有改动。取2.5 mg DPPH定容至60 mL无水乙醇中,超声溶解5 min,测定吸光值,A值范围在1.2~1.3之间。将样品以及阳性对照品VC、BHT用无水乙醇配制成浓度为0.02,0.04,0.06,0.08,0.10,0.12,0.14,0.16,0.18,0.20 mg/mL的溶液。取DPPH溶液2 mL加入试管中,加入1 mL无水乙醇充分混合,在519 nm测定吸光值为A0。取DPPH溶液2 mL加入试管中,加入样品液0.5 mL,无水乙醇0.5 mL,避光静置30 min后测定吸光值为A。每次测量A值时需要重新测定相应的A0。
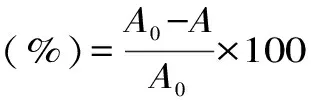
式(1)
式(1)中:A0空白组吸光值;A为样品组及阳性对照组吸光值。
1.2.2ABTS自由基清除实验 采用李熙灿教授方法[8],部分有改动。配制好的ABTS储备液放置黑暗室温12h备用。将ABTS储备液用无水乙醇稀释50倍,测定吸光值,范围在0.7±0.02,此溶液为ABTS+工作液。取上述1.6mLABTS+工作液与0.4mL无水乙醇充分混合,静置6min后,测得A值为A0。取1.6mLABTS+工作液与0.4mL样品溶液充分混合,静置6min后,测得A值为A。
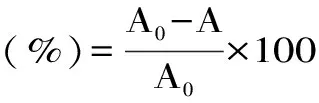
式(2)
式(2)中:A0空白组吸光值;A为样品组及阳性对照组吸光值。
1.2.3 羟基自由基清除能力 采用李熙灿教授方法[9],部分有改动。样品和BHT选用固体1、2、3、4、5、6、7、8、9、10mg。取0.2mol/L缓冲液2mL加入固体样品中,混合均匀,依次加入50mmol/L脱氧核糖250μL,1mmol/LNa2EDTA250μL,3.2mmol/LFeCl3250μL,50mmol/LH2O2250μL,1.8mmol/L抗坏血酸250μL,50 ℃水浴加热20min后,依次加入10%TCA500μL,5%TBA150μL,105 ℃加热15min,在530nm条件下测定吸光值。A0为无样品添加组,A为样品添加组。
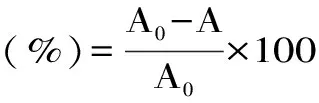
式(3)
式(3)中:A0空白组吸光值;A为样品组及阳性对照组吸光值。
1.2.4 还原能力测定 将样品以及阳性对照品VC、BHT用无水乙醇配制成浓度为0.02,0.04,0.06,0.08,0.10,0.12,0.14,0.16,0.18,0.20mg/mL的溶液。取样品溶液1.0mL,加入PBS2.5mL、1%铁氰化钾2.5mL,将上述溶液混合均匀后50 ℃水浴加热20min后,加入10%三氯乙酸2.5mL,3000r/min离心10min,精密吸取上清液2.5mL,加入蒸馏水2.5mL、0.1%FeCl30.5mL,在700nm处测定吸光度[10]。
1.2.5HUVEC细胞抗氧化实验
1.2.5.1 细胞的复苏 从液氮罐中取出冻存管,在37 ℃水浴中迅速融化,1000r/min离心10min,弃去上清液,加入3mL10%胎牛血清的1640细胞培养液,吹打成悬浮液后转移至细胞培养瓶[11]。
1.2.5.2 细胞的传代 步骤一,弃去培养瓶中培养液,在瓶中滴加2mLPBS,轻轻摇晃后小心弃去;步骤二,加入2mL胰酶,37 ℃培养箱恒温培养2min,在显微镜下观看细胞形态,如果细胞撑圆鼓胀且不成片聚集,即刻加入10%胎牛血清的1640细胞培养液5mL终止消化。步骤三,吹打成悬浮液,1000r/min离心5min后弃去培养液,加入10%胎牛血清的1640细胞培养液3mL,以每个培养瓶1.5mL的量均匀分至两个细胞培养瓶中,37 ℃培养箱恒温培养[12]。
1.2.5.3 细胞的冻存 步骤一、步骤二同细胞的传代;步骤三,吹打成悬浮液,1000r/min离心5min后弃去培养液,加入冻存液,分至冻存管中,采用梯度降温法,4 ℃冰箱降温30min,-20 ℃冰箱降温2h直至完全冻实,然后放置于-80 ℃冰箱过夜,次日转移至液氮罐中冻存[13]。
1.2.5.4MTT毒理实验 将样品溶液按照终浓度为0.5、2.5、5、10、25、50、100、250μg/mL配制成8个梯度;收集对数期细胞制备成细胞悬浮液,在96孔板中37 ℃培养24h;待孔板底部长满细胞后,弃去培养液,无血清路线培养4h;空白组后续不加任何试剂;不加AngⅡ组加入黄酮样品液后培养24h;加AngⅡ组加入黄酮样品液后培养18h,加入AngII培养6h;以上两组每孔加入MTT后,继续培养4h;小心弃去培养液后,每孔加入DMSO终止培养,将孔板置于摇床低速振荡10min,使结晶充分溶解。在490nm处用酶标仪测定吸光值,筛选出低、中、高三个浓度组[14]。
1.2.5.5SOD、GSH-PX、T-AOC试剂盒实验 选用已筛选出的三个浓度组进行实验。步骤一同细胞的传代;步骤二,加入2mL胰酶,37 ℃培养箱恒温培养2min,加入含10% 胎牛血清的1640细胞培养液13~14mL终止消化;步骤三,吹打细胞成悬浮液,以每孔1mL的量转移至十二孔板中,过夜培养至细胞长满孔板底部;步骤四,小心吸取培养液后,无血清培养路线培养4h;步骤五,空白对照组加入黄酮样本培养24h,预防组加入黄酮样本培养18h;步骤六,预防组加入AngII培养6h[15]。步骤七,预防组和空白对照组均弃去培养液加入胰酶消化1min后,加入无血清1640培养液转移至EP管中,-20 ℃储存,用于SOD、GSH-PX、T-AOC的测定。
1.4 数据分析
各实验组数据用SPSS22.0作单因素方差分析和LSD均数间多重比较。
2 结果与分析
2.1DPPH自由基清除实验结果
从图1中可以看出,样品组随着溶液浓度的增加,清除率呈递增趋势,在0.20mg/mL时,最大清除率达到86.89%,说明桦树叶黄酮具有良好的清除DPPH自由基能力。

图1 桦树叶黄酮对DPPH自由基的清除作用Fig.1 DPPH radical scavenging activities of flavonoids from birch leaves
2.2 ABTS自由基清除实验结果
从图2中可以看出,黄酮提取物溶液具有良好清除ABTS自由基能力,随着浓度增加,其抗氧化能力呈上升趋势,当浓度达到0.18 mg/mL时达到最大清除率96.26%,与阳性对照品清除率十分接近,证明有良好的清除ABTS自由基能力。
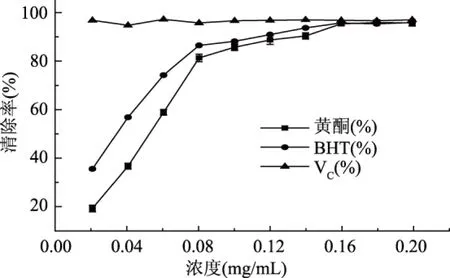
图2 桦树叶黄酮对ABTS自由基的清除作用Fig. 2 ABTS radical scavenging activities of flavonoids from birch leaves
2.3 羟基自由基清除实验结果
由图3可以看出,黄酮样品的清除率高于阳性对照品BHT,在使用量为1.9 mg/mL时,清除率达到71.18%,而BHT清除率为50.50%。具有良好的清除羟基自由基效果。

图3 桦树叶黄酮对羟基自由基的清除作用Fig.3 Hydroxyl free radical scavenging activities of flavonoids from birch leaves
2.4 还原能力实验结果
由图4可见,黄酮提取物溶液的还原能力随着浓度的增大,有缓慢的递增趋势,变化并不明显。
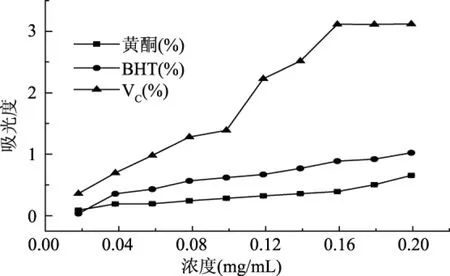
图4 桦树叶黄酮的还原能力Fig.4 Reducing power of flavonoids from birch leaves
2.5 MTT毒理实验结果
如图5(无ANGⅡ损伤对照组)所示,空白组随着溶液浓度的增加呈递增趋势,当溶液浓度为5 μg/mL时,与空白组呈显著差异;当溶液浓度为10、25 μg/mL时,与空白组呈极显著差异(p<0.01),并且在浓度为10 μg/mL时吸光度达到峰值,此时细胞活力最高,而当浓度继续增高时,吸光度下降,此时已超出细胞所能融合的最大黄酮浓度,细胞活力降低,呈高浓度抑制现象。同样,在图6(含ANGⅡ损伤对照组)中,ANGⅡ预防组在10 μg/mL时吸光度达到峰值,而当浓度继续增高时,吸光度下降,这表明溶液浓度继续增高对细胞的活力有抑制作用,预防损伤的能力降低。综合以上实验结果,选取最优浓度10 μg/mL为中浓度组,5 μg/mL为低浓度组,25 μg/mL为高浓度组。

图5 MTT毒理实验Fig.5 Results of determined by MTT toxicology experiment注:*p<0.05;**p<0.01表示与空白组相比有显著、极显著差异,图6同。

图6 MTT毒理实验Fig.6 Results of determined by MTT toxicology experiment
2.6 T-AOC、SOD、GSH-Px试剂盒实验
2.6.1 T-AOC试剂盒实验结果 机体防御体系的抗氧化能力的强弱与健康程度存在着密切联系,该防御体系有酶促与非酶促两个体系,许多酶是以微量元素为活性中心,非酶促反应体系中主要为维生素、氨基酸和金属蛋白质。机体中有许多抗氧化物质,能使Fe3+还原成Fe2+,后者可与菲啉类物质形成稳固的络合物,通过比色可测出其抗氧化能力的高低[17]。如图7所示,预防组和空白组的低、中、高浓度组均与ANGⅡ对照组和空白对照组呈高度显著差异(p<0.01),其中中浓度组抗氧化能力优于低浓度组与高浓度组,与阳性对照VC组抗氧化能力接近,结果表明桦树叶黄酮提取物的添加能够显著增加细胞的总抗氧化能力,中浓度组效果最佳。

图7 桦树叶总黄酮对HUVEC总的抗氧化能力的影响Fig.7 Effects of total flavonoids from birch leaves on T-AOC of HUVEC注:图中*为实验组与空白组之间的差异显著性, *:p<0.05,**:p<0.01;#为实验组与ANGⅡ组之间的差异显著性,#:p<0.05,##:p<0.01,图8、图9同。
2.6.2 SOD试剂盒实验结果 SOD是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中的有害物质,对人体能够起到抗衰老的作用[18]。如图8所示,预防组与空白组均与空白对照组和ANGⅡ组呈高度显著差异(p<0.01),其中预防组中浓度组活力远优于低浓度组和高浓度组,空白组实验结果相同,其中空白对照组和预防组的低浓度组均低于空白组但高于ANGⅡ组,表明在SOD实验中低浓度已经不能提高细胞SOD活力,但黄酮提取物的添加仍然可以一定程度的预防细胞氧化损伤。这表明桦树叶黄酮提取物有良好的清除氧自由基、提升细胞中SOD活力的功能。

图8 桦树叶总黄酮对HUVEC中SOD的影响Fig.8 Effects of total flavonoids from birch leaves on SOD of HUVEC
2.6.3 GSH-Px试剂盒实验结果 谷胱甘肽过氧化物酶是机体内广泛存在的一种重要的催化过氧化氢分解的酶。它特异的催化还原型谷胱甘肽(GSH)对过氧化氢的还原反应,可以起到保护细胞膜结构和功能完整的作用[19]。如图9所示,除预防组低浓度组与空白组无显著差异外,其余均与空白组有高度显著差异(p<0.01),高浓度组的GSH-Px活力要优于中浓度组。这与前三组试剂盒实验结果有所不同,高浓度并没有产生对细胞活力的抑制作用。

图9 桦树叶总黄酮对HUVEC中GSH-Px的影响Fig.9 Effects of total flavonoids from birch leaves on GSH-PX of HUVEC
3 讨论与结论
由于人体需要经常与外界进行接触,例如呼吸、放射线照射、污染物等,导致人体体内会不断的产生自由基,科学研究表明过量的自由基堆积会导致癌症、衰老等疾病。SOD、GSH-Px是生物体内非常重要的抗氧化酶,可以有效的清除体内自由基,有十分重要的机体抗氧化损伤作用[20]。
本实验过程中,应用原料为实验室自制桦树叶黄酮提取物,并没有分析提取物中的黄酮组分,在GSH-Px试剂盒实验中,呈现出了高浓度组在预防损伤组、空白组明显优于中浓度组,并没有呈现出高浓度抑制细胞活力,这与其他三组试剂盒实验有所不同,原因可能是粗提物中的不同黄酮化合物对酶的生理活性有所影响从而导致细胞活力的增加,建议对黄酮提取物中具体的黄酮组分进行研究。
实验结果表明,当桦树叶黄酮提取物浓度为0.20 mg/mL时,DPPH自由基清除率为86.89%;浓度为0.18 mg/mL时,ABTS自由基清除率为96.26%;浓度为1.9 mg/mL时,羟基自由基清除率为71.18%。当白桦叶黄酮提取物浓度为10 μg/mL时可极显著(p<0.01)增强细胞的SOD活力、GSH-Px活力和总的抗氧化能力,可以有效的预防HUVEC氧化损伤,这说明桦树叶黄酮提取物是良好的自由基清除剂。
[1]白桦Betula platyphylla Suk.中国植物志[M].(1979)[2016-9-4].http://frps.eflora.cn/frps/Betula%20platyphylla.
[2]李薇,李岩,金雄杰.白桦三萜类物质的抗肿瘤作用及其对免疫功能的增强效应[J].中国免疫学杂志,2000,16(9):485-487.
[3]Bandele Omari J,Osheroff Neil..Bioflavonoids as poisons of human topoisomerase II alpha and II beta.[J]. Biochemistry,2007,46(20):6097-6108.
[4]田瑶.蓝莓中黄酮类物质的提取、分离纯化及生物活性研究[D].东北农业大学,2012.
[5]段晓玲,王海英,杨国亭,等.白桦叶精油的抑菌和抗氧化活性成分分析[J].安徽农业科学,2014,42(33):11746-11748.
[6]延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(09):1534-1544.
[7]Xican Li,Xiaoting Wu,Ling Huang.Correlation between Antioxidant Activities and Phenolic Contents of Radix Angelicae Sinensis(Danggui)[J].Molecules,2009,10(14):5349-5361.
[8]Xican Li,Jing Lin,Yaoxiang Gao,et al.Antioxidant activity and mechanism of Rhizoma Cimicifugae.[J].Chemistry Central Journal,2012,6(1):1-10.
[9]Xican Li.Solvent effects and improvements in the deoxyribose degradation assay for hydroxyl radical-scavenging[J].Food Chemistry,2013,141(3):2082-2088.
[10]李庆明,莫开菊.几种松针水提液抗氧化活性的比较[J].湖北民族学院学报:自然科学版,2008,26(2):212-216.
[11]吴玉兰.金樱子总黄酮对氧化损伤HUVEC保护作用的研究[D].衡阳:南华大学,2012.
[12]毛文东.芹菜苷对HUVEC高血压损伤模型作用机制[D].扬州:扬州大学,2015.
[13]申玉莉.染料木黄酮对电离辐射所致HUVEC损伤的防护作用及其机理的研究[D].武汉:湖北中医药大学,2013.
[14]G K Prashanth,P A Prashanth,Y Tejabhiram,et al.ZnO nanopellets have selective anticancer activity[J].Materials Science & Engineering,2016,39(62):919-926.
[15]李熙灿,周健洪,黎晖,等.荜茇提取物对大鼠骨髓间质干细胞MSC的增殖作用及与化学官能团的关系[J].中药材,2005,28(07):570-574.
[16]黄儒强,李娘辉,黄科礼,等.山稔子黄酮类提取物抗自由基作用及体内抗氧化功能的研究[J].食品科学,2008,29(09):588-590.
[17]陈慧婵,裴斐,杨文建,等.金针菇、香菇和蛹虫草对小鼠体内抗氧化酶活性的影响[J].食品科学,2014,35(01):219-223.
[18]赵建,宋亮楠,刘薇,等.ORAC法测定保健食品抗氧化能力的体内外实验对比分析[J].食品科学,2011,32(15):103-108.
[19]胥莉,李阳,刘学波.车前子总黄酮和总多糖粗提物的体外抗氧化性能及其对脑神经细胞的保护作用[J].食品科学,2013,34(11):142-146.
[20]崔志文,黄琴,黄怡,等.鼠李糖乳酸杆菌对Caco-2细胞抗氧化功能的影响[J].中国农业科学,2011,44(23):4926-4932.
Study on the influence of flavonoid extracts from brich leaves on antioxidant activity of human umbilical vein endothelial cells
LIU Yue,MIAO Xin-yu,WEN Lian-kui*
(Jilin Agriculture University,College of Food Science and Technology,Changchun 130118,China)
This paper is to identify the anti-oxidative effectinvitroof the birch leaf flavonoids and their preventive effects on HUVEC cells from oxidative damages. Experiments are performed to determine the capabilities of the birch leaf flavonoids to eliminate the DPPH radicals,hydroxyl radicals and ABTS radicals,and their reductive activity as well as the cellular SOD,GSH-PX activities,and T-AOC were measured in order to prove that the birch leaf flavonoids are capable of resisting the radicalsinvitroand preventing the cellular damages. Results demonstrated the birch leaf flavonoids(0.20 mg/mL)could scavenge the DPPH radicals by 86.89%,ABTS radical by 96.26% at 0.18 mg/mL,and the hydroxyl radicals fall by 50.50% in presence of 1.9 mg/mL flavonoids. The cellular SOD,GSH-PX and T-AOC were significantly enhanced by the 10 μg/mL flavonoids(p<0.01). It’s concluded that the birch leaf flavonoids markedly scavenge(free)radicals and prevent cells from oxidative damages.
birch leaf;flavonoids;invitroantioxidation;human umbilical vein endothelial cell(HUVEC)
2016-10-28
刘玥(1991-),女,硕士研究生,研究方向:果蔬贮藏加工工程,E-mail:8577aimishi@sina.com。
*通讯作者:文连奎(1962-),博士,教授,研究方向:长白山野生植物资源开发利用,E-mail:wenliankui@163.com。
TS201.2
A
1002-0306(2017)09-0082-05
10.13386/j.issn1002-0306.2017.09.007
