不同氮源组成麦汁对酿酒酵母发酵性能的影响
2017-06-05周永婧阳辉蓉涂京霞赵海锋
周永婧,卢 敏,阳辉蓉,涂京霞,赵海锋,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.广州珠江啤酒股份有限公司,广东广州 510308)
不同氮源组成麦汁对酿酒酵母发酵性能的影响
周永婧1,卢 敏1,阳辉蓉1,涂京霞2,赵海锋1,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.广州珠江啤酒股份有限公司,广东广州 510308)
研究了酿酒酵母Saccharomycespastorianus(FBY0095)在六种不同氮源组成麦汁(20 °P)中生物量、表观发酵度、乙醇浓度以及游离氨基氮(FAN)消耗量等指标的差异。结果表明,在20 °P超高浓麦汁发酵中,麦汁氮源含量和组成对酵母发酵性能具有显著影响。随着麦汁中可同化氮量的提高,加速了酵母对糖的吸收利用,提高了酵母稳定期生物量和乙醇产量,发酵时间缩短了20%。当氮源匮乏(约为FAN=124.59 mg/L)时,补充适量大豆分离蛋白水解物(SPIH)于超高浓麦汁中,增加了麦汁氮源的多样性,使菌体增长量提高8.3%,乙醇产量提高4.43%,是酵母生长的有效氮源。
酿酒酵母,氮源,超高浓麦汁,发酵性能,大豆分离蛋白水解物
在啤酒酿造过程中,氮是酵母细胞生长和代谢的必需营养元素。麦汁中酵母可利用的含氮物质称为游离氨基氮(FAN)[1],主要包括游离氨基酸、铵离子、二肽和三肽等小分子肽,其在酵母细胞代谢过程中并不能被全部利用。发酵初期,酵母的增殖伴随着对氮源的快速吸收利用,发酵后期,酵母细胞对氮源的利用也随之降低甚至终止。
适当的氮源含量和多样性是影响工业发酵和产品质量的重要因素[2]。啤酒发酵所需的最佳氮源水平随着麦汁浓度和菌种而有所差异[3-4],氮源匮乏是发酵延缓或停滞的主要原因之一[5-6]。因此,适量的 FAN 水平是维持酵母正常生长和发酵的基本保障[7]。Piddocke等[3]发现酵母菌株在高浓酿造中需要更多的 FAN 来抵抗渗透压和其它环境胁迫。在乙醇发酵中,蛋白胨等复杂氮源的存在则可以提高酵母生物量和乙醇产量[2,8-10]。近年来,随着人们对肽类物质的深入了解,发现有部分肽对生物机体具有一定生理功能,在生物机体的细胞生理及代谢调节上具有非常重要的作用[11]。万春艳等[12]研究发现,在啤酒发酵培养基中加入大豆蛋白水解物,可以增加氮源的复杂性从而具有促进啤酒发酵的作用。
因此,探明适合啤酒超高浓酿造的氮源组成和含量至关重要。本研究通过对比六种不同氮源组成的超高浓度麦汁对酿酒酵母增殖和发酵性能的影响,以期确定适合于供试酵母菌株超高浓麦汁发酵的最佳氮源组成,提高酵母的发酵性能,缩短发酵周期。
1 材料与方法
1.1 材料与仪器
酿酒酵母FBY0095(Saccharomycespastorianus) 由华南理工大学食品生物技术研究室筛选并保藏;大豆分离蛋白 蛋白含量85.12%,广州合诚实业有限公司;Protamex蛋白酶 酶活力8.5×104U/g,诺维信公司;大麦芽、糖浆 广州珠江啤酒股份有限公司;实验所用试剂 均为分析纯。

表1 六种麦汁组成成分表
全自动糖化仪 杭州博日科技有限公司;低温培养箱 上海一恒科技有限公司;UV2100 紫外可见分光光度计 上海尤尼柯仪器有限公司;Waters 600型高效液相色谱仪 美国Waters公司;3-18K型高速冷冻离心机 德国Sigma公司;SW-CJ-2FD超净工作台 上海浦东悦新科学仪器厂;A300全自动氨基酸分析仪 德国MenbraPure公司。
1.2 实验方法
1.2.1 大豆蛋白水解物(SPIH)的制备方法 大豆分离蛋白按1∶15(m/v)溶于水,均质,调pH至7.0,加入Protamex蛋白酶([E]/[S]=1%),于50 ℃恒温酶解9 h。然后沸水浴灭酶10 min,离心(4 ℃,8000 r/min,15 min),上清液冷冻干燥,即得大豆蛋白酶解物(SPIH),按下式计算水解度(DH)[13]。
DH(%)=(水解液氨态氮含量/水解液总氮含量)×100
式(1)
式(1)中:上清液的总氮含量采用凯氏定氮法,氨态氮含量采用甲醛滴定法[14]。
1.2.2 麦汁制备及发酵 将一定量的麦芽粉碎,以1∶4(g∶mL)的料水比进行糖化,过滤后105 ℃煮沸1.5 h并以3∶4∶3的比例分三次加入0.6‰的酒花,过滤得到麦汁。将麦汁与糖浆以不同的比例调制成不同FAN水平的超高浓麦汁,见表1,121 ℃灭菌15 min。使用1000 mL三角瓶,分别装入麦汁300 mL,用橡皮塞和装有去离子水的发酵栓封口。接种量为6.8 g(酵母泥)/L,于12 ℃下静置发酵,每天摇瓶1次。
1.2.3 发酵过程指标的测定
1.2.3.1 细胞干重(DCW) 准确量取25 mL发酵液,4 ℃条件下8000 r/min离心15 min,收集菌体,用生理盐水洗涤两次后,将菌体转移到干燥皿中,于105 ℃条件下烘干至恒重。
1.2.3.2 表观浓度 准确量取50 mL发酵液,4 ℃条件下8000 r/min离心15 min,收集上清液,用密度瓶法测定其浸出物含量。
表观发酵度(%)=(1-时刻表观浓度/原麦汁表观浓度)×100
式(2)
式(2)中,表观浓度的单位是°P,表示100 mL液体中含有浸出物的质量(g)。
1.2.3.3 乙醇浓度 准确量取发酵液50 mL,将其转移到蒸馏烧瓶中,并加入100 mL去离子水。连接好蒸馏装置,加热蒸馏直至收集到的溜出液体积为45 mL左右时,停止蒸馏。用去离子水将馏出液定容至50 mL,密度瓶法测定乙醇浓度。
1.2.3.4 FAN含量 茚三酮比色法[15]。
1.2.4 SPIH游离氨基酸组成 采用氨基酸分析仪A300测定,iControl and iPeak软件进行氨基酸分析。将SPIH稀释至适当倍数,加入 1 mL 15%磺基水杨酸到4 mL样品中,4 ℃静置1 h后离心(4 ℃,10000 r/min,15 min)。上清液再次离心后用锂离子稀释液稀释,然后过0.22 μm膜备用。氨基酸通过阳离子交换柱分离,柱后茚三酮衍生可见光于570 nm测定其吸光值(脯氨酸除外,于440 nm处),外标法定量。
1.2.5 SPIH分子量分布 采用高效液相色谱法。色谱条件:a.色谱柱:TSK gel 2000SXL凝胶柱,7.8 mm×300 mm,预柱:C18,柱温:30 ℃;b.流动相:100%磷酸盐缓冲液(pH7.2);流速:1.0 mL/min;进样量:20 μL;洗脱时间:20 min;c.检测波长:214 nm。
1.3 数据处理
实验中每个处理重复三次,应用Origin 8.0软件作图。

表2 大豆分离蛋白水解物中肽的分子量分布
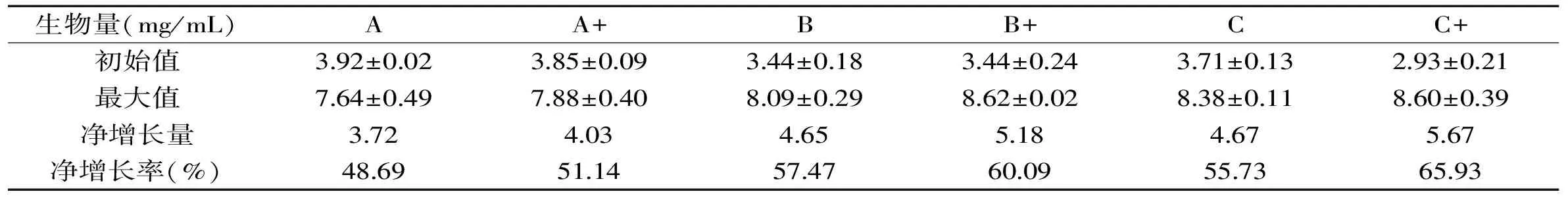
表4 六组不同麦汁对酿酒酵母增殖的影响
2 结果与分析
2.1 大豆分离蛋白水解物(SPIH)的组成
本文所述条件下制备的SPIH的水解度为9.86%,分子量分布如表2所示。由表2可知,SPIH分子量集中在3 kDa以下,占73.5%,主要是小分子肽类和氨基酸的混合物。由于酿酒酵母细胞能转运氨基酸与二肽、三肽等小分子肽,因此,SPIH可以为酵母提供可同化氮源,对酵母的生长具有促进作用。
SPIH中游离氨基酸的组成和含量如表3所示,Lei等[26]根据Lager酵母细胞对氨基酸的同化速率,可将SPIH中的游离氨基酸分成四类(表3)。由表3可知,SPIH含有丰富的一类和二类氨基酸,占游离氨基酸总量的62.3%,可供酵母细胞快速利用及抑制相应高级醇的产生。Lei等[16]发现赖氨酸和组氨酸的添加可显著促进酵母生长和风味物质的形成,提高麦汁发酵度和乙醇产量。此外,发酵培养基中氨基酸的存在还会影响酵母细胞对肽类物质的同化,其中亮氨酸能高效调节酵母对肽类的吸收[17],而一些氨基酸如精氨酸等则是酵母细胞优先利用的氮源,它们的存在则会抑制细胞对小分子肽的吸收[18]。

表3 大豆分离蛋白水解物的游离氨基酸组成
2.2 不同氮源组成麦汁对酿酒酵母增殖的影响
酿酒酵母在六种麦汁中的增殖情况如图1,其净增长量和净增长率见表4。由图1可知,A组酵母在前10 d迅速生长,其余组均在前12 d迅速生长,之后生物量逐渐下降。六组高浓麦汁中酵母的最大生物量为7.64~8.60 mg/mL,净增长率为48.69%~65.93%(表4)。向麦汁中补充适量的SPIH均能提高酵母的增殖量,其中A组加入SPIH后菌体增长量提高8.3%。这是由于SPIH含有丰富的一、二类氨基酸和小分子肽,在麦汁氮源水平较低时,增加了氮源的多样性,从而促进了酵母增殖,是酵母可以利用的有效外加氮源。以前的研究也表明大豆蛋白酶解物能为微生物生长代谢提供氮源,具有促进微生物生长繁殖和代谢的作用[19-20]。

图 1 六组不同麦汁对酿酒酵母增殖的影响Fig.1 Effects of different worts on the propagation of brewer’s yeast
2.3 不同氮源组成的麦汁对酿酒酵母发酵性能的影响
如图2所示,向麦汁中补充SPIH后,各组初始表观浓度均有提高。发酵前12 d,各组降糖迅速,生物量的增长促进了降糖,而后,由于麦汁中糖浓度的下降以及乙醇的积累,发酵变缓。通常当表观发酵度达到80%时,可认为啤酒发酵已经结束。如图3所示,第12 d时,B、B+、C、C+发酵结束,而A、A+于第15 d发酵结束。A+、B+相对于A、B来说,发酵度均有所提高,但C+组在发酵前期发酵度高于C组,发酵结束时发酵度却低于C组,这可能是由于发酵后期过高的乙醇浓度抑制酵母细胞繁殖的缘故。莫芬等[21]发现小麦面筋蛋白水解物在氮源匮乏条件下能够促进酵母的增殖,提高其活性,是酵母生长的有效氮源,在氮源充足条件下并不能被充分利用,也不能发挥促发酵效果。这说明,C组的初始氮源水平(即FAN=193.18 mg/L)并不是该酵母菌株的氮源匮乏水平,所以没有显著的促发酵效果。

图2 六种不同麦汁对酿酒酵母糖代谢的影响Fig.2 Effects of different worts on the sugar consumption of brewer’s yeast

图3 六种不同麦汁对发酵度的影响Fig.3 Effects of different worts on the apparent attenuation of brewer’s yeast
麦汁发酵过程中,乙醇是酵母代谢可发酵糖的重要产物。A、A+、B、B+、C、C+发酵结束时,终乙醇浓度为分别为8.8%、9.19%、8.545%、8.705%、8.96%、9.025%,添加了SPIH后均能得到更高的乙醇浓度,A、B、C三组终乙醇浓度分别提高了4.43%、1.87%、0.73%,其中A组乙醇浓度提高地更多。麦汁中SPIH的添加,在一定程度上增加了氮源的复杂性,其中小分子肽段参与改善胞内代谢,从而促进了酵母对糖的代谢能力,大分子肽段可吸附在细胞表面,提高酵母细胞的耐乙醇和耐渗透压能力,因而产生了更高的乙醇浓度。

表5 六组不同麦汁在发酵过程中酵母对FAN的利用情况
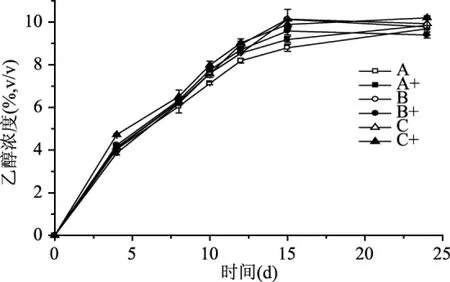
图4 六组不同麦汁对酿酒酵母乙醇生成的影响Fig.4 Effects of different worts on the ethanol yield of brewer’s yeast
2.4 酿酒酵母对不同氮源组成麦汁FAN的利用情况
FAN通常被认为是啤酒酿造中反映酵母可同化氮水平的一个重要指标[22]。酵母细胞在六组麦汁中FAN的利用情况如图5和表5所示。就麦汁A、B、C而言,在发酵过程中FAN的利用量随着初始FAN的增加而增加。同样,就补充了SPIH的麦汁A+、B+、C+而言,在发酵过程中FAN的利用量也随着初始FAN的增加而增加。酵母对空白对照组FAN的同化量要略大于相应的SPIH添加组,但其降糖、生物量及乙醇生成量等指标则低于相应的实验组。这可能是由于麦汁中的氮源已基本满足啤酒发酵中酵母细胞的增殖,同时酵母细胞在发酵过程中也会分泌少量胞外蛋白酶,这些蛋白酶可以将大分子的肽和蛋白质分解成小分子物质,为酵母细胞增殖提供了可同化氮源物质[23],而这部分小分子物质的量无法得知。此外,从表5也可以看出,初始FAN水平越低,利用率越高,这些可能与麦汁的组成有关,氮源的数量与多样性是影响发酵的重要因素。有研究表明,麦芽汁中含有近400种二肽和近8000种三肽[24]。在啤酒发酵过程中,酵母会转运麦汁中40%的寡肽。虽然添加了SPIH,但由于水解物中含有相对较多的大分子肽且并未进一步分离纯化,其中促发酵肽含量较低,所以其氮源组成不如成分复杂且含有大量小分子肽的麦汁,但其可作为麦汁氮源匮乏时的有效补充。
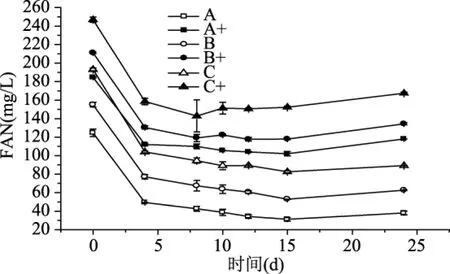
图5 六组不同麦汁对酿酒酵母利用FAN的影响Fig.5 Effects of different worts on the FAN utilization rate of brewer’s yeast
3 结论
啤酒发酵中,麦汁氮源组成对啤酒发酵具有显著影响。一般来说,随着麦汁中可同化氮源数量和氮源多样性的提高,酿酒酵母表现出更加优异的发酵性能。
将大豆分离蛋白水解物应用于啤酒超高浓发酵中,能够促进酵母的增殖和发酵,是酵母生长的有效氮源。
本研究实验菌株在20°P超高浓发酵时的氮源匮乏条件约为FAN=124.59 mg/L。
[1]赵文琪. 麦汁和啤酒中游离氨基氮的重要性[J]. 啤酒科技,2006,(3):60-62.
[2]Batistote M,Cruz S H D,Ernandes J R. Altered patterns of maltose and glucose fermentation by brewing and wine yeasts influenced by the complexity of nitrogen source[J]. Journal of the Institute of Brewing,2006,112(2):84-91.
[3]Piddocke M P,Fazio A,Vongsangnak W,et al. Revealing the beneficial effect of protease supplementation to high gravity beer fermentations using "-omics" techniques[J]. Microbial Cell Factories,2011,10:27(1):1-14.
[4]Boulton C,Quain D. Brewing yeast and fermentation[M]. Blackwell Science,2001:258-260.
[5]Dlamini B C. Yeast fermentation of sorghum worts:influence of nitrogen sources[D]. Pretoria:University of pretoria,2015.
[6]Arifeen N,Kookos I K,Wang R,et al. Development of novel wheat biorefining:Effect of gluten extraction from wheat on bioethanol production[J]. Biochemical Engineering Journal,2009,43(2):113-121.
[7]Sankh S N,Deshpande P S,Arvindekar A U. Improvement of ethanol production using Saccharomyces cerevisiae by enhancement of biomass and nutrient supplementation[J]. Applied Biochemistry & Biotechnology,2011,164(8):1237-1245.
[8]Junior M M,Batistote M,Ernandes J R. Glucose and fructose fermentation by wine yeasts in media containing structurally complex nitrogen sources[J]. Journal of the Institute of Brewing,2008,114(114):199-204.
[9]Cruz S H D,Cilli E M,Ernandes J R. Structural complexity of the nitrogen source and influence on yeast growth and fermentation[J]. Journal of the Institute of Brewing,2002,108(1):54-61.
[10]Junior M M,Batistote M,Cilli E M,et al. Sucrose fermentation by brazilian ethanol production yeasts in media containing structurally complex nitrogen sources[J]. Journal of the Institute of Brewing,2009,115(3):191-197.
[11]苗素平. 生物活性肽在食品加工中的应用[J]. 湖南城市学院学报(自然科学版),2015,(04):87-88.
[12]万春艳,赵谋明,赵海锋. 大豆蛋白水解物对酿酒酵母生长和发酵性能的影响[J]. 食品与发酵工业,2011,37(9):50-53.
[13]万春艳. 大豆活性肽对酵母增殖代谢及啤酒发酵的影响研究[D]. 广州:华南理工大学,2012.
[14]杨文博,张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品,2014,(3):88-90.
[15]张永国,秦锐兰. 麦汁中α-氨基氮含量的测定方法[J]. 啤酒科技,2008,(3):35-37.
[16]Lei H,Li H,Mo F,et al. Effects of Lys and His supplementations on the regulation of nitrogen metabolism in lager yeast[J]. Applied Microbiology & Biotechnology,2013,97(20):8913-8921.
[17]Ingledew W M,Patterson C A. Effect of nitrogen source and concentration on the uptake of peptides by a lager yeast in continuous culture[J]. Journal of the American Society of Brewing Chemists,1999,57(1):9-17.
[18]Island M D,Naider F,Becker J M. Regulation of dipeptide transport in Saccharomyces cerevisiae by micromolar amino acid concentrations[J]. Journal of Bacteriology,1987,169(5):2132-2136.
[19]陈美珍,廖灶辉,陈英歌,等. 大豆蛋白酶解物抗氧化及促进微生物生长研究[J]. 汕头大学学报:自然科学版,2007,22(3):43-48.
[20]单春乔,吴磊,刘秋晨,等. 大豆小肽促进益生菌增殖作用的研究[J]. 中国微生态学杂志,2012,(04):311-313,317.
[21]莫芬. 小麦面筋蛋白水解物对酵母增殖代谢及啤酒发酵的影响研究[D]. 广州:华南理工大学,2014.
[22]Stewart G G,Lekkas C,Hill A E. Wort FAN - Its characteristics and importance during fermentation[J]. Journal of the American Society of Brewing Chemists,2013,71(71):179-185.
[23]Maddox I S,Hough I S. Protedytic enzymes of saccharomyces carlsbergensis[J]. Biochemical Journal,1970,117(5):843.
[24]Calderbank J,Rose A H,Tubb R S. Pepitide removal from all-malt and adjunt worts by Saccharomyces cerevisiae ncyc 240[J]. Journal of the Institute of Brewing,1985,91(5):321-324.
Effect of worts with different nitrogen compositions on fermentation performance of brewer’s yeast
ZHOU Yong-jing1,LU Min1,YANG Hui-rong1,TU Jing-xia2,ZHAO Hai-feng1,*
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China; 2.Guangzhou Zhujiang Brewery Co.,Ltd,Guangzhou 510308,China)
Six kinds of very high gravity worts(20 °P)with different nitrogen compositions were used to examine their effects on the biomass accumulation,degree of fermentation,ethanol yield and FAN consumption of brewer’s yeast(FBY0095)in this study. Results showed that fermentation performance of yeast was strongly affected by both of the level and the composition of nitrogen during very high gravity fermentation(20 °P). With the increases of sugars consumption rates,biomass,ethanol yield and the decrease of fermentation time by 20% were observed with the increase of the amounts of nitrogenous compounds in wort. When the nitrogen source was insufficient(about FAN=124.59 mg/L),wort supplemented with appropriate soy protein isolate hydrolysates(SPIH)induced the increases of biomass and ethanol yield by 5.03% and 4.43%,respectively,and the diversity of nitrogen sourch was increased which indicated that SPIH was an effective nitrogen source for yeast growth with a more complex nitrogen composition.
brewer’s yeast;nitrogen source;very high gravity wort;fermentation performance;soy protein isolate hydrolysates(SPIH)
2016-11-11
周永婧(1995-),女,硕士研究生,研究方向:食品生物技术,E-mail:yongjingzhou@sina.cn。
*通讯作者:赵海锋(1977-),男,博士,副研究员,主要从事食品生物技术方面研究,E-mail:hfzhao@scut.edu.cn。
国家自然科学基金项目(31571821);广东省自然科学基金(2014A030313227);广东省科技计划项目(2016A010105003) 。
TS201.3
A
1002-0306(2017)09-0119-05
10.13386/j.issn1002-0306.2017.09.014
