非小细胞肺癌中BRAF V600、EGFR基因突变与临床病理特征的关系
2017-06-05韩义明沈金花邹先进
韩义明,饶 兰,丁 莉,郑 杰,杨 婉,沈金花,邹先进
非小细胞肺癌中BRAF V600、EGFR基因突变与临床病理特征的关系
韩义明1,饶 兰1,丁 莉1,郑 杰1,杨 婉1,沈金花2,邹先进1
目的 探讨非小细胞肺癌(non-small cell lung cancer, NSCLC)中BRAF V600、EGFR基因突变及其与临床病理特征的关系。方法 采用PCR-DNA测序法检测146例NSCLC标本中BRAF V600、EGFR基因突变情况,并分析基因突变与临床病理特征的关系。结果 BRAF V600基因突变率为7.5%(11/146),与患者吸烟史有关(P=0.045),而与患者性别、年龄、组织学类型及分化程度等无关(P>0.05)。EGFR基因突变率为46.6%(68/146),多见于女性、不吸烟、腺癌患者(P<0.05)。共检测出4例同时具有BRAF V600(3例V600E及1例V600D)及EGFR基因突变(19号外显子缺失2例,21号外显子L858R突变2例),两者未见相关性(P>0.05)。结论 NSCLC患者BRAF V600基因突变与患者性别、年龄、组织学类型及分化程度等无关,多见于无吸烟史患者。
肺肿瘤;BRAF V600;EGFR;突变
鼠类肉瘤滤过性毒菌致癌基因同源体B1(V-raf murine sarcoma viral oncogene homolog B, BRAF)作为一种原癌基因编码丝/苏氨酸特异性激酶,是RAS/RAF/MEK/ERK/MAPK通路重要的转导因子,参与调控细胞的生长、分化和凋亡等[1]。包括肺癌在内的多种人类恶性肿瘤,如恶性黑色素瘤、甲状腺癌、结直肠癌等,均存在不同比例的BRAF基因突变[2-3]。肺癌中BRAF基因突变率为0.8%~8%,其中V600E突变率超过50%[4-6]。Vemurafenib(PLX4032)等作为BRAF特异性抑制剂,已被FDA批准临床用于治疗具有BRAF V600E突变的恶性黑色素瘤患者[7],而且也在部分非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中应用[6,8-10]。BRAF基因是多种肿瘤的驱动基因,可能成为NSCLC患者治疗的新靶点。本文探讨NSCLC中BRAF V600、EGFR基因突变情况及其与临床病理特征的关系,并分析其相关性,为NSCLC的个体化靶向治疗提供更多临床依据。
1 材料与方法
1.1 材料 收集湖北省荆门市第一人民医院病理科2012年1月~2014年6月经手术切除的NSCLC石蜡标本146例,所有病例术前均未行放、化疗。其中男性96例,女性50例,年龄28~81岁(中位年龄60岁);有吸烟史82例,无吸烟史64例;肿瘤最大径1.1~7 cm(中位数为3 cm)。
1.2 DNA测序检测BRAF V600、EGFR基因突变 样本均经10%中性福尔马林固定,石蜡包埋。观察HE常规染色病理切片,避开出血、坏死区域,在肿瘤组织集中处的石蜡包埋块上,采用直径0.5 cm打孔器打出组织块,将其重新石蜡包埋。5 μm厚连续切片,共6片。采用QIAamp DNA FFPE Tissue Kit试剂盒(Qiagen公司,Germany)进行样本DNA提取。使用NanoDrop 1000 Spectrophotometer测定样本DNA纯度和浓度,样本DNA的OD260/280值1.8~2.0为有效。采用中山大学达安基因公司的BRAF V600、EGFR基因突变检测试剂盒(PCR测序法),通过PCR和毛细管电泳测序(ABI 3130XL)检测146例样本BRAF V600及EGFR基因18~21外显子突变情况。
1.3 统计学分析 应用SPSS 19.0软件进行统计学分析,采用χ2检验或确切概率法、Spearman等级相关分析BRAF V600、EGFR基因突变及其与NSCLC临床病理特征的关系。P<0.05为差异有统计学意义。
2 结果
2.1 组织学分型 标本均由两位高年资病理医师根据组织形态学和相关免疫组化标记结果重新复核诊断。鳞状细胞癌65例,高、中、低分化分别为24、19、22例。其中含有腺癌成分<1%样本4例,仍然分类为鳞状细胞癌;含有腺癌成分1%~10%时将其归类为鳞状细胞癌局部伴腺癌分化4例;腺鳞癌(腺癌或鳞状细胞癌每种成分均>10%)6例。肺腺癌72例。大细胞癌3例。
2.2 BRAF V600基因突变及与NSCLC临床病理特征的关系 本组146例NSCLC中共检测出BRAF V600基因突变11例(7.5%,11/146)。其中BRAF V600E突变8例(72.7%,8/11)(图1);BRAF V600D突变2例(18.2%,2/11)(图2);BRAF V600K突变1例(9.1%,1/11);BRAF基因突变主要集中在15号外显子的V600E(5.5%,8/146)。BRAF V600基因突变更多见于无吸烟史的NSCLC患者(P=0.045),而与患者性别、年龄、组织学分型、分化程度、肿瘤大小及淋巴结有无癌转移无相关性(表1)。
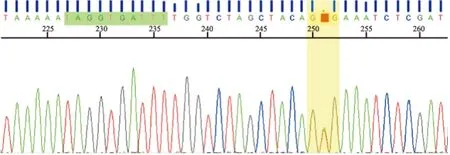
图1 BRAF V600E突变

图2 BRAF V600D突变
2.3 EGFR基因突变及与NSCLC临床病理特征的关系 本组146例NSCLC中共检测出EGFR基因突变68例(46.6%,68/146)。其中18号外显子突变3例(4.4%,3/68);19号外显子突变31例(45.6%,31/68);20号外显子突变5例(7.4%,5/68);21号外显子突变29例(42.6%,29/68)。EGFR基因突变主要集中在19号外显子缺失和21号外显子点突变(L858R)。多见于女性、不吸烟、腺癌患者(P<0.05,表2)。

表1 BRAF V600基因突变与非小细胞肺癌临床病理特征的关系[n(%)]

表2 EGFR基因突变与非小细胞肺癌临床病理特征的关系[n(%)]
2.4 BRAF V600基因突变与EGFR基因突变的关系 146例NSCLC中共检测出4例同时具有BRAF V600(3例V600E及1例V600D)及EGFR基因突变(19号外显子缺失2例,21号外显子L858R突变2例)。BRAF V600基因突变率在EGFR突变阳性组为5.9%,阴性组为9.0%,两组差异无统计学意义(表3)。

表3 BRAF V600突变与EGFR基因突变的关系[n(%)]
3 讨论
肺癌的发病率和病死率居恶性肿瘤之首,其中NSCLC占原发性肺癌的85%[11]。在肿瘤治疗进入基于分子标志物的“个体化”医学时代,NSCLC研究热点更多着重于对肿瘤携带的复杂基因突变进行系统的分子分型。在NSCLC中,EGFR是研究最多的靶标,EGFR基因突变是接受EGFR酪氨酸激酶抑制剂(EGFR-TKIs)治疗的患者有效且具有筛选性的预测性生物标志物[12]。
BRAF是一种癌基因,在EGFR信号通路中位于KRAS下游,编码MAPK通路中的丝氨酸-苏氨酸蛋白激酶。BRAF基因突变引起编码氨基酸的改变,导致编码蛋白持续被激活,细胞恶性增殖引起癌变[1]。BRAF基因是多种肿瘤的驱动基因,可能成为NSCLC患者治疗的新靶点,其在NSCLC中的意义越来越受到广大学者的关注。
本组146例NSCLC样本中检测出11例BRAF V600基因突变(7.5%),主要集中在15号外显子的V600E突变(72.7%,8/11)。这与文献报道肺癌中BRAF基因突变率为0.8%~8%,其中V600E突变率超过50%的结果[4-6]相一致;本组实验同时检测出EGFR基因突变68例(46.6%,68/146),多见于女性、不吸烟、腺癌患者(P<0.05),这与报道一致[13-14]。Kobayashi等[15]认为亚裔人群肺腺癌患者BRAF基因突变率低,为0.8%~1.1%。NSCLC患者的BRAF基因突变率偏低可能与种族差异性及在亚裔女性肺腺癌患者具有较高的EGFR基因突变率有关[13]。由于本组总例数相对较少,缺乏大样本多中心数据分析,因此BRAF V600基因突变是否与国人种族与地域性有关仍需进一步深入探讨。
BRAF基因突变率低,迄今为止与之相关的临床特征和预后意义尚未充分的认识。本组实验结果显示,BRAF V600基因突变与患者年龄、组织学类型及分化程度等无关(P>0.05)。BRAF V600基因突变更多见于无吸烟史的患者(P<0.05),这与Tissota等[6,16]的结果一致。本组实验结果同时显示BRAF V600基因突变与患者性别无相关性(P>0.05)。BRAF V600基因突变与患者性别的相关性,国内外报道观点不同。Tissota等[6]通过对2 690例肺癌患者进行BRAF等相关基因突变的研究认为,男性患者更易见于非BRAF V600基因突变,而在BRAF V600基因突变患者中男性较少见,但两者差异无统计学意义。Li等[17]研究了5 125例NSCLC的相关基因突变,其中BRAF基因突变率仅为0.5%,并认为仅与患者性别相关,BRAF V600突变多见于女性。
过去有研究认为BRAF、EGFR、KRAS突变是相互独立的事件[15-16,18]。而Kinno等[13]通过对2 001例NSCLC进行研究,同时检测到5例非V600E BRAF(4例G469A和1例G464E/G466R)突变与EGFR突变(4例L858R和1例缺失),但未检测到BRAF V600E突变伴随EGFR突变。近年来,多项研究认为具有BRAF基因突变的NSCLC患者对于EGFR-TKI药物出现耐药[13,19]。检测BRAF临床功效的回顾性分析[20]表明西妥昔单抗及帕尼单抗对BRAF基因突变的患者无效。这些也提示BRAF基因突变预示抗EGFR靶向治疗的耐药性。在本实验中共检测出4例同时具有BRAF V600(3例V600E及1例V600D)及EGFR基因突变(19号外显子缺失2例,21号外显子L858R突变2例)。提示这4例NSCLC患者对EGFR-TKI药物治疗效果可能不佳。实验仍需进一步观察分析寻找BRAF基因突变的临床意义。
检测NSCLC患者BRAF基因突变情况对于筛选BRAF基因突变药物及指导EGFR-TKI的靶向用药有重要意义。BRAF基因突变对NSCLC治疗预测及预后的机制与作用,仍需进一步深入探讨。
[1] Ji H, Wang Z, Perera S A,etal. Mutations in BRAF and KRAS converge on activation of the mitogen-activated protein kinase pathway in lung cancer mouse models[J]. Cancer Res, 2007,67(10):4933-4939.
[2] Elisei R, Ugolini C, Viola D,etal. BRAF(V600E) mutation and outcome of patients with papillary thyroid carcinoma: a 15-year median follow-up study[J]. J Clin Endocrinol Metab, 2008,93(10):3943-3949.
[3] Samowitz W, Sweeney C, Herrick J,etal. Poor survival associated with the BRAF V600E mutation in microsatellite-stable colon cancers[J]. Cancer Res, 2005,65(14):6063-6069.
[4] Yousem S A, Nikiforova M, Nikiforov Y. The histopathology of BRAF-V600E-mutated lung adenocarcinoma[J]. Am J Surg Pathol, 2008,32(9):1317-1321.
[5] Marchetti A, Felicioni L, Malatesta S,etal. Clinical features and outcome of patients with non-small-cell lung cancer harboring BRAF mutations[J]. J Clin Oncol, 2011,29(26):3574-3579.
[6] Tissot C, Couraud S, Tanguy R,etal. Clinical characteristics and outcome of patients with lung cancerharboring BRAF mutations[J]. Lung Cancer, 2016,91:23-28.
[7] Flaherty K T, Puzanov I, Kim K B,etal. Inhibition of mutated, activated BRAF in metastatic melanoma[J]. N Engl J Med, 2010,363(9):809-819.
[8] Gautschi O, Pauli C, Strobel K,etal. A patient with BRAF V600E lung adenocarcinoma responding to vemurafenib[J]. J Thorac Oncol, 2012,7(10):e23-e24.
[9] Peters S, Michielin O, Zimmermann S. Dramatic response induced by vemurafenib in a BRAF V600E-mutated lung adenocarcinoma[J]. J Clin Oncol, 2013,31(20):e341-344.
[10] Robinson S D, O’Shaughnessy J A, Cowey C L,etal. BRAF V600E-mutated lung adenocarcinoma with metastases to the brain responding to treatment with vemurafenib[J]. Lung Cancer, 2014,85(2):326-330.
[11] Herbst R S, Heymach J V, Lippman S M. Lung cancer[J]. N Engl J Med, 2008,359(13):1367-1380.
[12] Cagle P T, Chirieac L R. Advances in treatment of lung cancer with targeted therapy[J]. Arch Pathol Lab Med, 2012,136(5):504-509.
[13] Kinno T, Tsuta K, Shiraishi K,etal. Clinicopathological features of nonsmall cell lung carcinomas with BRAF mutations[J]. Ann Oncol, 2014,25(1):138-142.
[14] 韩义明, 郑 杰, 姜云惠, 等. 非小细胞肺癌中EGFR基因突变与ERCC1、Ki-67表达及临床病理特征的关系[J]. 临床与实验病理学杂志, 2015,31(7):759-763.
[15] Kobayashi M, Sonobe M, Takahashi T,etal. Clinical significance of BRAF gene mutations in patients with non-small cell lung cancer[J]. Anticancer Res, 2011,31(12):4619-4624.
[16] Litvak A M, Paik P K, Woo K M,etal. Clinical characteristics and course of 63 patients with BRAF mutant lung cancers[J]. J Thorac Oncol, 2014,9(11):1669-1674.
[17] Li S, Li L, Zhu Y,etal. Coexistence of EGFR with KRAS, or BRAF, or PIK3CA somatic mutations in lung cancer: a comprehensive mutation profiling from 5125 Chinese cohorts[J]. Br J Cancer, 2014,110(11):2812-2820.
[18] De Oliveira Duarte Achcar R, Nikiforova M N, Yousem S A. Micropapillary lung adenocarcinoma: EGFR, K-ras, and BRAF mutational profile[J]. Am J Clin Pathol, 2009,131(5):694-700.
[19] Ohashi K, Sequist L V, Arcila M E,etal. Lung cancers with acquired resistance to EGFR inhibitors occasionally harbor BRAF gene mutations but lack mutations in KRAS, NRAS, or MEK1[J]. Proc Natl Acad Sci USA, 2012,109(31): E2127- E2133.
[20] Di Nicolantonio F, Martini M, Molinari F,etal. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer[J]. J Clin Oncol, 2008,26(35):5705-5712.
Relationship between the status of BRAF V600 and EGFR gene mutation and clinicopathological features in patients with non-small cell lung cancer
HAN Yi-ming1, RAO Lan1, DING Li1, ZHENG Jie1, YANG Wan1, SHEN Jin-hua2, ZOU Xian-jin1
(1DepartmentofPathology,JingmenFirstPeople’sHospital,Jingmen448000,China;2DAANGeneCo.,Ltd.ofSunYat-senUniversity,Guangzhou510665,China)
Purpose To study the status of BRAF V600 and EGFR mutations in patients with non-small cell lung cancer (NSCLC) and to examine the relations between them. Methods BRAF V600 and EGFR mutations were detected with DNA sequencing. The relationship between BRAF V600, EGFR mutations and the clinicopathological features were analyzed. Results BRAF V600 mutations were detected in 11 (7.5%) of the 146 specimens. BRAF V600 mutations were found more1frequently in non-smokers (P=0.045). There were no significant differences in age, gender, histological subtype and differentiation between patients with and without BRAF V600 mutations (P>0.05). EGFR mutations were detected in 68 (46.6%) of the 146 specimens. EGFR mutations were found more frequently in women, non-smokers and adenocarcinoma (P<0.05). Four tumors with BRAF V600 mutations (three V600 and one V600D) showed concomitant EGFR mutations (two DEL and two L858R). Conclusion BRAF V600 mutations in patients with NSCLC are found more frequently in non-smokers. There are no significant differences in age, gender, histological subtype and differentiation between patients with and without BRAF mutations.
lung neoplasms; BRAF V600; EGFR; mutation
863重点项目计划资助(2011AA02A110)
1湖北省荆门市第一人民医院病理科,荆门 4480002中山大学达安基因股份有限公司,广州 510665
韩义明,女,硕士,主治医师。E-mail: 115812795@qq.com 邹先进,男,主任医师,通讯作者。E-mail: 502764519@qq.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.005.html
R 734.2
A
1001-7399(2017)04-0375-04
10.13315/j.cnki.cjcep.2017.04.005
接受日期:2017-02-22
