脑转移性管状囊性肾细胞癌1例并文献复习
2017-06-05姚丽青
杜 薇,姚丽青
脑转移性管状囊性肾细胞癌1例并文献复习
杜 薇1,姚丽青2
目的 探讨管状囊性肾细胞癌(tubulocystic renal cell carcinoma, TRCC)的临床病理特征、诊断与鉴别诊断。方法 对1例60岁男性患者额部转移性TRCC行HE及免疫组化EnVison两步法染色,光镜下观察组织形态学特征,并复习相关文献。结果 镜下可见肿瘤由纤细的纤维性间质分隔的大小不等的囊状和小管结构组成,囊腔内含嗜伊红蛋白,囊腔内衬覆扁平或柱状上皮细胞,部分呈“鞋钉样”突向腔内。细胞核圆形或卵圆形,空泡状,可见核仁,Fuhrman核3级,核分裂象不易见,胞质丰富,嗜酸性。免疫表型:肿瘤细胞vimentin、P504s、CK19、CKpan和EMA均呈弥漫强阳性,CD10和CK7均呈阴性,Ki-67增殖指数<5%。结论 TRCC十分罕见,好发于成年男性,大部分患者预后良好,复发和转移者罕见,转移性病灶依赖于病理学诊断,并为原发灶的查找提供重要线索和依据。
肾细胞肿瘤;转移性;诊断;病理;鉴别诊断
管状囊性肾细胞癌(tubulocystic renal cell carcinoma, TRCC)是一种罕见的预后良好的低度恶性肿瘤,是WHO(2016)肾脏肿瘤分类中的新增肾细胞癌亚型,肿瘤切除后复发和转移者较少,目前尚未见有关脑转移的报道[1]。TRCC好发于成年男性,左肾多见,临床常无明显体征,常于体检时偶然发现,最终诊断依赖于术后病理检查,但在临床医师未提供既往病史的情况下,对于转移性TRCC的诊断较为困难。本文现对1例中老年男性TRCC脑转移的术后病理标本的组织形态学特点、免疫表型进行探讨,并复习相关文献。
1 材料与方法
1.1 临床资料 患者男性,60岁,于2006年9月碰伤致额部出现一隆起性肿物,未行任何治疗,随后无明显诱因隆起性肿物迅速增大,2007年3月行CT检查示:额部近中线处占位性病变,倾向脑膜瘤,遂行额部肿瘤切除术。术后1年遵医嘱复查头颅CT示:额部占位性病变,考虑肿瘤术后复发可能,再次行额部肿瘤切除术,2009年4月发现左侧颞部肿瘤转移灶。追问病史,2005年5月患者曾于外院行右肾切除术,借取外院手术病理切片回顾分析。
1.2 方法 肿瘤组织经10%中性福尔马林固定,常规脱水,石蜡包埋,组织切片(4~6 μm厚),HE染色,光镜观察。免疫组化采用EnVision两步法,一抗包括vimentin、P504s、CK19、CKpan、EMA、CD10、CK7和Ki-67,均购自北京中杉金桥公司。中性树胶封固,DAB显色。
2 结果
2.1 眼观 肿瘤界限清楚,灰褐色,质中,切面呈多囊性,似海绵状,内含清亮液体,无出血和坏死区域(图1)。
2.2 镜检 肿瘤由大小不等的囊状结构和小管组成,囊腔内含嗜伊红蛋白,部分囊腔塌陷,囊状结构和小管间有纤细的间隔或纤维性间质分隔,囊腔内衬覆扁平或柱状上皮细胞,部分区域上皮细胞呈“鞋钉样”突向腔内(图2)。细胞核圆形或卵圆形,空泡状,可见核仁,Fuhrman核3级,但核分裂不易见,胞质丰富,嗜酸性,所有切片仅查见小灶透明细胞区域(图3)。肾脏肿瘤的镜下形态特点与其一致,呈多囊结构和小灶乳头状结构(图4、5)。另外,该患者1枚腹主动脉旁淋巴结见癌转移(图6)。
2.3 免疫表型 肿瘤细胞vimentin、CK19(图7)、P504s(图8)、CKpan和EMA均呈弥漫强阳性,CD10和CK7均呈阴性,Ki-67增殖指数<5%。免疫组化结果提示肿瘤向异常肾小管方向分化。
2.4 病理诊断 结合病史、组织病理学特点和免疫组化结果,本例患者最终确诊为脑转移性TRCC,TNM分期T4N0M1,stage Ⅳ。
3 讨论
3.1 组织学起源 目前,TRCC的组织学来源尚存在争议,以往认为TRCC来源于集合管,属于低度恶性的肾集合管癌[2],2009年Amin等[3]在美加病理年会(USCAP)上报道29例该形态肿瘤,肿瘤细胞大部分免疫组化表达近曲小管(P504s、CD10)和远曲小管(CK19),并命名为TRCC。在TRCC的部分病例中可见乳头状肾细胞癌(papillary renal cell carcinoma, PRCC)的结构,且与PRCC一样也出现染色体7和17的获得及Y染色体的缺失[4],因此推测两者关系密切或者说TRCC可能是PRCC的变异型。最近通过比较基因微点阵分析发现,TRCC独特的基因拷贝数资料显示其周期性的17号染色体获得,与肿瘤的进展有关[5],这与PRCC相似但又不完全相同。饶秋等[6]的研究表明,形态学不伴透明细胞和乳头状结构的TRCC未发现有染色体7和17的获得及Y染色体缺失。一个大样本量的基因表达谱及比较基因组杂交分析显示,TRCC的细胞遗传学谱与透明细胞癌、PRCC、嫌色细胞癌和集合管癌均不同[7]。因此,TRCC作为新增肾细胞癌亚型被列入WHO(2016)肾脏肿瘤分类中。

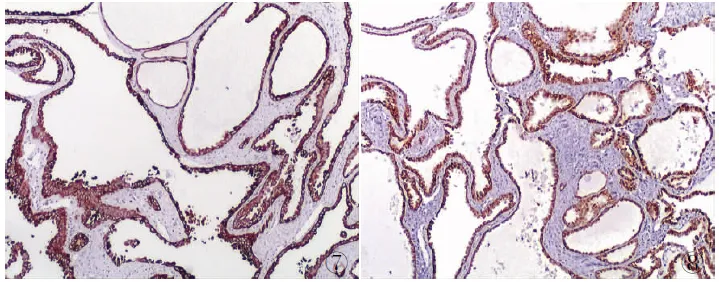
图1 肿瘤切面呈多囊性,似海绵状,内含清亮液体 图2 肿瘤呈囊状和小管样,部分呈“鞋钉样” 图3 小灶透明细胞区域 图4 肾脏肿瘤呈多囊结构 图5 小灶乳头状结构 图6 淋巴结中见癌转移 图7 肿瘤细胞弥漫表达CK19,EnVision两步法 图8 肿瘤细胞弥漫表达P504s,EnVision两步法
3.2 流行病学及临床特点 TRCC好发于成人,男性发病率明显高于女性,常见于左肾(约70%),临床常无明显体征或于体检时偶然发现。TRCC是一种十分少见的低度恶性肿瘤,罕见发生转移。Amin等[3]报道29例TRCC患者中17例随访6~104个月(平均56个月) ,发现仅1例发生骨转移,1例发生肝转移。Yang等[8]报道13例TRCC中仅1例出现盆腔淋巴结转移。迄今为止,尚未见TRCC发生脑转移的报道。本例为60岁男性患者,在发现肾脏肿瘤1年余即出现第一次额部转移,且无明显临床症状,提示TRCC属于惰性肿瘤,但具有转移潜能。
3.3 组织学特征 镜下肿瘤境界清楚,但无真性纤维性包膜,由大小不等的囊状和小管结构组成,其间有纤细的间隔或纤维性间质分隔,部分囊腔塌陷或囊性扩张,囊腔内含嗜伊红蛋白,部分内衬覆扁平或柱状上皮细胞,部分区域上皮细胞呈“鞋钉样”突向腔内。细胞核圆形或卵圆形,空泡状,可见核仁,Fuhrman核3级,但核分裂象不易见,胞质丰富,嗜酸性,无出血、坏死区域。本例患者的转移灶中无乳头状结构,仅见小灶性透明细胞区域,而原发灶中查见小灶乳头状结构。本例组织病理学形态十分特殊,在临床医师未提供既往病史的情况下,对于转移性的TRCC诊断困难。
3.4 鉴别诊断 TRCC具有独特的多房囊性结构,需与以下几种同样具有该结构的肾脏肿瘤进行鉴别[9]。(1)多房囊性肾细胞癌,囊内衬覆单层扁平或立方上皮细胞,常脱落至囊腔内或消失,细胞呈空泡状或淡染,类似肾透明细胞癌,Fuhrman核常为1级,且该肿瘤进展缓慢,目前尚未见复发和转移的报道。TRCC的肿瘤细胞常呈“鞋钉样”突向腔内,可见核仁,Fuhrman核分级更高。(2)囊性肾瘤,女性发病率明显高于男性,囊腔纤维间隔内可见类似卵巢间质的细胞和簇状分布的成熟肾小管结构,而TRCC男性高发,间质中无此类结构。(3)混合性上皮和间质肿瘤,女性多发,常有血尿、尿路感染等临床症状,肿瘤呈囊实性,由大囊、微囊和小管构成,微囊结构多样,间质为多少不等的梭形细胞,可呈黏液样或胶原化,偶见脂肪,梭形细胞常表达ER和PR,该肿瘤通过手术可治愈。TRCC常无明显临床体征,间质无明显梭形细胞,且不表达ER和PR。(4)Billini集合管癌,是一种高度恶性肿瘤,呈不规则小管状或乳头状,核异型性明显,核分裂象易见,纤维间质伴大量粒细胞浸润,免疫组化常表达CK(34βE12)和CK19,CD10和P504s常阴性。TRCC由单一囊状或小管样结构组成,核无异型,核分裂不易见,免疫组化常表达CK19、CD10和P504s,不表达CK(34βE12)。
3.5 治疗与预后 TRCC被认为是一种低度恶性肿瘤,大部分患者预后较好。本例患者在病理确诊为TRCC脑转移后,曾行头部局部放射治疗1个疗程、DC-CIK生物免疫治疗2个疗程及吉西他滨(泽菲)化疗2个周期,治疗过程中患者偶感左下肢疼痛,影响行走,疗效不详。患者2009年6月出院,随访45个月后死亡,目前鲜有文献对不同临床分期TRCC的生存期及预后的报道。MacLennan等[10]对8例TRCC随访12~104个月,发现1例患者术后46个月肿瘤复发、死亡。已报道的TRCC转移病例中均发现透明细胞区域或PRCC区域[3],本例原发灶中查见乳头状结构区域,而转移灶中查见透明细胞区域,与患者早期复发和转移是否有关,尚需积累更多病例进一步分析。
(本文承蒙南京军区福州总医院病理科和福建医科大学附属协和医院病理科提供相关切片,特此致谢!)
[1] Azoulay S, Vieillefond A, Paraf F,etal. Tubulocystic carcinoma of the kidney: a new entity among renal tumors[J]. Virchows Arch, 2007,451(5):905-909.
[2] Hennigar R, Epstein J I, Farrow G M. Tubular renal cell carcinomas of collecting duct origin[J]. Mod Pathol, 1994,7(1):76.
[3] Amin M B, MacLennan G T, Gupta R,etal. Tubulocystic cacinoma of the kidney: clinicopathologic analysis of 31 cases of a distinctive rare subtype of renal cell carcinoma[J]. Am J Surg Pathol, 2009,33(3):384-392.
[4] Kovacs G, Fuzesi L, Emanual A,etal. Cytohenetics of papillary renal tumors[J]. Genes Chromosomes Cancer, 1991,3(4):49-55.
[5] Quiroga-Garza G, Pia-Oviedo S, Cuevas-Ocampo K,etal. Synchronous clear cell renal cell carcinoma and tubulocystic carcinoma: genetic evidence of independent ontogenesis and implications of chromosomal imbalances in tumor progression[J]. Diagn Pathol, 2012,27(7):21.
[6] 饶 秋,夏秋媛,周晓军,等. 2016版WHO肾脏肿瘤新分类解读[J]. 中华病理学杂志, 2016,45(7):435-441.
[7] Tran T, Jones C L, Williamson S R,etal. Tubulocystic renal cell carcionma is an entity that isimmunonohistochemically and genetically distinct from papillary renal cellcarcinoma[J]. Histopathology, 2016,68(6):850-857.
[8] Yang X J, Zhou M, Hes O,etal. Tubulocystic carcinoma of the kidney: clinicopathologic and molecular characterization[J]. Am J Surg Pathol, 2008,32(2):177-187.
[9] 张 伟,韩 芳,李玉军,等. 肾管状囊性癌的临床病理观察[J]. 临床与实验病理学杂志, 2012,28(1):81-83.
[10] MacLennan G T, Farrow G M, Bostwick D G. Low-grade collecting duct carcinoma of the kidney: report of 13 cases of low-grade mucinous tubulocystic renal carcinoma of possible collecting duct origin[J]. Urology, 1997,50(5):679-684.
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.025.html
1福建中医药大学附属人民医院病理科,福州 3500042南京军区福州总医院病理科,福州 350000
杜 薇,女,硕士研究生,主治医师。E-mail:villa1218@163.com 姚丽青,女,硕士,副主任医师,通讯作者。E-mail:119025625@qq.com
R 737.11
B
1001-7399(2017)03-0330-03
10.13315/j.cnki.cjcep.2017.03.025
接受日期:2017-01-16
