环境分子诊断技术在污染场地环境管理中的应用进展
2017-06-05刘伟江
文 一,张 涛,刘伟江,康 阳,陈 坚
环境保护部环境规划院,北京 100012
环境分子诊断技术在污染场地环境管理中的应用进展
文 一,张 涛,刘伟江,康 阳,陈 坚
环境保护部环境规划院,北京 100012
环境分子诊断技术(EMDSs)是有机单体同位素分析和各种分子生物学技术的总称,将其应用于污染场地特征识别、修复方案可行性评估、监测和修复终止等污染场地环境管理过程中,探明土壤和地下水中污染物生物和非生物降解过程、降解速率及机制,确定不同污染来源,可弥补传统污染场地环境管理方法的不足,具有广阔的发展前景。文章综述了污染场地环境管理过程及传统方法的不足,介绍了有机单体同位素分析和各种分子生物学技术的基本原理和用途,并对各种技术的特点进行阐述和对比;介绍了EMDSs在污染场地环境管理中的实际应用,提出了EMDSs的发展趋势。
污染场地; 环境分子诊断;有机单体同位素分析;分子生物学技术
环境分子诊断技术(EMDSs)是利用新兴的同位素技术和分子生物学技术,分析土壤和地下水等环境样本的生物和化学特征,用于污染场地特征识别、修复方案可行性评估、效果监测和修复结案等污染场地环境管理过程[1]。
按照诊断原理,环境分子诊断技术主要分为2类:基于同位素的有机单体同位素分析(CSIA)和基于DNA、RNA等的分子生物学技术(MBTs)。这些方法已经在医药、国防和工业领域广泛应用,由于传统的场地环境管理方法(如水文地质调查、化学和地球化学分析等)仅能提供污染物自然衰减是否发生或者主动污染修复的反应速率高低等间接证据,难以快速和全面支撑污染场地环境管理决策,而环境分子诊断技术通过分析涉及污染物转化过程中的同位素、微生物、基因或者酶等微观证据,可以提供更多有效和直接的数据,用以完善传统管理方法的不足[2-3]。近10年来,国内外逐渐将环境分子诊断技术应用在污染场地环境管理中,据美国环保局(USEPA)统计,2009—2012年已有数百个环境修复场地在场地污染调查、监测和修复等过程中使用了环境分子诊断技术[4]。中国台湾地区将环境分子诊断技术应用在油品类污染场地调查中,在加油站油品泄漏场地中,通过碳同位素分析、特定生物指标化合物分析,判断油品污染的油源的差异,确定受污染的时间[5]。
在我国,环境分子诊断技术的应用和研究还处于起步阶段,主要利用CSIA和MBTs对污染物的迁移转化机制进行探索性研究,在实际污染场地环境管理中应用较少[6-8]。本文综述了环境分子诊断技术的种类、适用性及在污染场地环境管理中运用,并提出了下一步研究的方向。
1 污染场地环境管理过程
国内外的污染场地环境管理指南或规范中,一般将污染场地环境管理分为4个阶段:污染场地特征识别、污染修复、监测和修复终止[9]。污染场地特征识别的作用是确定污染类型、刻画污染程度和空间分布、建立场地概念模型,为开展风险评估和实施地下水修复方案提供信息。污染修复包括修复方案选择、修复工程设计、可行性评估和修复工程实施等过程。污染环境场地管理中的监测,包括监测修复技术可行性评估中的修复效果、修复工程实施过程中污染物和副产物的浓度和溶质通量变化趋势等,以评价修复的实际效果。污染修复终止是指当实施修复工程后,场地的土壤、水和土壤气等环境介质中污染物的浓度不会对人群及环境产生危害时,停止污染场地修复行动。
传统的污染场地环境管理是通过对土壤和地下水等环境样品的采样分析,获得污染物和副产物的浓度和溶质通量的变化趋势,为环境管理各阶段提供决策信息。土壤和地下水环境样品的传统分析方法存在局限性,例如,传统的污染物分析利用气相色谱或者气质联用定量污染物的含量,仅能提供少量的污染物信息,且无法提供污染物的同位素信息,而污染物的同位素变化是表征污染来源、降解速率和降解机制的可靠指标;在生物分析上,传统方法是利用异养菌平板计数法或者最大近似数分析法估计微生物的数量和生物降解的可能性,然而近99%的微生物不能在实验室接种培养,基于平板培养的方法并不能充分评估参与污染物生物降解的微生物菌落的规模和组成[10]。因此,传统的方法无法精确判断目标污染物发生的生物和非生物过程的降解机理、降解速率和降解效果,也不能有效区分污染物来源[11],难以快速和准确地为污染特征识别、污染修复效果确定和修复技术调整等提供数据支持。
采用环境分子诊断技术作为污染场地环境管理过程中传统方法的补充,可以从多种疑似污染来源中准确判断污染来源[12-13],可以提高对污染场地环境中微生物群落及其降解污染物能力的了解[13],掌握降解污染物的非生物过程及机制[14],提供详细的生物和非生物降解发生和反应速率等信息[15],确定监测自然衰减或者主动修复策略,估计满足修复目标达到的时间,为污染场地环境管理各阶段提供有效和更直接的数据支撑。环境分子诊断技术在污染场地环境管理的各阶段的应用见图1。
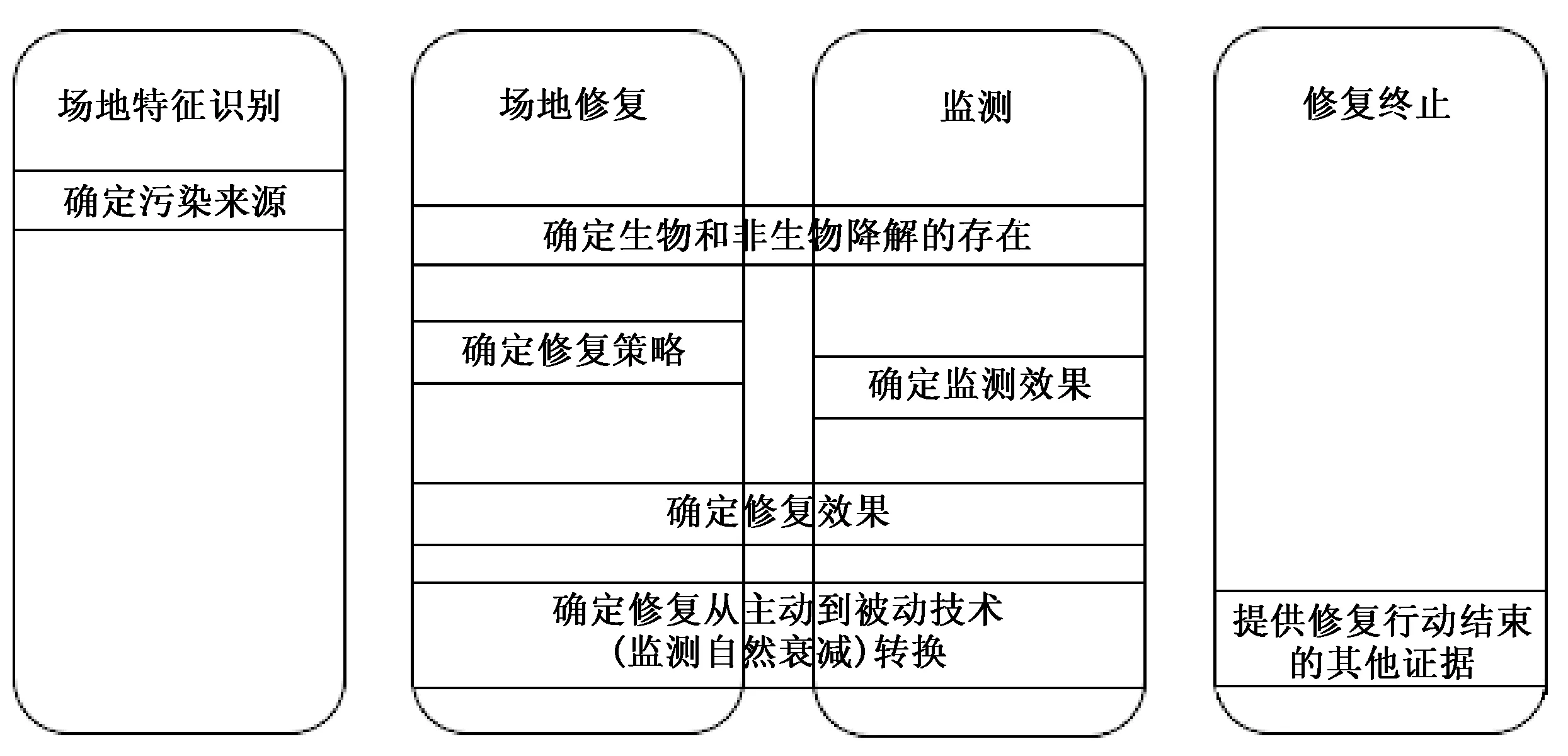
图1 环境分子诊断技术在污染场地环境管理各阶段中的应用Fig.1 Potential uses of EMDs in site management
2 环境分子诊断技术的介绍
环境分子诊断技术的类别见图2。
2.1 有机单体同位素分析技术
有机污染物在发生化学或生物化学反应等过程中,由于动力学同位素效应导致残留物中重同位素富集,产物中重同位素贫化[16],可利用同位素质谱分析仪或者同位素质谱仪与气相或液相色谱联用等方法测定残留物中特定元素重同位素的富集值(或产物中重同位素贫化),以判断目标污染物是否发生转化[17]。目前,在单体碳同位素中应用较多的元素为氢(2H/1H)、碳(13C/12C)、氮(15N/14N)、氧(18O/16O和17O/16O)和氯(37Cl/35Cl)[18]。
在污染场地环境管理中,有机单体同位素分析技术可应用于监测和量化污染物的降解过程和确定环境污染物的来源。在许多非生物和生物反应过程中,由于元素的重同位素键强度高于轻同位素,因此轻同位素会优先从反应物中转移到产物中(正常的同位素分馏),而重同位素则会在残留反应物中富集,可以通过这个过程来判断污染物是否发生降解。以13C/12C为例,当发生降解反应时,底物中13C发生富集,其富集程度的大小与降解程度有关。HUNKELER等[19]研究苯的微生物降解时,发现底物中13C发生显著的富集,其中δ13C值为+3.4‰(f<0.1)。在特定的环境领域下,化合物的同位素组成保持不变,可直接利用其同位素组成进行来源示踪,确定污染物的来源。CSIA已经被广泛应用于评价石油烃的原始来源,包括判别不同地区的原油以及通过这些原油生产的汽油[20]。SHOUAKAR等[21]通过H同位素组成,区分环境中的三氯乙烯是来自于工业三氯乙烯还是通过还原脱氯作用由四氯乙烯降解生成,工业生产的三氯乙烯中的δ2H的值为100‰或更高,高于通过四氯乙烯还原脱氯产生的三氯乙烯中的δ2H的值。由于地下水中δ2H的值为0‰或者更低,若监测到TCE中δ2H的值超过100‰,那么三氯乙烯的来源为工业生产。
2.2 分子生物学技术
通常情况下,特定的污染物在特定的微生物作用下,发生生物转化,基于分子生物技术的环境分子诊断技术,可检测和定量作用特定污染物的微生物,识别产生降解作用的未知微生物,确定微生物降解特定污染物的能力,基于上述能力,可以用来确定污染物的降解机理和降解效率,为污染场地环境管理提供数据支持。目前,运用在污染场地环境管理的分子生物学技术包括定量聚合酶链式反应(qPCR)、微生物指纹图谱、DNA微探针阵列、稳定同位素探针(SIP)、酶活性探针(EAPs)和荧光原位杂交(FISH)[4],各种技术的原理和用途见表1。
2.3 环境分子诊断技术的适用性
环境分子诊断技术中包含了多种技术,可以提供不同或相似的环境场地管理信息,在实际使用中,需要根据不同技术的优缺点、费用和技术成熟度(见表2),选择合适的技术在实际污染场地环境管理中运用,如CSIA除了提供监测和量化污染物的降解过程外,还能确定环境污染物的来源,分子生物学技术主要用于提供污染物降解过程中功能微生物的种类、数量和活性等信息。在分子生物学技术中,有些技术可以提供相同的信息,如qPCR、FISH等都能提供微生物基因序列信息。环境分子诊断技术的测试费用为225~5 000美元,技术成熟度也有商业可利用或者还处于实验室研究阶段之分[1,4]。

表1 基于分子生物的环境分子诊断技术

表2 环境分子诊断技术的适用性
2.4 在污染场地环境管理中的应用
环境分子诊断技术已经应用于多环芳烃、石油烃、氯代烃、农药残留物等有机污染场地的场地特征识别、修复可行性评估以及修复效果的判定[30]。表3概括了近年来CSIA在污染场地环境管理中实际应用案例,从实际应用可以看出,CSIA在氯代烃污染场地的应用最为广泛,并且涉及了污染场地环境管理的各个阶段。以新泽西州受三氯乙烯污染地下水的航空基地的场地特征识别为例,前期的地下水采样分析结果表明,该场地存在2个明显的地下水氯代烃高值区,但不能确认是否存在2个污染源。利用CSIA技术分析地下水中δ13C,结果发现,高值区中的δ13C分别为-38.83‰和-32.44‰,存在明显差异,表明存在2个明显的污染源[4]。
3 结语
目前,随着我国工业化进程的发展与扩大,在华北平原、长三角和珠三角等地下水使用量大或者经济发达的地区出现了大量的土壤与地下水污染场地,寻求有效的方法,开展快速、准确和有效的环境管理迫在眉睫。从国外研究成果与实际应用来看,环境分子诊断技术在污染场地特征识别、污染修复、监测和修复终止等污染场地环境管理中发挥了重要的作用,从污染溯源、确定生物和非生物降解作用、效果和机制方面提供更多有效和直接的数据,可完善传统环境管理方法的不足,提高环境管理决策的效率和准确度,因此,将环境分子诊断技术运用到我国污染场地环境管理中是一个重要的发展方向。我国在应用环境分子诊断技术方面具备了良好的基础,同位素分析技术和分子生物学技术已经广泛应用于我国医药、工业领域,具备完备的技术和硬件条件,并实现了商业利用,将其利用到污染场地环境管理中具有较高的经济和技术可行性。下一步需要研究不同污染物在污染场地环境介质中迁移转化过程中同位素的反应类型和分馏机理,不同污染物的降解过程与微生物的DNA、代谢蛋白质等的相互关系,使技术能应用到实际污染场地环境管理中。

表3 环境分子诊断技术的实际应用案例
环境分子诊断技术也存在一定的局限性,CSIA目前仅能分析整个污染物中的同位素组成,而不能定位污染物中特定位置的原子;另外,CSIA技术主要用于有机污染物的场地环境管理中,在重金属污染物的场地环境管理中应用较少,今后可加强它们的研究,拓宽CSIA技术的适用范围,进一步确定有机和重金属环境污染物的迁移转化机制,为污染场地环境管理提供更多的数据支撑。在分子生物学技术上,随着高通量生物学技术的发展,将宏基因组学、环境转录组学、代谢组学、蛋白质组学和高通量测序等新手段应用于污染场地环境管理中是新的发展方向,这些技术能分析环境中全部的微生物群落的结构和功能,可以迅速分析多种环境样品,提供更全面和快速的环境微生物群落生物降解过程的信息。
[1] ITRC. Environmental molecular diagnostics fact sheets[R]. USA: ITRC, 2011.
[2] COURBET C A,RIVIRE S, JEANNOTTAT S, et al.Complementing approaches to demonstrate chlorinated solvent biodegradation in a complex pollution plume: Mass balance, PCR and compound-specific stable isotope analysis[J]. J Contam Hydrol, 2011,126:315-329.
[3] WATANABE K, HAMAMURA N. Molecular and physiological approaches to understanding the ecology of pollutant degradation[J].Curr Opin Biotech, 2003,14: 289-295.
[4] ITRCEMDT. Environmental molecular diagnostics [R]. USA: ITRC, 2013.
[5] 彭学伟,韩立坤,孙健,等. 二维单体同位素分析在有机污染物转化研究中的运用进展[J].环境污染与防治,2014,36(6):74-79.
PENG Xuewei, HAN Likun, SUN Jian, et al. Advances of application of two-dimensional compound-specific isotope analysis in the research of organic pollutants transformation[J]. Environmental Pollution & Control,2014,36(6):74-79.
[6] 彭先芝,刘向,叶兆贤,等. 化学与稳定同位素指纹示踪原油类污染:以广东南海两次小型溢油事件为例[J].地球化学,2004,33(3):317-320.
PENG Xianzhi, LIU Xiang, YE Zhaoxian, et al.Applications of chemical and stable isotopic fingerprints for oil contamination identification: Case studies of two heavy oil spills in Nanhai, Guangdong Province,China[J]. Geochimica, 2004,33(3):317-320.
[7] 王晓红,魏加华,成志雄,等.地下水有机污染源识别技术体系研究与示范[J]. 环境科学,2013,34(2):661-668.
WANG Xiaohong, WEI Jiahua, CHENG Zhixiong, et al. Groundwater organic pollution source identification technology system research and application[J]. Environmental Science, 2013,34(2):661-668.
[8] 靳利蕊,张晓君,李辉,等. 三氯乙烷污染地地下水中Dehalobacter属细菌定量与多样性分析[J].微生物学通报,2013,40(8):1 522-1 530.
JIN Lirui, ZHANG Xiaojun, LI Hui, et al.Diversity of 1,1,1-trichloroethane degrading Dehalobacterspp. in contaminated groundwater[J]. Microbiology China, 2013,40(8):1 522-1 530.
[9] 龚宇阳. 污染场地管理与修复[M].北京: 中国环境出版社,2012:66-68.
GONG Yuyang. Polluted sites management and remediation[M].BeiJing: China Environment Science Press, 2012:66-68.
[10] 宋孟珂,江龙飞,王琰,等.稳定同位素探针技术在有机污染物生物降解中的应用[J].微生物通报,2014,41(4):699-711.
SONG Mengke, JIANG Longfei, WANG Yan,et al. Application of stable isotope probing in biodegradation of organic pollutants[J].Microbiology China, 2014,41(4):699-711.
[11] 张琳,桂建业,陈立. 单体同位素判识地下水MTBE衰减的研究进展[J]. 环境科学与技术,2012,35(6):84-88.
ZHANG Lin, GUI Jianye, CHEN Li. Application of compound specific isotope analysis to assessing MTBE biodegradation in contaminated groundwater[J]. Environmental Science & Technology, 2012,35(6):84-88.
[12] STURCHIO N C, HOAGLUND J R, MARROQUIN R J, et al.Isotopic mapping of groundwater perchlorate plumes[J]. Ground Water, 2012,50(1):94-102.
[13] Blessing M. Delineation of multiple Chlorinated ethene sources in an industrialized area—a forensic field study using compound specific isotope analysis[J].Environ Sci Technol,2009,43(8):2 701-2 707.
[14] THOMAS B,HOFSTETTE R, Michael B.Assessing transformation processes of organic contaminants by compound-specific stable isotope analysis.Trends in Analytical Chemistry[J]. 2011,30(4):618-626.
[15] SKARPELI-LIATI M, JISKRA M, TURGEON A,et al. Using nitrogen isotope fractionation to assess the oxidation of substituted anilines by manganese oxide[J]. Environ Sci Technol, 2011, 45(13):5 596-5 604.
[16] SIM M S, BOSAK T, ONO S et al. Large sulfur isotope fractionation does not require disproportionation[J]. Science, 2011, 333(6 038): 74-77.
[17] SESSIONS A L. Isotope ratio detection for gas chromatography[J].J Sep Sci, 2006, 29:1 946-1 961.
[18] 李先国,彭学伟,张庆红.单体同位素分析在有机污染物研究中的应用进展[J].中国海洋大学学报,2009,39(6):1 251-1 256.
LI Xianguo, PENG Xuewei, ZHANG Qinghong. Application of compound-specific isotope analysis in organic pollutants research[J]. Periodical of Ocean University of China, 2009,39(6):1 251-1 256.
[19] HUNKELER D, ANDERSEN N, ARAVENA R, et al. Hydrogen and carbon isotope fractionation during aerobic biodegradation of benzene[J]. Environ Sci Technol, 2001, 35: 3 462-3 467.
[20] PHILIP P. The emergence of stable isotopes in environmental and forensic geochemistry studies: a review[J]. Environ Chem Lett, 2007,5:57-66.
[21] SHOUAKAR-STASH O, FRAPE S K, DRIMMIE R J. Stable hydrogen, carbon and chlorine isotope measurements of selected chlorinated organic solvents[J]. J Contam Hydrol 2003,60:211-228.
[22] 付小花,李艳丽.DGGE和qPCR联用定量分析环境样品中优势菌群[J]. 实验技术与管理,2012,29(9):45-49.
FU Xiaohua, LI Yanli. Quantitative analysis of dominant bacteria in environmental samples based on DGGE plus quantitative PCR techniques[J]. Experimental Technology and Management, 2012,29(9):45-49.
[23] BALDWIN B R, BIERNACKI A, BLAIR J, et al.Monitoring gene expression to evaluate oxygen infusion at a gasoline-contaminated site[J]. Environ Sci Technol,2010,44 (17): 6 829-6 834.
[24] FISCHER J, SCHAUER F, HEIPIEPER H J. The trans/cis ratio of unsaturated fatty acids is not applicable as biomarker for environmental stress in case of long-term contaminated habitats[J]. Appl Environ Microb 2010, 87:365-371.
[25] FROSTEGÅRD A, TUNLID A, BAATH E. The use and misuse of PLFA measurements insoils[J].Soil Biology & Biochemistry, 2011,43:1 621-1 625.
[26] 杨悦锁,雷玉德,杜新强,等. 当地下水邂逅DNA:石油类有机污染及其生物降解[J].吉林大学学报:地球科学版,2012,42(5):1 435-1 447.
YANG Yuesuo, LEI Yude, DU Xinqiang, et al. When groundwater meets DNA: petroleum hydrocarbon stress vs biodegradation. Journal of Jilin university:earth sciecnce edition, 2012,42(5):1 435-1 447.
[27] COOPER M, LA Duc,PROBST M T, et al. Comparison of innovative molecularapproaches and standard spore assays for assessment of surface cleanliness[J]. Applied and Environmental Microbiology,2011,77: 5 438-5 444.
[28] WYMORE R A, LEE M H, MILLER A R,et al. Field Evidence for Intrinsic aerobic chlorinated ethene cometabolism by methanotrophs expressing sMMO[J]. Bioremediation Journal,2007,11(3):125-139.
[29] 何世斌,柴连琴,谭珺隽,等. 荧光原位杂交技术的研究进展[J].植物科学学报,2014,32(2): 199-204.
HE Shibin, CAI Lianqin, TAN Junjuan, et al. Recent advances in fluorescence in situ hybridization [J].Plant Science Journal, 2014,32(2): 199-204.
[30] HOFSTETTER T B, BERG M. Assessing transformation processes of organic contaminants by compound-specific stable isotope analysis[J]. TrAC Trends Anal Chem,2011, 30(4):618-627.
Application of Environmental Molecular Diagnostics in Environmental Management of Contaminated Site
WEN Yi, ZHANG Tao, LIU Weijiang, KANG Yang, CHEN Jian
Chinese Academy for Environmental Planning, Beijing 100012, China
Environmental molecular diagnostics (EMDSs) is a series of techniques by combining chemical techniques, specifically compound specific isotope analysis (CSIA), and a variety of molecular biological techniques (MBTs), which have application in each phase of environmental site management, including site characterization identification, feasibility evaluation of remediation plan, monitoring and closure activities. EMDSs can complement these data for conventional management by providing direct measurements of the abiotic and biotic degradation process and relative rates of various degradation processes. In addition, EMDSs can be used to identify the source of contamination when several sources are suspected. The application of EMDSs has a bright prospect in environmental site management. The paper reviews the environmental management process for contaminated site and limitation of conventional methods, introduces the fundamental principal and application of EMDSs, the characteristic and the application of EMDSs, and practical application in environmental site management. Future prospect of EMDSs is also presented.
contaminated site; environmental molecular diagnostics; specifically compound specific isotope analysis; molecular biological techniques
2016-01-26;
2016-05-23
全国地下水基础环境状况调查评估项目(20110302)
文 一(1980-),女,四川资阳人,博士,副研究员。
陈 坚
X830.5
A
1002-6002(2017)01- 0029- 07
10.19316/j.issn.1002-6002.2017.01.05
