中国葡萄主要品种对葡萄座腔菌的抗性评价
2017-06-05姚晟伟张国军李兴红徐海英
张 玮, 姚晟伟, 张国军, 谢 悦, 李兴红*, 徐海英*
(1. 北京市农林科学院植物保护环境保护研究所, 北京 100097; 2. 北京市农林科学院林业果树研究所, 北京 100093)
中国葡萄主要品种对葡萄座腔菌的抗性评价
张 玮1, 姚晟伟1, 张国军2, 谢 悦1, 李兴红1*, 徐海英2*
(1. 北京市农林科学院植物保护环境保护研究所, 北京 100097; 2. 北京市农林科学院林业果树研究所, 北京 100093)
采用离体有伤接种绿枝条的方法分析了我国25个葡萄主要品种对葡萄座腔菌Botryosphaeriadothidea的抗/感程度并建立了抗性分级标准。根据接种发病后的病斑长度,利用系统聚类方法鉴定不同葡萄品种对葡萄座腔菌的抗性并进行分级,建立了葡萄对葡萄座腔菌的抗性评价方法和抗性分级标准。结果表明,我国25个主要葡萄品种对葡萄座腔菌的抗性存在明显差异,‘巨峰’、‘红宝石无核’、‘藤稔’、‘红地球’、‘香妃’、‘玫瑰香’、‘巨玫瑰’、‘霞多丽’、‘龙眼’、‘西拉’、‘品丽珠’、‘贝达’、‘峰后’、‘梅鹿辄’、‘美人指’、‘赤霞珠’和‘山葡萄洛桑’等17个品种对葡萄座腔菌表现为抗病,‘弗蕾无核’、‘5BB’、‘夏黑’和‘无核白鸡心’表现为感病,而‘维多利亚’、‘牛奶’、‘矢富罗莎’和‘摩尔多瓦’表现为高感。
葡萄; 葡萄溃疡病; 抗性评价
葡萄是我国重要的经济果树,据农业部统计资料显示,截至2013年底,我国葡萄栽培面积和产量分别为68万hm2和1 150万t(2014年度葡萄产业技术发展报告,内部资料)。近年来,葡萄座腔菌科Botryosphaeriaceae真菌引起的葡萄溃疡病已成为限制葡萄园可持续发展的重要因素[1-5]。抗病品种的选育和利用是控制植物病害的有效措施,因此,评价我国主栽葡萄品种对我国葡萄溃疡病优势种群的抗性水平,为选育和利用抗病品种提供依据和技术支持,对我国葡萄产业安全健康发展意义重大。
葡萄溃疡病为重要的葡萄枝干病害,存在于几乎所有种植葡萄的国家,包括美国、匈牙利、法国、意大利、葡萄牙、西班牙、南非、智利、澳大利亚、黎巴嫩、中国、埃及等[6-11],并在一些国家造成了极为严重的损失,美国加州每年因葡萄枝干病害引起的损失已超过2.6亿美元[6]。2010年李兴红等首次在中国发现由葡萄座腔菌Botryosphaeriadothidea引起的葡萄溃疡病[12]。截至目前,我国报道的引起葡萄溃疡病的葡萄座腔菌科真菌有6个种:B.dothidea,Diplodiaseriata[13],Lasiodiplodiatheobromae[14],Neofusicoccumparvum[10],L.pseudotheobromae[15]和N.mangiferae[16],其中葡萄座腔菌是我国的优势种群,迄今已在我国18个省市被检测到[10]。
在我国,葡萄座腔菌引起葡萄果梗干枯、果实干缩或掉粒、枝干溃疡、树势减弱等症状,严重时造成死树。由葡萄座腔菌引起的病害在遇有持续高温、强降雨的气候条件下,或在果实高产、树势较弱的果园中发生严重,发病重的果园可减产30%以上[10]。目前生产上尚无高效的防控该病害的措施,因此,探讨利用品种抗性控制葡萄溃疡病尤为必要,亟需开展不同葡萄品种对葡萄座腔菌的抗性评价,为应用抗病品种防控病害和新品种选育提供依据。本研究以测定结果准确、经济、快速为原则,选取来源不同的葡萄座腔菌菌株,采用室内有伤接种一年生葡萄绿枝条和系统聚类分析方法,评价了我国25个葡萄主要品种对葡萄座腔菌的抗性并建立了抗性评价标准。
1 材料与方法
1.1 材料
接种试验选用本实验室分离保存的2个葡萄座腔菌B.dothidea菌株,菌株信息见表1。将供试菌株活化后,转接于直径为90 mm培养皿中的PDA培养基上,28℃条件下培养2 d,距菌落边缘10 mm处用5 mm灭菌打孔器打取菌饼备用。

表1 试验所用菌株
供试25个葡萄品种包括6个鲜食用欧美杂种(‘峰后’、‘巨玫瑰’、‘巨峰’、‘夏黑’、‘藤稔’、‘摩尔多瓦’);11个鲜食用欧亚种(‘美人指’、‘弗蕾无核’、‘玫瑰香’、‘红地球’、‘香妃’、‘红宝石无核’、‘维多利亚’、‘矢富罗莎’、‘无核白鸡心’、‘龙眼’、‘牛奶’);5个酿酒用欧亚种(‘赤霞珠’、‘霞多丽’、‘西拉’、‘梅鹿辄’、‘品丽珠’)和3个砧木品种(‘贝达’、‘5BB’、‘山葡萄洛桑’)。
在北京市农林科学院林业果树研究所品种资源圃选取不同品种的葡萄一年生健康半木质化的绿枝条,去掉叶片,剪成30~35 cm的枝段,每段包含4~5个节,用70%乙醇消毒,晾干后用于接种试验。
1.2 接种方法
采用有伤接种离体葡萄绿枝条的方法,参考Taylor等[7]有关葡萄溃疡病菌致病力测定方法并加以改进。在距绿枝条顶端15 cm处用4 mm灭菌打孔器打孔去除韧皮部和皮层,取1.1制备的菌饼接种于伤口处,用封口膜包扎保湿,每处理共30个枝条,分3个重复,平行重复2次;以接种同样大小的无菌PDA培养基为对照。接种后的绿枝条用枝剪在枝条下端做马蹄形修剪,顶端做平行修剪,插入装有灭菌蛭石的营养钵中,放置于温室培养(L∥D=12 h∥12 h,光照时25℃,黑暗时18℃,相对湿度80%),并保持蛭石湿润,每天观察枝条发病情况。
1.3 病害调查与统计分析
接种初期观察病害潜育期,在接种后第10天用刻度尺测量接种点圆心至病斑边缘的长度,即为病斑长度。
将调查所得的数据,利用SAS 9.0进行方差分析。使用IBM SPSS Statistics 21软件采用欧氏距离(Euclidean distance)计算品种间距离,离差平方和法(Ward’s)进行系统聚类分析。根据聚类谱系图,制定出不同葡萄品种对葡萄座腔菌抗性等级划分的标准。
2 结果与分析
2.1 不同葡萄品种对葡萄座腔菌的抗性分析
本研究利用2株葡萄座腔菌接种葡萄绿枝条,根据枝条上形成的病斑长度对25个供试葡萄品种对葡萄座腔菌的抗性进行评价。结果(图1)表明,不同葡萄品种对葡萄座腔菌的抗性存在明显差异:‘巨峰’,‘红宝石无核’,‘藤稔’,‘红地球’,‘香妃’’,‘玫瑰香’,‘巨玫瑰’,‘霞多丽’,‘龙眼’,‘西拉’,‘品丽珠’,‘贝达’,‘峰后’,‘梅鹿辄’,‘美人指’,‘赤霞珠’和‘山葡萄洛桑’等17个品种对葡萄座腔菌的抗性很强,接种后病斑没有扩展或者扩展很小,其中‘峰后’、‘藤稔’、‘美人指’、‘霞多丽’、‘梅鹿辄’潜育期较长;‘夏黑’、‘牛奶’、‘矢富罗莎’、‘维多利亚’和‘无核白鸡心’对葡萄座腔菌较为敏感,潜育期短,接种后病斑迅速扩大,而且在病斑上产生子实体。但‘弗蕾无核’、‘5BB’和‘摩尔多瓦’等3个葡萄品种对2个葡萄座腔菌菌株间的敏感性存在差异,表明葡萄座腔菌对葡萄存在致病力差异。

图1 不同葡萄品种接种葡萄座腔菌后10 d的病斑长度Fig.1 Mean length of lesions on different cultivars 10 days after inoculation with Botryosphaeria dothidea isolates
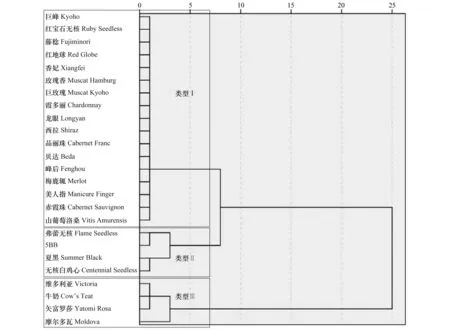
图2 25个葡萄品种对葡萄座腔菌抗性的聚类分析图Fig.2 Clustering analysis diagram for the resistance of 25 grape cultivars to Botryosphaeria dothidea
2.2 25个葡萄品种对葡萄座腔菌抗病性的聚类分析
按照1.3的方法对2.1的结果进行聚类,得到聚类分析谱系图(图2)。根据聚类分析结果,取阈值为5时,25个葡萄品种被聚为3类,类型I:‘巨峰’,‘红宝石无核’,‘藤稔’,‘红地球’,‘香妃’,‘玫瑰香’,‘巨玫瑰’,‘霞多丽’,‘龙眼’,‘西拉’,‘品丽珠’,‘贝达’,‘峰后’,‘梅鹿辄’,‘美人指’,‘赤霞珠’和‘山葡萄洛桑’;类型Ⅱ:‘弗蕾无核’,‘5BB’,‘夏黑’和‘无核白鸡心’;类型Ⅲ:‘维多利亚’,‘牛奶’,‘矢富罗莎’和‘摩尔多瓦’。2个葡萄座腔菌菌株在类型I中17个品种绿枝条上产生的病斑平均长度为0.80 cm,在类型Ⅱ和类型Ⅲ中葡萄品种上的平均病斑长度分别为9.21 cm和18.19 cm,由此可知三个类型的抗性依次为:类型Ⅰ>类型Ⅱ>类型Ⅲ。
2.3 25个葡萄品种对葡萄座腔菌的抗性等级划分
根据鉴定材料的病斑长度和用系统聚类分析法制定出的不同葡萄品种对葡萄座腔菌的抗性等级标准,聚类谱系图取阈值5,进行抗病和感病的划分,划分标准见表2。根据抗性级别评价标准,得到25个供试品种对葡萄座腔菌的抗/感结果,其中,抗病品种17个,占68%;感病品种4个,占16%;高感品种4个,占16%。
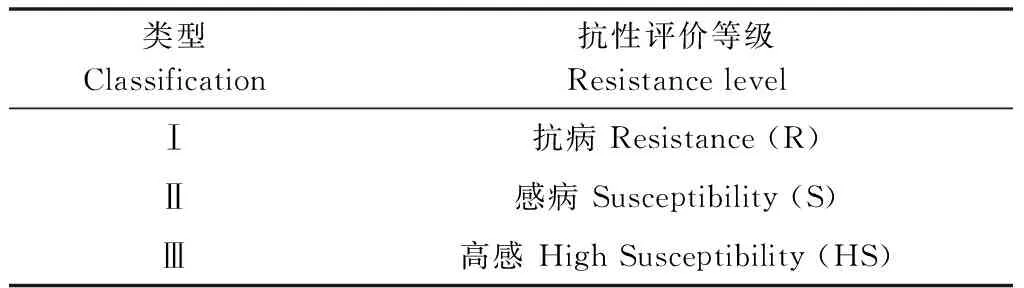
表2 葡萄对葡萄座腔菌抗性的评价标准
3 讨论
本研究采用有伤接种离体葡萄绿枝条的方法获得不同葡萄品种对葡萄座腔菌的抗性数据,由于方法简便易行,重复性好,数据易于采集,因此可以保证抗病评价结果的准确性和可靠性。数据分析采用系统聚类法,可以同时考虑更多数量的抗性指标,比传统方法兼顾更全面。
由本研究结果可知,‘巨峰’,‘红宝石无核’,‘藤稔’,‘红地球’等17个我国主要葡萄品种对葡萄座腔菌的抗性较强,可以在葡萄座腔菌危害严重的浙江、江苏、广西、山东等地区种植,以减轻危害。
‘夏黑’葡萄具有早熟、无核、香味浓郁等特点,已成为我国东部和南部地区的主栽鲜食品种,在江苏、上海、广西、云南等地广泛种植(2014年度葡萄产业技术发展报告,内部资料)。但本研究结果显示‘夏黑’对葡萄座腔菌表现为感病,另外,根据Yan等[10]的研究结果,葡萄溃疡病的另外一种重要病原菌可可毛色二孢对‘夏黑’致病力极强,因此,该品种在我国东部和南方地区的大面积种植应慎重。
本研究中选用的2个葡萄座腔菌菌株分别来源于天津和湖北,对‘巨峰’,‘红宝石无核’和‘藤稔’等大部分葡萄品种的致病力表现一致,但对个别品种,如‘弗蕾无核’,‘5BB’和‘摩尔多瓦’的致病力存在差异,与Yan等[10]的研究结果一致。由于葡萄座腔菌在我国河北、山东、山西、广西、云南等18个省市均有分布[10],因此,要选取当地的葡萄座腔菌株进行致病力分析,筛选抗葡萄座腔菌的新品种。此外,由于引起我国葡萄溃疡病的葡萄座腔菌科种类有6种,且病原菌种的分布存在地理差异[10,13-16],所以,在进行葡萄溃疡病抗病育种时,也要针对当地的优势病原菌种类开展工作。
[1] Pascoe I. Trunk diseases of grapevines-perspective from a tour of California [J]. The Australian Grapegrower & Winemaker, 1998 (417): 68-71.
[2] Van Niekerk J M, Fouriel P H, Halleen F, et al.Botryosphaeriaspp. as grapevine trunk disease pathogens[J]. Phytopathologia Mediterranea, 2006, 45: 43-54.
[3] Martos S, Andolfi A, Luque J, et al. Production of phytotoxic metabolites by five species of Botryosphaeriaceae causing decline on grapevines, with special interest in the speciesNeofusicoccumluteumandN.parvum[J]. European Journal of Plant Pathology, 2008, 121(4): 451-461.
[5] Qiu Y, Steel C C, Ash G J, et al. Survey of Botryosphaeriaceae associated with grapevine decline in the Hunter Valley and Mudgee grape growing regions of New South Wales [J]. Australasian Plant Pathology, 2011, 40(1): 1-11.
[6] Siebert J B. Eutypa: The economic toll on vineyards [J]. Wines Vines, 2001(4): 50-56.
[7] Taylor A, Hardy G E, Wood P, et al. Identification and pathogenicity ofBotryosphaeriaspecies associated with grapevine decline in Western Australia[J]. Australasian Plant Pathology, 2005, 34(2): 187-195.
[10]Yan J Y, Xie Y, Zhang W, et al. Species of Botryosphaeriaceae involved in grapevine dieback in China [J]. Fungal Diversity, 2013, 61(1): 221-236.
[11]Billones R G, Ridgway H J, Jones E E, et al. First report ofNeofusicoccummacroclavatumas a canker pathogen of grapevine in New Zealand [J]. Plant Disease, 2010, 94(12): 1504.
[12]Li X H, Yan J Y, Kong F F, et al.Botryosphaeriadothideacausing canker of grapevine newly reported in China [J]. Plant Pathology, 2010, 59(6): 1170.
[13]Yan J Y, Peng Y L, Xie Y, et al. First report of grapevine trunk disease caused byBotryosphaeriaobtusain China [J]. Plant Disease, 2011, 95: 616.
[14]Yan J Y, Li X H, Kong F F, et al. Occurrence of grapevine trunk disease caused byBotryosphaeriarhodinain China [J]. Plant Disease, 2011, 95: 219.
[15]Dissanayake A J, Zhang Wei, Liu Mei, et al.Lasiodiplodiapseudotheobromaecauses pedicel and peduncle discolouration of grapes in China [J]. Australasian Plant Disease Notes, 2015, 10(1): 1-5.
[16]Dissanayake A J, Zhang Wei, Li Xinghong, et al. First report ofNeofusicoccummangiferaeassociated with grapevine dieback in China [J]. Phytopathologia Mediterranea, 2015, 54(2): 414-419.
(责任编辑:杨明丽)
Resistant evaluation of main grape cultivars in China toBotryosphaeriadothidea
Zhang Wei1, Yao Shengwei1, Zhang Guojun2, Xie Yue1, Li Xinghong1, Xu Haiying2
(1. Institute of Plant and Environment Protection, Beijing Academy of Agriculture andForestry Sciences, Beijing 100097, China; 2. Institute of Forestry and Pomology,Beijing Academy of Agriculture and Forestry Sciences, Beijing 100093, China)
Wound inoculation method used on detached green shoots was used to identify and evaluate the resistance of 25 main grape cultivars toBotryosphaeriadothideain China. The length data of inoculated grapevine disease lesion were collected, and then the system clustering method was adopted to identify the resistance of different grape cultivars toB.dothideabased on the disease lesion length data. A resistant evaluation method of grape cultivars toB.dothideaand the resistance classification standard were established. Seventeen grape cultivars were resistant toB.dothidea, including ‘Kyoho’, ‘Ruby Seedless’, ‘Fujiminori’, ‘Red Globe’, ‘Xiangfei’, ‘Muscat Hamburg’, ‘Muscat Kyoho’, ‘Chardonnay’, ‘Longyan’, ‘Shiraz’, ‘Cabernet Franc’, ‘Beda’, ‘Fenghou’, ‘Merlot’, ‘Manicure Finger’, ‘Cabernet Sauvignon’ and ‘Vitis Amurensis’. ‘Flame Seedless’, ‘5BB’, ‘Summer Black’ and ‘Centennial Seedless’ were susceptible, while ‘Victoria’, ‘Cow’s Teat’, ‘Yatomi Rosa’ and ‘Moldova’ were highly susceptible.
grape; grapeBotryosphaeriadieback; resistant evaluation
2016-05-19
2016-07-06
国家现代农业产业技术体系(CARS-30);北京市农林科学院科技创新能力建设专项(KJCX20140402)
S 436.631
A
10.3969/j.issn.0529-1542.2017.03.030
* 通信作者 E-mail:lixinghong1962@163.com;haiyingxu63@sina.com
