Chelex-100法提取甘薯小象甲DNA及云南地区甘薯小象甲的分子鉴定
2017-06-05徐可成董跃丽杨子祥韦永贵孙跃先
徐可成, 董跃丽, 杨子祥, 韦永贵, 黄 琼*, 孙跃先*
(1. 云南农业大学植物保护学院, 昆明 650201; 2. 云南省农业科学院热区生态农业研究所,元谋 651300; 3. 文山州农业科学院, 文山 663099)
Chelex-100法提取甘薯小象甲DNA及云南地区甘薯小象甲的分子鉴定
徐可成1, 董跃丽1, 杨子祥2, 韦永贵3, 黄 琼1*, 孙跃先1*
(1. 云南农业大学植物保护学院, 昆明 650201; 2. 云南省农业科学院热区生态农业研究所,元谋 651300; 3. 文山州农业科学院, 文山 663099)
甘薯小象甲是国内外重要的检疫性害虫,除本身为害薯块外,引起的伤口还会诱致病菌侵入,使受害薯块发生恶臭和苦味无法食用。准确鉴定云南地区的甘薯小象甲,特别是研究其遗传变异可为检疫提供依据。本研究采集了云南元谋县甘薯小象甲,采用Chelex-100法快速提取甘薯小象甲基因组DNA,分别对雌雄成虫rDNA ITS-1序列进行系统发育分析,首次发现云南元谋县的甘薯小象甲属于东亚分支的东南亚亚支,与我国之前报道的甘薯小象甲属于东亚分支的东北亚亚支不同,说明云南元谋县的甘薯小象甲种群来源与中国广东、福建、浙江和重庆的种群来源不同。
甘薯小象甲; Chelex-100法; ITS-1; 系统发育
甘薯Ipomoeabatatas(L.)Lam.是旋花科番薯属一年生或多年生块根作物,其分布广泛、适应性强,经济价值高,广泛种植于世界上100多个国家[1]。我国是世界上最大的甘薯生产国,每年种植面积约600万hm2,年生产量约1.2亿t,在我国粮食生产中的面积仅次于水稻、小麦和玉米,位居第4位[2]。
甘薯小象甲Cylasformicarius又称甘薯蚁象甲,隶属鞘翅目锥象科,是国内外重要的检疫性害虫[2]。甘薯小象甲成虫啃食甘薯的嫩芽梢、茎蔓与叶柄的皮层,并将块根咬食成许多小孔,严重影响甘薯的生长发育和薯块的质量与产量。其幼虫钻蛀匿居于块根或薯蔓内,不但能抑制块薯的发育膨大,且其排泄物充塞于潜道中,助长病原侵染,导致薯块腐烂霉坏,变黑发臭[3-4]。
ITS序列在昆虫学、植物学和分类学方面具有重要应用价值[5-6]。其作为一种分子标记,主要应用于昆虫的品系鉴定、亲缘关系鉴定及系统发育、进化与扩散及昆虫与生态环境的关系等方面[7-14]。
昆虫基因组DNA的提取方法有很多,传统的酚/氯仿抽提法是DNA提取的经典方法,但是该方法操作步骤复杂、耗时长,容易产生交叉污染,残留在DNA溶液中的有机物质对DNA聚合酶有抑制作用。试剂盒法相对来说操作简单、高效,提取的DNA质量较高,但价格昂贵,提取量少。安瑞生等[15]和陈保锋等[16]分别通过改变研磨方式以及改进蛋白酶K法提高昆虫基因组DNA提取效率,但是操作仍较为复杂。另外,酚、氯仿等有机溶剂易造成环境污染,有损操作者健康。因此寻求一种简单、快速并且高效的甘薯小象甲DNA提取方法,显得尤为重要。
Chelex-100是一种由苯乙烯和苯二乙烯组成的独特螯合树脂,可以高选择性地结合多价阳离子,去除样品和缓冲液中的金属离子,避免煮沸过程中模板DNA的降解。目前Chelex-100法广泛应用于医学微量血痕DNA[17]和微生物DNA提取[18],以及植物转基因检测模板DNA的制备[19],而很少用于昆虫DNA的提取,对于甘薯小象甲DNA的提取更是未见报道。本试验首次利用Chelex-100法快速提取甘薯小象甲DNA,使其ITS基因的PCR扩增更加简便、省时。
目前关于甘薯小象甲研究主要集中在生物学、发生特点调查[20-21]及综合防治方面[22-23],对于甘薯小象甲的rDNA-ITS序列研究较少,Kiyohisa等[24]基于rDNA-ITS序列对世界主要疫区的甘薯小象甲作了遗传变异研究,国内仅有于海滨等[25]对中国4个省市6个地区的甘薯小象甲rDNA-ITS序列进行了分析,关于云南甘薯小象甲种群的ITS序列尚未有报道。为了明确云南的甘薯小象甲的遗传变异及来源,本研究采集了云南元谋县的甘薯小象甲,分别对雌雄成虫rDNA ITS-1序列进行了分析。
1 材料与方法
1.1 甘薯小象甲
甘薯小象甲采自云南省元谋县,在实验室内采用甘薯块根饲养多代,饲养条件如下:温度为(28±0.5)℃,相对湿度为75%±5%,光周期为L∥D=0 h∥24 h。分别取雌雄成虫各3头用于测序及系统发育分析。
1.2 基因组DNA的提取
1.2.1 Chelex-100法提取
取甘薯小象甲成虫除去鞘翅,用灭菌ddH2O清洗干净后在灭菌滤纸上干燥,干燥后取单头甘薯小象甲置于1.5 mL的离心管中,用灭菌玻璃棒充分研磨,加入150 μL悬浮好的5% Chelex-100溶液,100℃金属浴5 min,漩涡溶液5 s,12 000 r/min 离心5 min,上清液即可作为PCR反应的DNA模板。
1.2.2 试剂盒提取
取甘薯小象甲成虫用ddH2O清洗干净后在滤纸上干燥,按基因组DNA提取试剂盒(北京全式金生物技术有限公司生产)说明提取DNA。
1.3 试验处理
1.3.1 Chelex-100法提取和试剂盒提取对比
分别采用Chelex-100法和试剂盒法提取单头甘薯小象甲,各重复3次。
1.3.2 不同保存方式标本提取对比
分别以新鲜活虫、干制标本以及75%乙醇保存的甘薯小象甲为材料用Chelex-100法提取DNA,各重复3次。
1.3.3 模板保存时间的探索
将单头提取的甘薯小象甲DNA模板保存在-20℃冰箱中,分别对保存0、30、60、90 d的模板进行PCR扩增。
1.4 ITS-1区PCR扩增
ITS-1区PCR扩增引物:正向 5′-TTG ATT ACG TCC CTG CCC TTT-3′;反向 5′-ACG AGC CGA GTG ATC CAC CG-3′[8],引物由上海生工生物工程有限公司合成。扩增反应在30 μL反应体系中进行:11 μL ddH2O,15 μL 2×TaqPCR StarMix,正反引物各1.5 μL,DNA模板1 μL。扩增条件为:94℃预变性5 min;94℃变性60 s,55℃退火90 s,72℃延伸90 s,循环35次;最后72℃延伸10 min,置于4℃冰箱保存。
取2 μL PCR扩增产物和3 μL核酸染料混合,于1.2%的琼脂糖凝胶上电泳检测,电泳缓冲液为0.5×TBE,在120 V电压下进行45 min,置于UPV紫外成像系统上观察成像,并拍照。目的条带的纯化、测序和序列正反拼接均由华大基因完成。
1.5 数据分析
将测得的6个甘薯小象甲ITS-1序列在NCBI上进行比对,选取GenBank中同源性较高的甘薯小象甲以及中国6个地区甘薯小象甲的ITS-1序列(表1),采用MEGA 6.06进行同源性比较,以稻水象甲序列为外群,用NJ法构建系统发育树,遗传距离采用p-distance法,空位成对删除,用自展法对构建的系统发育树进行内部分支检验,重复1 000次。
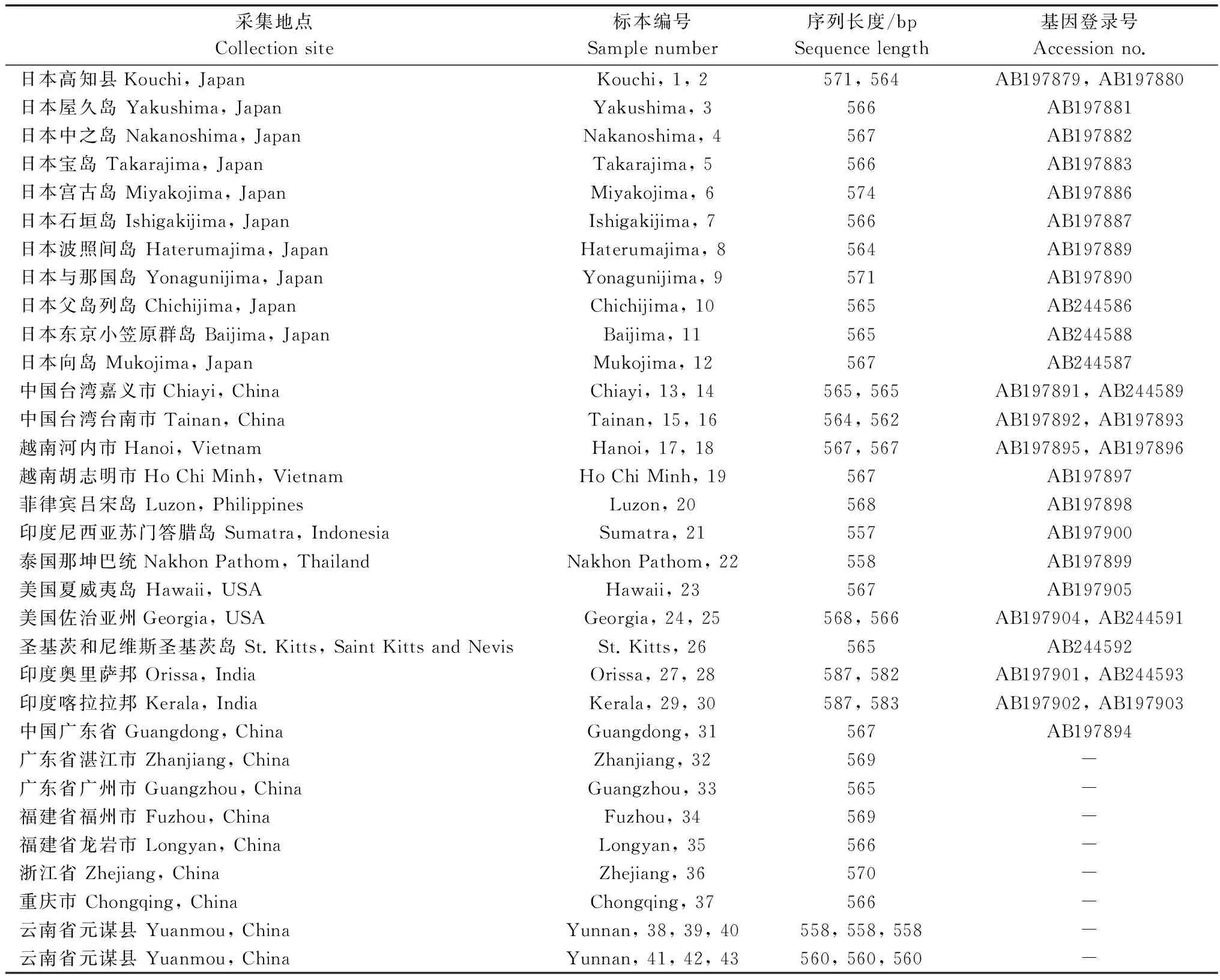
表1 甘薯小象甲来源、ITS-1序列长度以及GenBank登录号1)
1) “-”表示暂无基因登录号。 “-” indicate no accession number.
2 结果与分析
2.1 Chelex-100法提取与试剂盒提取对比
电泳检测结果显示(图1:泳道编号1~6):试剂盒提取单头甘薯小象甲DNA经ITS-1 PCR扩增,电泳条带较暗,其中一个重复没有条带,而Chelex-100法则均获得清晰明亮的电泳条带,表明试剂盒提取单头甘薯小象甲基因DNA的效果没有Chelex-100法理想,甚至有可能存在失败的情况,而Chelex-100法可抽提到适于PCR扩增反应的DNA模板,可为后续PCR试验提供足量的模板。
2.2 不同保存条件标本Chelex-100法抽提效果对比
结果表明(图1:泳道编号7~9)3种保存方式保存的样品采用Chelex-100法均能抽提到有效的DNA模板,但是电泳条带亮度显示:新鲜活虫>干制标本>75%乙醇保存标本。
2.3 模板保存时间对PCR效果的影响
Chelex-100使用说明上指出该法所获得模板应当于1周内使用,保存时间较短。而本试验结果显示(图1:泳道编号10~13):置于-20℃下保存1~3个月后的模板经PCR扩增,仍能获得较为清晰的电泳条带,但是电泳条带的亮度变暗,表明Chelex-100法提取的单头甘薯小象甲DNA模板在-20℃下可以保存较长的时间。

图1 不同处理下甘薯小象甲rDNA ITS-1 序列PCR扩增凝胶电泳Fig.1 Results of PCR amplification of rDNA ITS-1 sequences from Cylas formicarius by different treatments
2.4 甘薯小象甲rDNA ITS-1系统发育分析
由于有些地区的甘薯小象甲序列相似度较高,差异不明显,因此系统发育树的部分分支自展值偏低,但是3个地域性分支的自展值都在90以上(图2)。
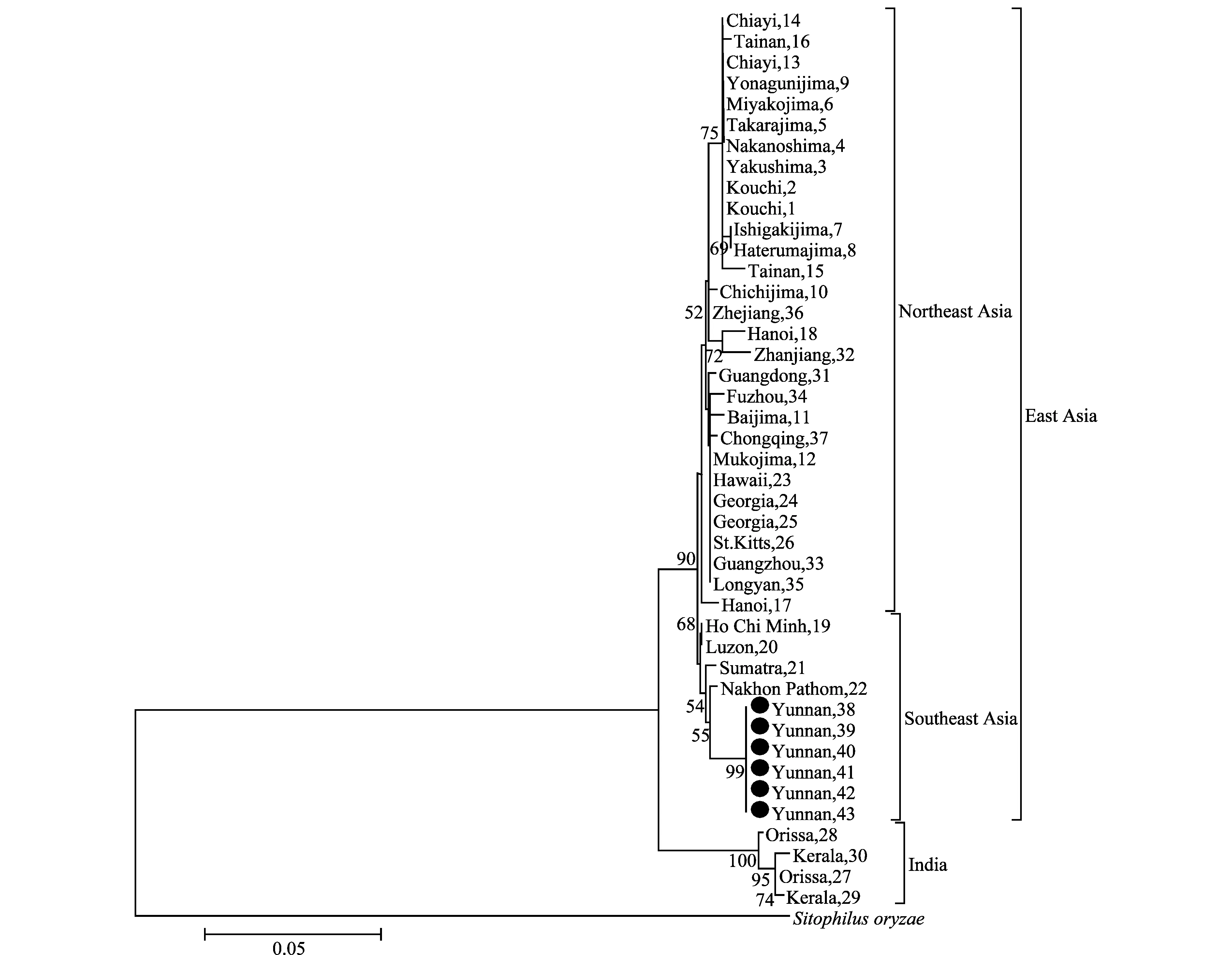
图2 基于NJ法构建的甘薯小象甲rDNA ITS-1序列的系统发育树Fig.2 Phylogenetic tree based on ITS-1 sequences of Cylas formicarius from different areas using the NJ method
该树表明甘薯小象甲被分为东亚分支和印度分支两大主支,东亚分支又分为东北亚亚支和东南亚亚支,其中东北亚亚支包括日本各地区,中国台湾、浙江、广东、福建和重庆地区,越南河内,美国佐治亚州、夏威夷岛以及圣基茨和尼维斯的圣基茨岛;东南亚亚支包括越南胡志明市,菲律宾吕宋岛,印度尼西亚苏门答腊岛,泰国以及中国云南地区,其中云南地区3个甘薯小象甲序列长度和泰国一致,且雌雄成虫的ITS-1序列长度并无明显差异,同源性达到100%。
3 结论
与传统酚/氯仿抽提法相比,Chelex-100法未使用苯酚去除蛋白,因此DNA纯度不高,但PCR对模板纯度的要求较低,Chelex-100法获得的DNA足以扩增出所需的基因片段,因此结果是可靠的[26]。本试验首次利用Chelex-100法快速提取甘薯小象甲DNA,与试剂盒法需裂解3 h相比较,Chelex-100法提取的整个过程只需15 min左右,使其ITS基因的PCR扩增更加简便、省时,克服了利用传统形态学鉴定的困难,在快速鉴定甘薯小象甲以及大规模提取其基因组DNA等方面具有重要意义。但是PCR-RFLP等精细分子试验以及其他昆虫的基因组DNA的提取能否采用Chelex-100法还有待进一步的研究。
甘薯小象甲起源于印度[27],由于其飞行能力差[28],主要通过人为运输带虫甘薯传播[27]。经与国内外的甘薯小象甲序列进行比较分析,研究结果与Kiyohisa等[24]的研究结果基本一致,甘薯小象甲可以分成两个明显的地域性主支,即印度分支和东亚分支,东亚分支又分为东北亚亚支和东南亚亚支。此外,印度分支和东亚分支的序列长度差异较大,东亚分支的甘薯小象甲ITS-1序列长度范围在557~574 bp,明显短于印度地区的甘薯小象甲。其中云南地区的3个甘薯小象甲ITS-1序列长度和泰国地区的一致,且位于东南亚亚支的同一分支上,由此说明云南地区3个甘薯小象甲很有可能是由泰国传入的。与于海滨等[25]的报道不同,他们的研究表明中国甘薯小象甲至少有两个来源,但都处于东北亚亚支上。本研究首次发现中国云南地区的甘薯小象甲处于东南亚亚支上,也就是说,云南元谋县的甘薯小象甲种群来源与中国广东、福建、浙江和重庆的不同。至于云南的甘薯小象甲是否还存在其他的遗传变异,还有待更多地区的标本进行分析。
[1] 陆漱韵, 刘庆昌, 李惟基. 甘薯育种[M]. 北京: 中国农业出版社, 1998.
[2] 张世祎, Talekar N S, 李正跃, 等. 甘薯小象甲成虫对甘薯植株不同部位的选择行为[J]. 云南大学学报(自然科学版),2008, 30(S1): 127-129.
[3] 张裕君,刘跃庭,廖芳,等.DNA条形码技术研究进展及其在植物检疫中的应用展望[J].中国植保导刊,2010,30(4):15-17.
[4] Elder J R, Turner B J. Concerted evolution of repetitive DNA sequences in eukaryotes [J]. Quarterly Review of Biology, 1995, 70: 297-319.
[5] 王建波,张文驹,陈家宽.核rDNA的ITS序列在被子植物系统与进化研究中的应用[J]. 植物分类学报, 1999, 37(4): 407-416.
[6] 任国栋, 宁靖. 基于18S rDNA的全变态类昆虫系统发育分析[J]. 科技导报, 2011, 29(22): 38-41.
[7] Manonmani A, Townson H, Adeniran T, et al. rDNA-ITS2 polymerase chain reaction assay for the sibling species ofAnophelesfluviatilis[J]. Acta Tropica, 2001, 78(1): 3-9.
[8] 周水森, 汤林华, 顾政诚, 等. 不同地区微小按蚊rDNA ITS2序列差异[J]. 中国寄生虫学与寄生虫病杂志, 2002, 20(1): 29-31.
[9] Alvarez J M, Hoy M A. Evaluation of the ribosomal ITS2 DNA sequences in separating closely related populations of the parasitoidAgeniaspis(Hymenoptera: Encyrtidae) [J]. Annals of the Entomological Society of America, 2002, 95: 250-256.
[10]De Barro P J, Driver F, Trueman J, et al. Phylogenetic relationships of world populations ofBemisiatabaci(Gennadius) using ribosomal ITS1 [J]. Molecular Phylogenetics and Evolution, 2000, 16: 29-36.
[11]Honda J Y, Nakashima Y, Yanase T, et al. Use of the internal transcribed spacer (ITS-1) region to inferOrius(Hemiptera: Anthocoridae) species phylogeny [J]. Applied Entomology Zoology, 1998, 33: 567-571.
[12]Marinucci M, Romi R, Mancini P, et al. Phylogenetic relationships of seven palearctic members of themaculipenniscomplex inferred from ITS2 sequence analysis [J]. Insect Molecular Biology, 1999, 8(4): 469-480.
[13]Thomson L J, Rundle B J, Carew M E, et al. Identification and characterization ofTrichogrammaspecies from south-eastern Australia using the internal transcribed spacer 2 (ITS-2) region of the ribosomal gene complex [J]. Entomologia Experimentalis et Applicata, 2003, 106: 235-240.
[14]Perrin A, Cetre-sossah C, Mathieu B. Phylogenetic analysis ofCulicoidesspecies from France based on nuclear ITS1-rDNA sequences [J]. Medical and Veterinary Entomology, 2006, 20: 219-228.
[15]安瑞生, 谭声江, 陈晓峰. 小型昆虫DNA提取时匀浆方法的改进[J]. 昆虫知识, 2002, 39(4): 311-312.
[16]陈保锋, 章欢, 申跃武, 等. 一种简洁实用的昆虫基因组DNA提取方法[J]. 医学动物防治, 2013, 29(6): 647-648.
[17]许金朋, 郝永清. Chelex-100法直接提取乳样中奶牛乳房炎主要致病菌DNA方法的建立[J]. 中国畜牧兽医, 2014, 41(11): 25-29.
[18]周月琴, 朱伟, 刘志萍, 等. 用Chelex-100快速提取微量血痕中的DNA[J]. 复旦学报, 2003, 30(4): 379-380.
[19]王永, 张莉, 兰青阔, 等. Chelex-100快速提取用于转基因检测DNA模板的研究[J]. 生物技术通报, 2008(2): 143-145.
[20]叶明鑫. 甘薯小象甲发生特点调查与原因分析[J]. 中国农学通报, 2015, 31(4): 195-199.
[21]潘初沂. 闽东南地区甘薯小象甲发生为害特点初探[J]. 福建农业科技, 2006(5): 59-61.
[22]徐三勤, 王海富, 陈时伟. 甘薯小象甲的发生规律与防控技术[J]. 现代园艺, 2015(7): 98-99.
[23]黄立飞, 黄世辉, 房伯平, 等. 甘薯小象甲的防治研究进展[J]. 广东农业科学, 2011(S1): 77-79.
[24]Kiyohisa K, Tuyosi S, Koji K, et al. Genetic variation of sweet potato weevils,Cylasformicarius(Fabricius) (Coleoptera: Brentidae), in main infested areas in the world based upon the internal transcribed spacer-1 (ITS-1) region [J]. Applied Entomology and Zoology, 2007, 42(1): 89-96.
[25]于海滨, 沈卫红, 马娟, 等. 中国甘薯小象甲的rDNA ITS-1遗传变异及入侵来源研究[J]. 中国农学通报, 2011, 27(18): 282-287.
[26]Jinks D C, Minter M, Tarver D A, et al. Molecular genetic diagnosis of sickle cell disease using dried blood specimens on blotters used for newborn screening [J]. Human Genetics, 1989, 81(4): 363-366.
[27]Wolfe G W. The origin and dispersal of the pest species ofCylaswith a key to the pest species groups of the world [M]// Sweet potato pest management, a global perspective. Boulder: Westview Press, 1991.
[28]Moriya S. A preliminary study on the flight ability of the sweet potato weevil,Cylasformicarius(Fabricius) (Coleoptera: Apionidae) using a flight mill [J]. Applied Entomology Zoology, 1995, 30: 244-246.
(责任编辑:杨明丽)
DNA extraction fromCylasformicarius(Coleoptera: Brentidae) by Chelex-100method and molecular identification ofCylasformicariusin Yunnan
Xu Kecheng1, Dong Yueli1, Yang Zixiang2, Wei Yonggui3, Huang Qiong1, Sun Yuexian1
(1. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China;2. Tropical Eco-agriculture Institute of Yunnan Academy of Agricultural Sciences, Yuanmou 651300, China;3. Yunnan Wenshan Academy of Agricultural Sciences, Wenshan 663099, China)
Sweet potato weevil (Cylasformicarius) is an important quarantine pest in the world. It not only harms sweet potato tuber but also makes wounds that induced pathogen to infect, which caused infected sweet potato to send out offensive odor and turn bitter. Accurate identification of sweet potato weevils in Yunnan, especially its genetic variation, can provide a basis for quarantine. In this research, we collected sweet potato weevils from Yuanmou County, Yunnan Province, applied a rapid method for extracting the DNA ofC.formicariusby using Chelex-100 and analyzed the ITS-1 sequence of adult female and male insects. We first find that sweet potato weevils in Yuanmou County belong to the southeast subclade of the East Asia clade. This result differs from the previous report that sweet potato weevils belong to the Northeast subclade of the East Asia clade,suggesting that sweet potato weevils populations in Yuanmou County differs from those in Guangdong, Fujian, Zhejiang and Chongqing.
Cylasformicarius; Chelex-100 method; ITS-1; phylogeny
2016-07-09
2016-08-30
国家自然科学基金(31270067)
S 435.315
A
10.3969/j.issn.0529-1542.2017.03.026
致 谢: 感谢河北大学生命科学院陈书龙研究员提供的中国6个地区的甘薯小象甲ITS-1序列。
* 通信作者 E-mail:huangqiong88hs@163.com;sunyx82114@gmail.com
