‘芽黄’红瑞木枝干溃疡病病原菌的鉴定及药剂防治
2017-06-05罗卿权路广亮刘亚杰吴时英季国辉
罗卿权, 路广亮, 王 凤, 周 坤,刘亚杰, 吴时英, 季国辉, 徐 颖*
(1. 上海市园林科学规划研究院, 上海 200232;2. 上海申迪园林投资建设有限公司, 上海 201205; 3. 上海市浦东新区林业站, 上海 201210)
‘芽黄’红瑞木枝干溃疡病病原菌的鉴定及药剂防治
罗卿权1, 路广亮1, 王 凤1, 周 坤2,刘亚杰2, 吴时英3, 季国辉3, 徐 颖1*
(1. 上海市园林科学规划研究院, 上海 200232;2. 上海申迪园林投资建设有限公司, 上海 201205; 3. 上海市浦东新区林业站, 上海 201210)
‘芽黄’红瑞木枝干溃疡病在上海发生严重。本研究通过病原菌分离,致病性测定和形态学特征观察,将引起此病害的病原菌鉴定为拟盘多毛孢属一种Pestalotiopsissp.。通过扩增病原菌的rDNA-ITS序列,构建系统发育树,其在系统发育树上与拟盘多毛孢属中分生孢子中间三个细胞异色的类群处于同一分支,此结果与形态学鉴定结果一致。5种杀菌剂室内药剂筛选结果表明,对Pestalotiopsissp.的抑制中浓度(EC50)为0.639~1.787 μg/mL。4种杀菌剂室外药效试验结果表明,在发病初期,25%丙环唑乳油和25%嘧菌酯悬浮剂防治效果可达80%以上,当病害发展后,供试4种杀菌剂对病害的防治效果均小于50%。
‘芽黄’红瑞木; 枝干溃疡; 拟盘多毛孢属; 药剂筛选; 药效试验
‘芽黄’红瑞木Cornusalba‘Bud’s Yellow’是山茱萸科梾木属落叶灌木,其叶片卵圆形,花白色,茎秆终年呈黄绿色,冬季落叶后,茎秆金黄,鲜明突出[1]。因花与枝条皆具有较高的观赏价值,逐渐成为园林造景中优良的彩色树种。红瑞木在我国原分布于东北、华北和西北地区[2],因其具观赏价值,其引种分布区域逐渐扩大,近年来在上海乃至华东地区,红瑞木也被广泛种植。
‘芽黄’红瑞木在上海迪士尼乐园园区被广泛种植,近两年在园区调查中发现, ‘芽黄’红瑞木上一种茎秆病害发生严重,此病害在小枝和主枝上均可发生。上海梅雨季节后,植株茎秆上始现病斑;此后,随着病害发展,病斑逐渐增大或增多,造成小枝枯死,发生严重者甚至危害基部主枝,导致整株植物枯萎死亡。此病害不仅对‘芽黄’红瑞木危害程度较严重,而且其危害率也较高,夏末调查显示,苗圃区株发病率达60%以上。
鉴于此病害对‘芽黄’红瑞木造成的严重危害,本研究对其危害症状等进行了观察描述,对病原菌进行了分离培养和致病性测定,利用传统的形态学鉴定,结合核糖体 DNA 内部转录间隔区(ITS,internal transcribed spacer)序列的系统发育树分析,对病原菌进行了鉴定;并进行了药剂筛选和药效防治试验,以期科学有效地指导该病害的识别与防控。
1 材料与方法
1.1 采样与分离
从上海迪士尼乐园西北苗圃‘芽黄’红瑞木上采集发病枝条,对症状典型的病枝进行病原菌分离[3]:取发病枝条病健交界处表面积4 mm×2 mm植物组织,70%乙醇消毒2~3 s,5%次氯酸钠消毒2 min,在无菌水中漂洗3次后晾干,置于含0.2%乳酸的PDA平板上,25℃恒温培养,5 d后挑取组织块周围的菌丝转皿培养、纯化,必要时用孢子稀释法进行单孢分离。对分离物归类、编号和转管4℃保存。
1.2 致病性测定
将菌株于PDA平板上25℃恒温培养5 d,用无菌手术刀将菌丝块切成5 mm×3 mm大小。选取‘芽黄’红瑞木健康植株,用无菌手术刀轻轻划伤枝条表皮,将菌丝块正面朝向伤口,用已浸湿无菌水的脱脂棉保湿伤口,并对接种枝条套袋保湿24 h。每个菌株设3个重复,并设置清水对照。接种后分别于7 d和14 d观察并记录发病情况,对发病枝条进行病原菌再分离及再次进行致病性测定。
1.3 病原菌形态特征观察
将致病菌株转移至PDA平板上,25℃恒温培养3~7 d,观察菌落形态特征,在光学显微镜下观察病原菌的分生孢子形态,并测量其大小,鉴定。
1.4 病原菌rDNA-ITS的PCR扩增与序列分析
1.4.1 基因组DNA提取
将致病菌株转接到PDA平板上,于25℃培养5~7 d,在平板上倒入液氮,用灭菌的载玻片刮取菌丝至研钵研磨,采用改良的CTAB法提取基因组DNA[4]。
1.4.2 rDNA-ITS PCR扩增和纯化
采用真菌核糖体rDNA ITS区域通用引物ITS1-fungl和ITS4 进行PCR扩增,引物序列如下:ITS1-fungl(5′-CTTGGTCATTTTAGAGGAAGTAA-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR反应体系总体积25 μL,包括:10×PCR Buffer 2.5 μL,dNTP mix(各25 mmol/L)2 μL,MgCl2(25 mmol/L)1.5 μL,真菌通用引物ITS1/ITS4(20 μmol/L)各0.5 μL,DNA模板0.5 μL(50 ng/μL),rTaq(5 U/μL)0.125 μL。反应程序为:94℃预变性5 min;94℃变性15 s,50℃退火45 s,72℃延伸45 s,35个循环;72℃延伸5 min。
1%琼脂糖凝胶电泳检测PCR产物,并用DNA凝胶回收试剂盒(Axygen)切胶纯化后获得目的基因片段。
1.4.3 目的片段的克隆测序及序列分析
通过pMD19-T Vector(TaKaRa)对纯化后DNA片段进行克隆,蓝白斑筛选后将阳性单克隆送上海生工生物技术有限公司测序。测序结果在NCBI GenBank(http:∥www.ncbi.nlm.gov)中Blast同源比对,向GenBank提交基因序列。参照Jeewon等[5]对Pestalotiopsis部分种构建的系统发育树,使用Mega5.0软件Maximum likelihood分析方法,构建系统发育树。相关序列基本信息见表1。

表1 本研究中参与系统发育树分析的序列1)
续表1 Table 1(Continued)
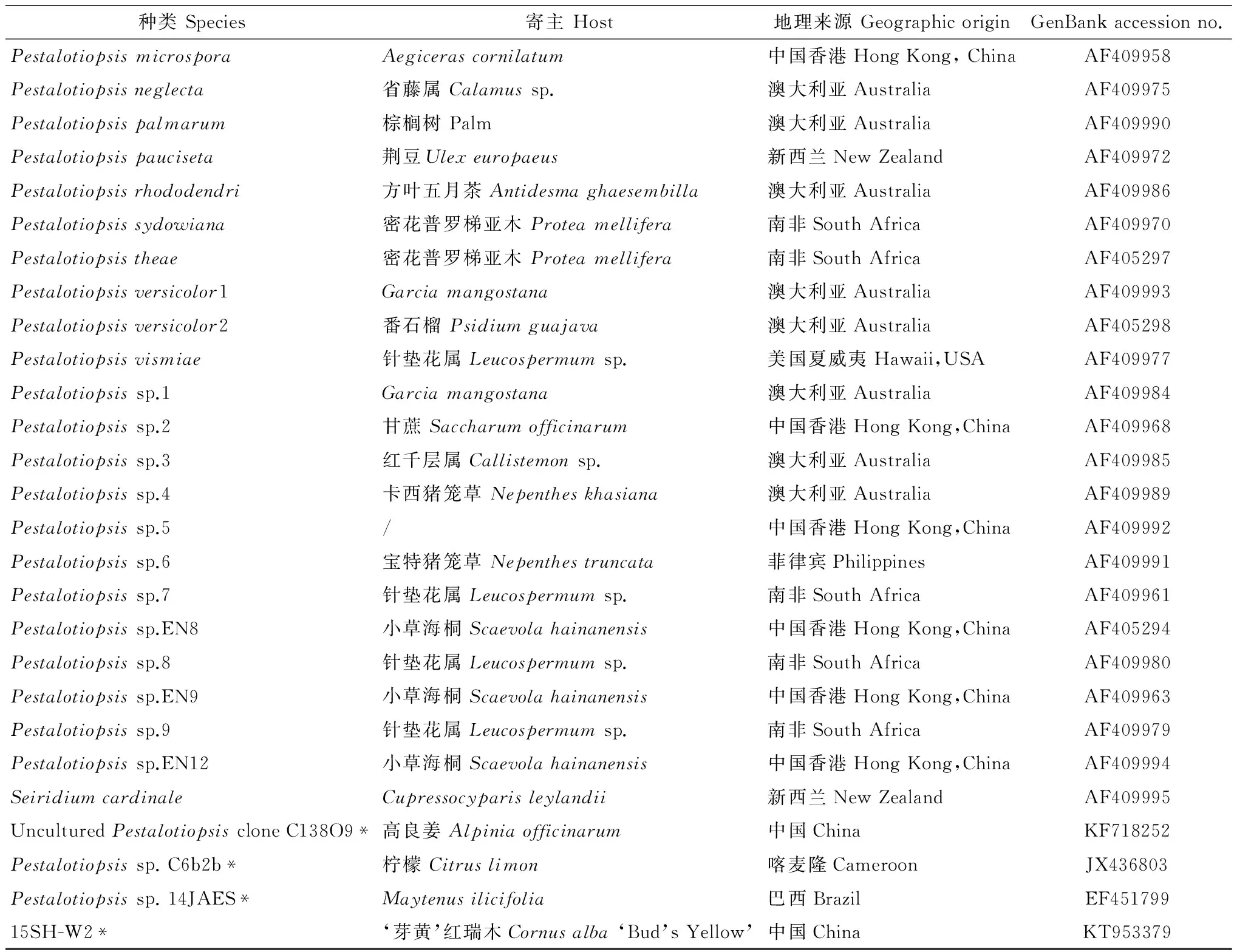
种类Species寄主Host地理来源GeographicoriginGenBankaccessionno.PestalotiopsismicrosporaAegicerascornilatum中国香港HongKong,ChinaAF409958Pestalotiopsisneglecta省藤属Calamussp.澳大利亚AustraliaAF409975Pestalotiopsispalmarum棕榈树Palm澳大利亚AustraliaAF409990Pestalotiopsispauciseta荆豆Ulexeuropaeus新西兰NewZealandAF409972Pestalotiopsisrhododendri方叶五月茶Antidesmaghaesembilla澳大利亚AustraliaAF409986Pestalotiopsissydowiana密花普罗梯亚木Proteamellifera南非SouthAfricaAF409970Pestalotiopsistheae密花普罗梯亚木Proteamellifera南非SouthAfricaAF405297Pestalotiopsisversicolor1Garciamangostana澳大利亚AustraliaAF409993Pestalotiopsisversicolor2番石榴Psidiumguajava澳大利亚AustraliaAF405298Pestalotiopsisvismiae针垫花属Leucospermumsp.美国夏威夷Hawaii,USAAF409977Pestalotiopsissp.1Garciamangostana澳大利亚AustraliaAF409984Pestalotiopsissp.2甘蔗Saccharumofficinarum中国香港HongKong,ChinaAF409968Pestalotiopsissp.3红千层属Callistemonsp.澳大利亚AustraliaAF409985Pestalotiopsissp.4卡西猪笼草Nepentheskhasiana澳大利亚AustraliaAF409989Pestalotiopsissp.5/中国香港HongKong,ChinaAF409992Pestalotiopsissp.6宝特猪笼草Nepenthestruncata 菲律宾PhilippinesAF409991Pestalotiopsissp.7针垫花属Leucospermumsp.南非SouthAfricaAF409961Pestalotiopsissp.EN8小草海桐Scaevolahainanensis中国香港HongKong,ChinaAF405294Pestalotiopsissp.8针垫花属Leucospermumsp.南非SouthAfricaAF409980Pestalotiopsissp.EN9小草海桐Scaevolahainanensis中国香港HongKong,ChinaAF409963Pestalotiopsissp.9针垫花属Leucospermumsp.南非SouthAfricaAF409979Pestalotiopsissp.EN12小草海桐Scaevolahainanensis中国香港HongKong,ChinaAF409994SeiridiumcardinaleCupressocyparisleylandii新西兰NewZealandAF409995UnculturedPestalotiopsiscloneC138O9*高良姜Alpiniaofficinarum中国ChinaKF718252Pestalotiopsissp.C6b2b*柠檬Citruslimon喀麦隆CameroonJX436803Pestalotiopsissp.14JAES*Maytenusilicifolia巴西BrazilEF45179915SH-W2*‘芽黄’红瑞木Cornusalba‘Bud’sYellow’中国ChinaKT953379
1) 未标注*的种类,均参考Jeewon等[5]。 Refer to Jeewon et al[5]for the species (genus) without the label *.
1.5 药剂防治试验
1.5.1 供试药剂
25%嘧菌酯悬浮剂(SC)(先正达中国投资有限公司);10%苯醚甲环唑水分散粒剂(WG)(先正达中国投资有限公司);80%代森锰锌可湿性粉剂(WP)(南通德斯益农化工有限公司);50%多菌灵可湿性粉剂(WP)(上海悦联化工有限公司);25%丙环唑乳油(EC)(先正达中国投资有限公司)。
1.5.2 室内药剂筛选
采用菌落生长速率法测定供试药剂对致病菌的菌丝生长抑制率。将菌株接种在PDA培养基上,于25℃ 培养箱中黑暗培养7 d,用直径5 mm打孔器沿菌落边缘打取菌碟,菌丝面向下置于含质量浓度 0.1、0.2、0.4、0.8、1.6 和3.2 μg /mL的PDA平板上,每处理重复3次,并设无药空白对照。25℃黑暗培养,待对照平板的菌落直径长至培养皿直径约 2/3 时,用十字交叉法测量各处理菌落直径。计算菌丝生长抑制率。
菌丝生长抑制率(%)=[1-(处理菌落直径-菌饼直径)/(对照菌落直径-菌饼直径)]×100。
将菌丝生长抑制率换算成几率值(y),药剂浓度换算成浓度对数(x),按浓度对数与几率值回归法求得线性回归方程y=a+bx,并计算各供试药剂对病原菌的抑制中浓度(EC50)、几率值与浓度对数之间回归的相关系数r值。
1.5.3 田间药效防治试验
于2014年在上海迪士尼西北苗圃进行田间药效防治试验。采用喷雾的方法,连续施药3次,间隔期为14 d左右。每个药剂处理100盆‘芽黄’红瑞木,并设清水对照。第一次施药前将所有具明显病斑的枝条剪除。每次药后14 d调查发病情况。并计算株发病率、病情指数及防治率。病害调查分级标准如下:0级, 无枝枯;1级, 1枝无分枝的小枝枯萎;2级, 无分枝的小枝枯萎,数目大于1枝;3级, 1枝有顶级分枝的枝条枯萎;4级, 有顶级分枝的枝条枯萎且枝条枯萎数目大于1枝;5级, 1枝或1枝以上基部大枝(至少有两级分枝)枯萎;6级,整株枯萎。株发病率的计算公式为:株发病率(%)=发病株数×100/总株数;株发病防治效果(%)=(1-处理株发病率/对照株发病率)×100;病情指数=100×∑(各级病株数×各级代表值)/(调查总株数×最高级代表值);病情指数防治效果(%)=(1-处理病情指数/对照病情指数)×100。
2 结果与分析
2.1 病害症状观察
‘芽黄’红瑞木溃疡病在上海始发于6月初,发病初期受害枝条表皮上出现长约3 mm的黑褐色、两端稍尖的长椭圆形病斑,随着病情的发展,病斑逐步扩大,长达数厘米,或扩展成片,呈不规则状,使枝条表皮环状坏死,导致病斑坏死部分上端枝条枯死,叶片枯萎(图1a)。病原菌既可侵染植株顶部较小的分枝,导致分枝枯死,也可侵染植株主干基部,导致整株植物枯萎死亡。
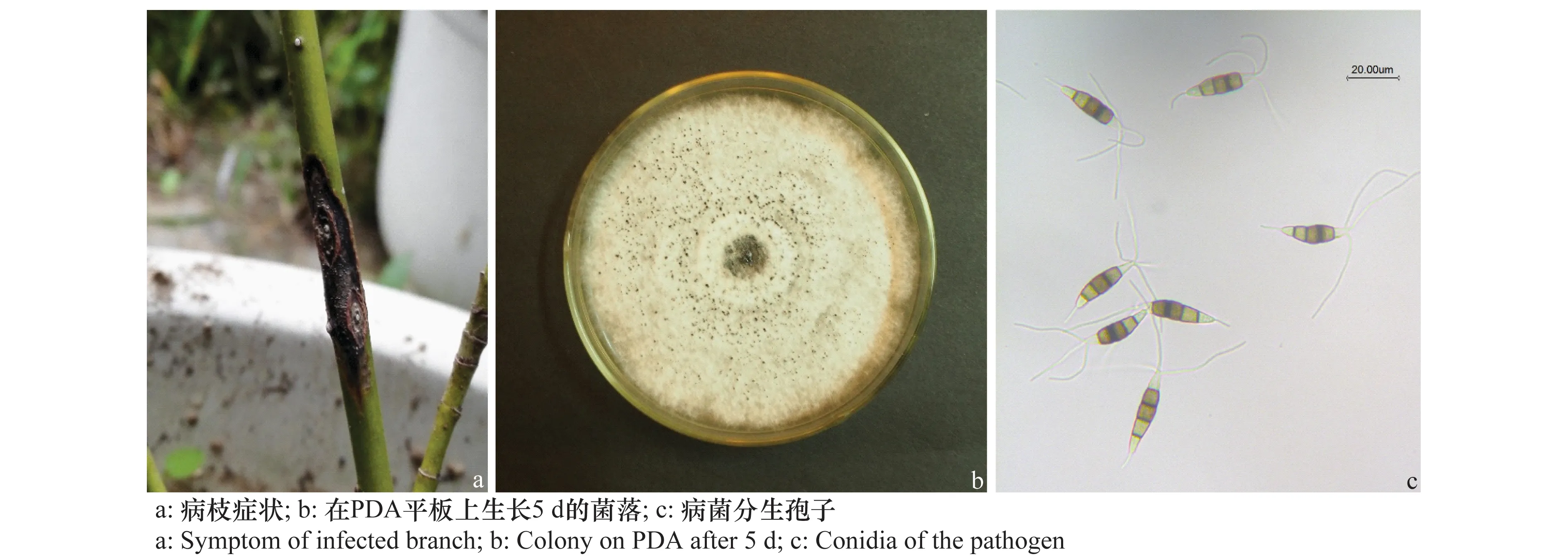
图1 红瑞木枝干溃疡病症状及病原菌形态Fig.1 Symptoms of infected branch of Cornus alba and morphology of the pathogen Pestalotiopsis sp. causing trunk canker
2.2 病原菌鉴定
2.2.1 病原菌分离、鉴定及致病性测定
从采集的发病‘芽黄’红瑞木中,挑取5个症状典型的病斑,从每个病斑的病健交界处各切取3块植物组织进行分离,培养后获得15个单菌落。其中5个菌落颜色为白色,从中随机挑取2个菌落进行转移培养,分别编号为15SH-W1, 15SH-W2。其余10个菌落形态特征一致,颜色均为灰色,从中随机挑取4个菌落进行转移培养,分别编号为15SH-G1, 15SH-G2, 15SH-G3, 15SH-G4。将上述6株编号菌株进行致病性测定,结果见表2,15SH-W1和15SH-W2接种后植株均表现发病,而4株菌落颜色为灰色的菌株和对照接种后不发病。对致病的菌株15SH-W1和15SH-W2接种产生的病斑进行了再分离培养和观察。
在PDA培养基上,菌株15SH-W1和15SH-W2气生菌丝较浓密,呈绒毛状,白色,至生长后期,其上产黑色的分生孢子器(图1b)。显微观察,分生孢子呈纺锤形,分生孢子大小为(29.14±2.25)μm×(7.12±0.39)μm,分生孢子具有4个分隔,将分生孢子分为5个细胞,中间3个细胞颜色为深色,且为异色。两端两个细胞无色,近三角形。顶部细胞直接着生3根附属丝(长度为30.77±2.81 μm),附属丝顶端不呈匙状,基部细胞着生一根较短的附属丝(长度为7.78±1.96 μm)(图1c)。从接种病斑上重新分离的病原菌与上述形态描述一致。根据菌落形态和分生孢子特征,参照真菌分类相关文献[6-8],认为上述特征符合拟盘多毛孢属Pestalotiopsis分类特征,将此病原菌鉴定为拟盘多毛孢Pestalotiopsissp.。
为验证菌株致病性,选择下列菌株再次接种:15SH-W1,菌株15SH-W1的单孢分离菌株,编号为15SH-W1(SC),菌株15SH-W1的回收分离菌株,编号为15SH-W1(E),菌株15SH-W2的回收分离菌株,编号为15SH-W2(E)。从表2结果可知,上述4株菌株接种的植株均表现为发病,而对照不发病。因此可确定分离获得的拟盘多毛孢Pestalotiopsissp.菌株是 ‘芽黄’红瑞木溃疡病的致病病原菌。

表2 ‘芽黄’红瑞木溃疡病病原菌致病性测定
2.2.2 病原菌rDNA-ITS序列分析及系统进化树构建
用引物 ITS1-fungl 和ITS4 对15SH-W2 菌株基因组DNA PCR扩增获得了1条600 bp左右的清晰条带。将目标条带回收纯化,并克隆测序后得到了长度为590 bp 的rDNA-ITS 序列。将该序列(已提交GenBank数据库,登录号:KT953379)在GenBank数据库中进行Blast同源性比对,结果显示所测的序列与多株拟盘多毛孢属(Pestalotiopsissp.)菌株序列(登录号:KF718252.1,KF718250.1,EF451804.1,KF718249.1,JX436803.1,EF451799.1)相似度均较高,达到99%。由于以上序列均未能鉴定到种,同时比对结果中相似度达98%以上的序列很多,且参比序列是拟盘多毛孢属下不同种,Blast比对结果表明15SH-W2属于拟盘多毛孢属,但不能鉴定到属下种级分类单元。
基于表1菌株序列,参照Jeewon等[5]运用MEGA 5.0软件采用Maximum Likelihood分析方法,构建系统发育树,bootstrap值为1 000。聚类分析结果显示,所选序列构建的系统进化树各分支自展值较高,在属内主要分为X、Y、Z三大分支。所测菌株15SH-W2与Blast同源性比对中同源性最高的菌株序列(KF718252,JX436803,EF451799)均在X分支下(图2),表明它们之间遗传距离较近。拟盘多毛孢属下分为三大类群的结果与Jeewon等[5]利用ITS和5.8S序列建立的系统进化树所得到的结果一致。同时,Jeewon等[5]的研究结果表明,这3个基于分子系统发育信息分类的类群,与以下基于形态特征区分的类群完全吻合:X类群形态特征为中间细胞异色且顶端细胞附属丝顶部不存在匙状凸起,Y类群特征为中间细胞同色且顶端细胞附属丝顶部存在匙状凸起,Z类群特征为中间细胞同色且顶端细胞附属丝顶部不存在匙状凸起。本研究中引起“芽黄”红瑞木溃疡病的病菌在形态学特征上符合X类群特征:中间细胞异色,顶端附属丝顶部不存在匙状凸起。

图2 基于GenBank数据库的系统发育树构建Fig.2 Phylogenetic tree based on the ITS sequences of the 15SH-W2 and other isolates from GenBank
2.3 药剂防治试验结果
2.3.1 室内药剂筛选结果
表3结果表明,5种杀菌剂EC50值较接近,80%代森锰锌可湿性粉剂的EC50值最低,为0.639 mg/L,25%嘧菌酯悬浮剂EC50值最高,为1.787 mg/L。
2.3.2 室外药剂防治试验结果
从表4室外防治试验结果可知,第1次和第2次药后调查,对照的病情指数分别为4.20和6.00,病害发生程度较轻。此时,25%丙环唑乳油和25%嘧菌酯悬浮剂均有较好的防治效果,第1次药后防治效果分别达到95.24%和85.71%,第2次药后分别达到90.00%和80.00%。但随着病害的发展,第3次药后调查,对照的病情指数达到17.40时,4种杀菌剂对病害的防治效果均小于50%。

表3 5种杀菌剂对‘芽黄’红瑞木溃疡病菌Pestalotiopsis sp.的室内毒力测定
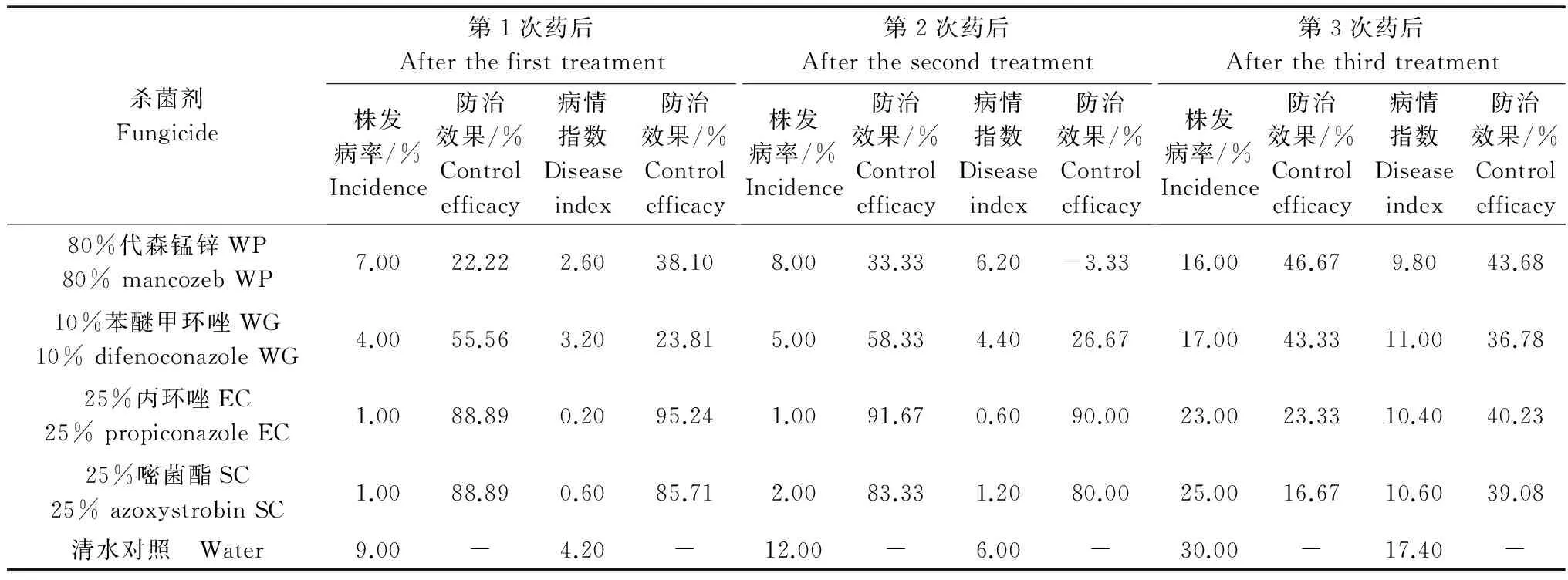
表4 4种杀菌剂对‘芽黄’红瑞木溃疡病的田间防治效果
3 讨论
拟盘多毛孢属Pestalotiopsis由Steyaert[9]1949年建立,但多年以来Guba[10]、Sutton[7]、Nag Raj[11]等分类系统对基于形态特征进行的该属及近似属的分类一直存在争议。近年来,根据Jeewon等[6]、韦继光等[12]基于分子系统发育对该属及近似属的研究,表明Sutton[7]的分类方法比较接近基于分子系统发育学所得到的分类结果。目前认为稳定的拟盘多毛孢属Pestalotiopsis具有以下形态特征[8]:分生孢子具有多根顶端附属丝,分生孢子 5个细胞, 顶端附属丝不分支或非二叉分支。本研究中“芽黄”红瑞木溃疡病菌符合上述形态特征,因此将其鉴定为拟盘多毛孢属Pestalotiopsissp.。
同时本研究采用rDNA-ITS序列分析并构建系统发育树的方法对菌株15SH-W2进行了分子生物学鉴定。对rDNA-ITS片段在GenBank数据库中的Blast同源比对结果表明菌株15SH-W2属于拟盘多毛孢属的一种,与形态学方法鉴定结果一致。但由于该属内rDNA-ITS片段种间相似度较高,仅凭rDNA-ITS难以将此菌株鉴定到种一级分类单元。在系统进化树中与菌株15SH-W2处于同一分支上有多个不同种类的拟盘多孢属菌株,表明这些菌株间遗传距离较近,同源性较高,相互之间难以区分。过去拟盘多毛孢属种内鉴定多以分生孢子大小和寄主为依据,致使全世界已报道拟盘多毛孢属内种多达241个,然而Jeewon等[6]、韦继光等[12]结合分子系统发育的研究结果,认为寄主完全不能作为拟盘多毛孢种内分类的依据,分生孢子大小也只能作为种内分类的次要依据。因此,当前拟盘多毛孢内的分类未能建立一个比较完善的分类检索体系, 仍然处于比较混乱的状态[8],将拟盘多毛孢鉴定到具体的种较为困难。
拟盘多毛孢属包含很多种植物病原真菌,同时,该属也是木本植物上一类重要的内生真菌。本研究Blast比对结果表明,具有与15SH-W2序列相似性最高的菌株,如KF718252.1、KF718250.1、EF451804.1、KF718249.1、JX436803.1、EF451799.1等均被报道为内生真菌。韦继光等[15]根据rDNA-ITS 序列建立的系统发育树结果表明, 同一种拟盘多毛孢不论其为内生性或是病原性的,均可聚在系统发育树的同一个分支下。本研究中,Blast比对结果显示引起‘芽黄’红瑞木溃疡病的Pestalotiopsissp.与部分内生性菌株相似性较高。韦继光等[15]认为某些拟盘多毛孢在不同(或相同)的植物中可以表现为内生状态或病原状态, 内生拟盘多毛孢在一定条件下可以转变为病原拟盘多毛孢,如茶拟盘多毛孢Pestalotiopsistheae是茶的病原真菌, 在金花茶枝叶和罗汉松枝上是内生真菌。因此,引起‘芽黄’红瑞木溃疡病的Pestalotiopsissp.是否在某些环境条件下,也可作为内生真菌存在于健康植株或其他植物中,也值得进一步研究。
红瑞木溃疡病在上海地区发生均较为普遍,造成植株部分枝条枯萎,甚至植株整株枯死。罗卿权等[16]对辰山植物园从国外引进的一种红瑞木品种Cornusalba‘Sphaethii’上溃疡病进行的病原菌鉴定结果表明,其由葡萄座腔菌Botryosphaeriadothidea引起。研究显示,在美国,山茱萸属植物Cornusspp.广泛受到山茱萸炭疽病(dogwood anthracnose)的危害,其病原菌被鉴定为Disculadestractiva[17],除危害叶片外,其也会引起茎秆上的黑色坏死斑。本研究中,上海迪士尼乐园中的‘芽黄’红瑞木由华北地区大量引种,引起其溃疡病的病原菌被鉴定为Pestalotiopsissp.。因此,在上海已鉴定的引起红瑞木溃疡病的病原菌至少存在2种,但这2种病原菌均分离自较小的种植区域,且2个种植区域所种植的红瑞木品种不同,引种来源地不同。因此在上海地区种植的红瑞木上引起溃疡病的主要病原菌是何种仍需进行大量的取样和分离才能确定。
尽管室内药剂筛选试验中的几种药剂均对病原菌有不同程度的抑制作用,然而室外药效试验对该病害的防控不尽如人意。在发病初期,25%丙环唑乳油和25%嘧菌酯悬浮剂防治效果可达80%以上,但当病害发展后,供试4种杀菌剂对病害的防治效果均小于50%。本研究未能找到一种能够有效控制该病害的杀菌剂。防治此病害应全面开展综合治理措施,如修剪发病枝条,尤其是结合冬季修剪降低病原基数,合理配置,增加通风透光条件,结合在发病之前或发病初期进行药剂预防或早期控制。
[1] 丘荣, 郭翎. 北京地区彩色植物的应用[J]. 北京园林,2014, 30(2): 34-39.
[2] 张天麟. 园林树木1600种[M]. 北京:中国建筑工业出版社, 2010:338.
[3] 方中达. 植病研究方法[M]. 第3版. 北京:中国农业出版社,1998:122-145.
[4] Nicholson P, Parry D W. Development and use of a PCR assay to detectRhizoctoniacerealis, the cause of sharp eyespot in wheat [J]. Plant Pathology, 1996,45(5): 872-883.
[5] Jeewon R, Liew E C Y, Simpson J A, et al. Phylogenetic significance of morphological characters in the taxonomy ofPestalotiopsisspecies[J]. Molecular Phylogenetics and Evolution, 2003, 27(3): 372-383.
[6] Jeewon R, Liew E C Y, Hyde K D. Phylogenetic relationships ofPestalotiopsisand allied genera inferred from ribosomal DNA sequences and morphological characters[J]. Molecular Phylogenetics and Evolution, 2002, 25 (3): 378-392.
[7] Sutton B C.The Coelomycetes, fungi imperfecti with pycnidia, acervuli and stromata[M]. Kew UK: Common Wealth Mycological Institute, 1980.
[8] 韦继光, 徐同, 潘秀湖, 等. 拟盘多毛孢属的分类学研究进展[J]. 广西农业生物科学,2006,25(1):78-85.
[9] Steyaert R L. Contribution à l′étude monographique dePestalotiade Not. etMonochaetiaSacc.(Truncatellagen. nov. etPestalotiopsisgen. nov.)[J]. Bulletin du Jardin Botanique de l’Etat, Bruxelles/Bulletin van den Rijksplantentuin, Brussel, 1949: 285-354.
[10]Guba E F. Monograph ofMonochaetiaandPestalotia[M]. Massachusetts, U. S. A.: Harvard University Press, 1961: 54-262.
[11]Nag Raj T R. Coelomycetous anamorphs with appendage-bearing conidia [M]. Waterloo, Ont ario, Canada: Mycologue Publications, 1993: 565-945.
[12]韦继光,徐同,郭良栋,等.从分子系统学的角度分析拟盘多毛孢属及其近缘属的界限[J].广西农业生物科学,2005,24(3):200-204.
[13]刘爱荣. 海南植物内生拟盘多毛孢的多样性及拟盘多毛孢属分子系统学研究[D]. 杭州:浙江大学, 2006.
[14]Jeewon R, Liew E C Y, Hyde K D. Phylogenetic evaluation of species nomenclature ofPestalotiopsisin relation to host association [J]. Fungal Diversity, 2004, 17(3):39-55.
[15]韦继光,徐同,黄伟华,等. 从分子系统发育探讨内生拟盘多毛孢与病原拟盘多毛孢的关系[J].浙江大学学报(农业与生命科学版),2008, 34(4):367-373.
[16]罗卿权, 徐颖, 刘美. 红瑞木溃疡病病原菌的鉴定[J]. 植物保护,2012, 38(4): 115-117.
[17]Daughtrey M L, Hibben C R. Dogwood anthracnose: a new disease threatens two nativeCornusspecies [J]. Annual Review of Phytopathology, 1994, 32(1):61-73.
(责任编辑:田 喆)
Pathogen identification and fungicide control of trunk canker ofCornusalba‘Bud’s Yellow’
Luo Qingquan1, Lu Guangliang1, Wang Feng1, Zhou Kun2, Liu Yajie2, Wu Shiying3, Ji Guohui3, Xu Ying1
(1. Shanghai Academy of Landscape Architecture Science and Planning, Shanghai 200232, China;2. Shanghai Shendi Garden Investment and Construction Co., Ltd., Shanghai 201205, China;3. Shanghai Pudong District Forest Station, Shanghai 201210, China)
Trunk canker is a severe disease ofCornusalba‘Bud’s Yellow’ in Shanghai. The causal pathogen was identified asPestalotiopsissp. through isolation, pathogenicity determination and morphological identification. Phylogenetic analysis based on the comparison of rDNA-ITS sequences showed that this pathogen belonged to the clade possessing versicolorous median cells, which was consistent with the morphological result. The half maximal effective concentrations (EC50) of five fungicides were 0.639-1.787 μg/mL. Field trials showed that the control efficacy of 25% propiconazole emulsifiable concentrate and 25% azoxystrobin suspension were above 80% in early stage of the disease, while the control efficacies of all the four fungicides were less than 50% in the following stage of disease development.
Cornusalba‘Bud’s Yellow’; trunk canker;Pestalotiopsissp.; sensitivity determination; field trial
2016-05-24
2016-07-28
上海市浦东新区环保市容局科研项目
S 763.7
A
10.3969/j.issn.0529-1542.2017.03.021
* 通信作者 E-mail: xuying20002@163.com
