WRKY转录因子在烟草受CMV侵染和激素处理中的表达模式初步分析
2017-06-05张鼎宇丁永强陈德鑫王凤龙焦芳婵曾庆宾王文静
张 洁, 张鼎宇, 丁永强, 陈德鑫, 王 静,冯 超, 王凤龙, 焦芳婵, 曾庆宾, 王文静*
(1. 中国农业科学院烟草研究所烟草行业烟草病虫害监测与综合治理重点实验室, 青岛 266101; 2. 云南省烟草农业科学研究院, 昆明 650021; 3. 四川省烟草公司攀枝花市公司, 攀枝花 617026)
WRKY转录因子在烟草受CMV侵染和激素处理中的表达模式初步分析
张 洁1, 张鼎宇1, 丁永强1, 陈德鑫1, 王 静1,冯 超1, 王凤龙1, 焦芳婵2, 曾庆宾3, 王文静1*
(1. 中国农业科学院烟草研究所烟草行业烟草病虫害监测与综合治理重点实验室, 青岛 266101; 2. 云南省烟草农业科学研究院, 昆明 650021; 3. 四川省烟草公司攀枝花市公司, 攀枝花 617026)
WRKY转录因子在调控植物抵抗病原菌的侵染中发挥重要作用,但是,目前为止还没有WRKY转录因子在烟草抗CMV中调控机理的研究。本研究检测了感病品种‘K326’和抗病品种‘TT8’在接种CMV后其WRKY1、WRKY2、WRKY4和WRKY11的表达情况。结果显示,CMV侵染后‘TT8’中4个WRKY转录因子表达量均有大幅上升;而‘K326’中WRKY2、WRKY4和WRKY11的表达量与CMV侵染前无显著差异,WRKY1表达量则大幅下降。幼苗经外源激素(水杨酸、茉莉素、乙烯)处理后用RT-PCR检测,结果表明,‘K326’和‘TT8’中WRKY转录因子对外源激素的诱导响应比较复杂多样,但总体表现为在‘TT8’中WRKY1、WRKY2和WRKY4会受到乙烯和茉莉酸的诱导,但在‘K326’中转录因子的表达未受明显诱导。
烟草; 黄瓜花叶病毒(CMV); WRKY转录因子; 水杨酸; 茉莉酸; 乙烯
黄瓜花叶病毒Cucumbermosaicvirus(CMV)是寄主范围最多、分布最广、最具经济重要性的植物病毒之一[1-2],给农业生产带来巨大损失。该病毒引起的病害是烟草生产中危害最大的病毒病之一,不仅使烟草叶片畸形、黄化、花叶,而且使烟草植株矮化,极大地影响了烟叶的产量和品质。因此,研究烟草抗CMV相关基因,揭示其抗病毒机理,对烟草和其他重要作物的CMV防治都有重要意义。
WRKY转录因子在植物应答逆境胁迫中发挥重要作用[3-4],尤其在植物抗病调控中的作用机理研究是近几年植物学研究的热点内容。WRKY转录因子通常含有1~2个 WRKY结构域,包括WRKYGQK序列和一个类锌指结构域,其调控通过结合含有W-box顺式作用元件的防御基因来实现[5-6]。在很多植物中,WRKY基因的表达可以被生物和非生物胁迫强烈并快速诱导。拟南芥中有74个WRKY成员,其中的49个WRKY转录因子都可以被病原菌或者激素诱导,这些过程与激素信号的传导有着密不可分的关系[4]。WRKY转录因子参与的激素信号途径主要有茉莉酸(jasmonate,JA)、水杨酸(salicylic acid,SA)、乙烯(ethylene,ET)三种通路[7]。虽然WRKY转录因子在植物抗病中的机理研究有很多报道,但还没有关于WRKY转录因子调控烟草对CMV抗性机理的研究报道。
‘台烟8号’(‘TT8’)是台湾烟草育种家使用烟草花叶病(TMV)抗性材料‘Holmes抗性系’做亲本育成的CMV抗性品种[8]。‘K326’是一个耐肥性、香气品质和加工品质较好的烤烟品种,但抗病性较差,在田间易于感染CMV发生花叶病,影响品质和产量形成[9]。对‘K326’进行抗病性改良是提高其产量和品质的关键手段。
本研究采用CMV接种烟草感病品种‘K326’和抗病品种‘TT8’,并检测接种后WRKY家族中的转录因子WRKY1、WRKY2、WRKY4和WRKY11在这两个品种中的表达情况。另外,利用水杨酸、茉莉酸、乙烯对‘K326’和‘TT8’幼苗进行处理,分析上述4个转录因子的表达情况。这些研究结果可为解析WRKY转录因子调控烟草抗CMV的分子机制提供参考,同时对揭示烟草不同抗性品种抗性差异的分子基础有重要作用。
1 材料与方法
1.1 试验材料
烟草感病品种‘K326’(Nicotianatabacum‘K326’),烟草抗病品种‘台烟8号’(N.tabacum‘TT8’,Taiwan tobacco No. 8)。
1.2 CMV的接种
在‘K326’和‘TT8’的6周龄期接种CMV,每个品种接种5株,3次重复:(1)将1 g感染CMV病毒的发病烟草叶片放在研钵中加入20 mL PBS缓冲液和细颗粒石英砂研磨至溶液变为悬浊液;(2)用纱布蘸取病毒悬浊液(蘸上少许石英砂)在植株叶片上轻轻摩擦,至划出轻微伤口;(3)在植株上盖上保鲜膜,放在光周期为L∥D=14 h∥10 h的试验温室,于25℃条件下培养;(4)待烟草植株发病后(接种后3周),分别取‘K326’和‘TT8’的病叶以液氮速冻后立即贮存于-80℃超低温冰箱备用。取接种前‘K326’和‘TT8’的完好叶片(0 d)作为对照。
1.3 抗感材料植株的激素处理
将烟草‘K326’和‘TT8’的种子在培养基中萌发,在长出真叶后分别转入营养土中培养,每个品种选取长势相近的5株烟草作为试验对象。待长出6片叶后,在相同叶位的叶片分别喷施1 mmol/L的水杨酸、50 μmol/L的茉莉酸和50 μmol/L的乙烯。每种处理设3个生物学重复,每个重复设5个单株。取样时间为处理后0、6、24 h。所取样品以液氮速冻后立即贮存于-80℃超低温冰箱备用。
1.4 cDNA的合成
采用Invitrogen 公司的Trizol试剂提取所有上述烟草样品总RNA,琼脂糖凝胶电泳检测RNA提取质量,并使用宝生物工程有限公司的PrimeScript RT Master Mix试剂盒进行反转录反应合成cDNA。取5 μg 叶片总RNA与反转录引物oligo(dT)20于65℃变性退火后,加入反转录试剂,置于PCR扩增仪内于42℃反转录1.5 h,随后85℃灭活5 min。
1.5 荧光定量PCR反应条件的优化
将反转录所得的cDNA稀释到100 μL,采用Promega生物技术有限公司的试剂盒,对实时荧光定量PCR引物与探针的浓度及退火温度进行优化,确立最佳反应体系。 25 μL反应体系包括:Master mix 12.5 μL;cDNA 0.5 μL;H2O 11 μL;上游引物 0.5 μL,下游引物0.5 μL。扩增条件为:95℃预变性2 min,50个扩增循环(94℃,20 s;58℃,20 s;72℃,30 s),PCR结束后测定熔解曲线。研究样品的荧光定量PCR扩增在iQ5 型荧光定量PCR仪(BIO-RAD, USA)上完成,以烟草Actin基因作为内参。以最小样本阈值循环数(Ct值)为标准获得所有扩增样本的Ct值,以各基因在对照处理‘K326’中的相对表达量为参照,用公式2-ΔΔCt方法计算出各基因在每种处理条件下的相对表达量。 最后,利用各基因在每种处理的3个重复试验样本中的相对表达量为基础,通过Excel软件计算其相对表达量的标准偏差。
本研究所用的WRKY1、WRKY2、WRKY4和WRKY11等4个基因的特异性引物如表1。
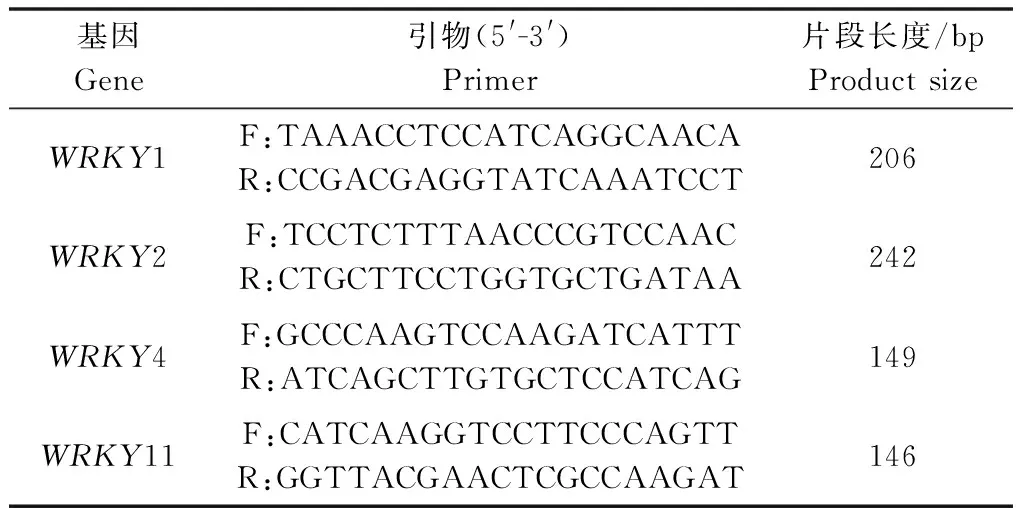
表1 试验所用特异性引物
2 结果与分析
2.1 转录因子WRKY1、WRKY2、WRKY4和WRKY11在感染CMV的‘K326’和‘TT8’中的表达情况
本研究以烟草感病品种‘K326’和抗病品种‘TT8’作为研究对象,在接种CMV后,通过定量PCR分析了WRKY类转录因子WRKY1、WRKY2、WRKY4和WRKY11的品种间表达差异。结果表明,‘TT8’中4个WRKY转录因子的表达量在CMV侵染后都有不同程度的上升,其中WRKY2、WRKY4和WRKY11的相对表达量超过对照的6倍,而WRKY1的相对表达量约为对照的2.5倍。在‘K326’中情况则相反:WRKY2、WRKY4和WRKY11在CMV侵染前后表达量无显著差异,WRKY1在CMV侵染后表达量大幅下降(图1)。该结果说明在‘TT8’中WRKY转录因子的表达受到CMV的诱导,相比之下,‘K326’的抗性与WRKY2、WRKY4和WRKY11的表达量关系较弱。

图1 CMV侵染后‘K326’和‘TT8’中WRKY基因的表达变化Fig.1 Expression levels of WRKY genes in ‘K326’ and ‘TT8’ infected by CMV
2.2 经SA、JA和ET处理后‘K326’和‘TT8’中转录因子WRKY1、WRKY2、WRKY4和WRKY11的表达情况
植物激素SA、JA和ET在调控植物抗病过程中发挥着重要作用,本研究分析了经这3种激素处理后‘K326’和‘TT8’中WRKY类转录因子的表达差异。
SA处理感病品种‘K326’后,对4个WRKY转录因子的表达有强烈的抑制作用。而在抗病品种‘TT8’中,情况则比较多变:WYKY1和WYKY11表达量受到强烈抑制,WYKY2的表达量变化不大,但是WRKY4受到SA的强烈诱导,表达量在接种24 h后大幅升高,超过对照的3倍(图2)。
在JA处理后,WRKY转录因子的表达量在两个品种中表现较一致,均有不同程度的增加。其中,WRKY2和WRKY11在处理后6 h时最高;WRKY4表达量在‘TT8’中达到峰值时间点为处理后6 h,‘K326’中为24 h;4个WRKY转录因子在‘TT8’中的表达量均高于‘K326’。这些结果表明WRKY转录因子能够响应JA途径,受JA正调控,且在抗病品种‘TT8’中响应更加强烈(图3)。
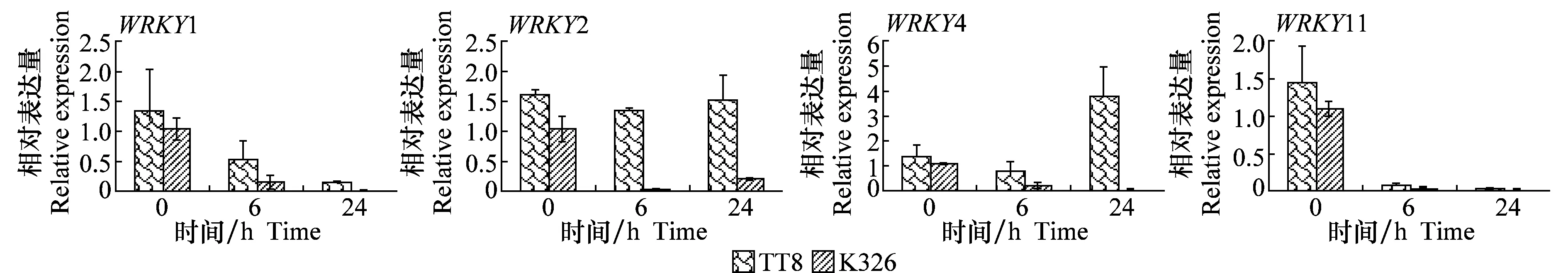
图2 SA处理后 ‘K326’和‘TT8’ 中WRKY基因的表达变化Fig.2 Expression levels of WRKY genes in ‘K326’ and ‘TT8’ treated by SA

图3 JA处理后 ‘K326’和‘TT8’中WRKY基因的表达变化Fig.3 Expression levels of WRKY genes in ‘K326’ and ‘TT8’ treated by JA
在ET处理后,‘TT8’中的WRKY1、WRKY2、WRKY4表达量均有所增加,并在处理后6 h时到达峰值。‘K326’中WRKY1表达量无明显差异,WRKY2有轻微增加,WRKY4在处理后6 h时显著下降,24 h时回升,并且这些转录因子在‘K326’中表达量整体低于‘TT8’中。此外,WRKY11的表达水平在ET处理后的两种材料中都明显下降,在‘TT8’中下降幅度更大,仅为对照的10%左右(图4)。
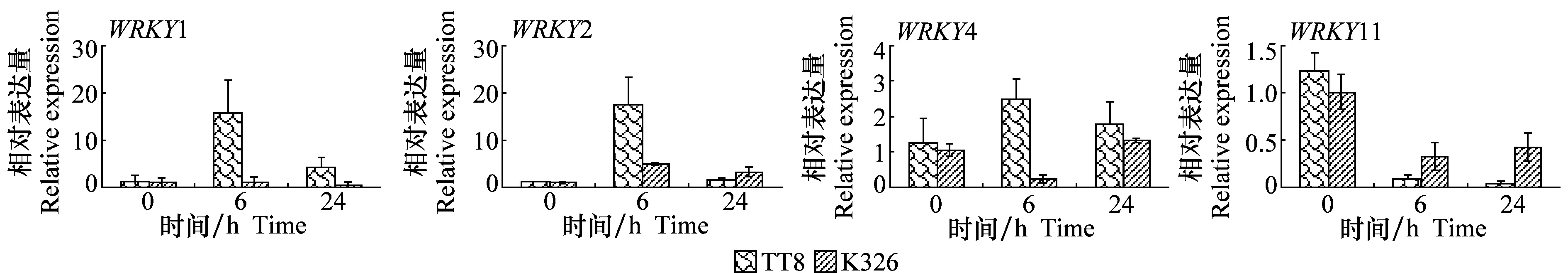
图4 ET处理后 ‘K326’和‘TT8’ 中WRKY基因的表达变化Fig.4 Expression levels of WRKY genes in ‘K326’ and ‘TT8’ treated by ET
3 讨论
植物对病害的抗性很大程度依赖于抗病基因的表达和转录因子的调控作用。WRKY转录因子是植物中最大的转录家族之一,在植物抵御病原体的侵染中发挥重要作用[10]。本研究对CMV侵染烟草感病品种‘K326’和抗病品种‘TT8’后WRKY家族4个转录因子的表达情况进行了初步分析,以期为揭示WRKY转录因子调控烟草CMV抗性的分子机制奠定基础。分析结果显示,CMV侵染后‘TT8’中4个WRKY转录因子表达量均有大幅上升;而在‘K326’中情况则完全不同,CMV侵染‘K326’后,WRKY2、WRKY4和WRKY11的表达量与侵染前无明显差异,而WRKY1在CMV侵染后表达量大幅下降。该研究结果与烟草品种的感病性和抗病性一致,即受CMV侵染后,抗性品种‘TT8’中WRKY转录因子表达量增加,使烟草表现抗病性;而感病品种‘K326’中WRKY转录因子表达量下降,使烟草表现感病性。该研究结果表明WRKY转录因子在烟草中可能参与抵抗CMV侵染,推测该转录因子是导致烟草感病品种‘K326’和抗病品种‘TT8’抗性差异的原因之一。
以往研究表明,WRKY转录因子在植物对病害的抗性中既可作为正调控因子,又可作为负调控因子[11-13]。另外,在拟南芥WRKY70的诱导表达特性研究中发现,AtWRKY70可以被SA诱导表达,但同时又受到JA的抑制[14]。在烟草中,WRKY4也被SA明显诱导,并且在受TMV侵染后,WRKY4的RI(转基因沉默)植株相对于空载体对照植株叶片表现出更明显的发病症状[15]。但是,有研究表明WRKY4在拟南芥中对丁香假单胞菌Pseudomonassyringae的抗性却呈现出负相关[16-17]。有研究结果表明,WRKY转录因子在调控植物的抗病过程中,它们的诱导表达非常复杂,参与多种信号途径的传导,受到不同激素的诱导表达[18]。本研究检测了WRKY家族的4个转录因子在经JA、ET和SA处理后的‘K326’和‘TT8’中表达水平的变化。在CMV敏感品种‘K326’中,除WRKY11受JA诱导外,这4个WRKY转录因子基因的表达对激素处理并不敏感。而在CMV抗性品种‘TT8’中,这4个WRKY转录因子基因均被JA诱导,同时,ET可诱导WRKY1、WRKY2和WRKY4表达,但抑制WRKY11表达;SA处理诱导WRKY4表达量急剧上升,但引起WRKY1和WRKY11表达量的下降。
植物的病毒抗性应答与JA、ET和SA等多种激素调控相关,其中,SA和ET是病毒抗性应答最重要的调控激素[19-20]。在‘TT8’烟草中,受ET和SA诱导表达的WRKY转录因子基因可能是其CMV抗性形成的重要调控因子,特别是被两者共同诱导表达的WRKY4基因。此外,本研究还发现,‘TT8’烟草的WRKY11基因受到ET和SA的共同抑制,可能是CMV抗性形成的一个重要负调控因子。这些研究结果揭示了烟草WRKY转录因子基因应答激素处理时在不同CMV抗性品种间的变化复杂性,同时,为解析WRKY转录因子参与植物激素信号途径调控病害抗性的分子机理提供了重要线索,对揭示烟草的CMV抗性形成机理有重要意义。
[1] Palukaitis P, García-Arenal F. Cucumoviruses [J]. Advances in Virus Research, 2003, 62(4): 241-323.
[2] 徐平东, 周仲驹, 林奇英, 等. 黄瓜花叶病毒亚组Ⅰ和Ⅱ分离物外壳蛋白基因的序列分析与比较[J]. 病毒学报, 1996,15: 164-171.
[3] Dong Jixin, Chen Chunhong, Chen Zhixiang. Expression profiles of theArabidopsisWRKY gene superfamily during plant defense response [J]. Plant Molecular Biology, 2003, 51(1): 21-37.
[4] Kalde M, Barth M, Somssich I E, et al. Members of theArabidopsisWRKY group III transcription factors are part of different plant defense signaling pathways [J]. Molecular Plant-Microbe Interactions, 2003, 16(4): 295-305.
[5] Rushton P J, Somssich I E, Ringler P, et al. WRKY transcription factors [J]. Trends in Plant Science, 2010, 15(5): 247-258.
[6] Eulgem T, Rushton P J, Robatzek S, et al. The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science, 2000, 5(5): 199-206.
[7] Thomma B P, Eggermont K, Tierens K F, et al. Requirement of functional ethylene-insensitive 2 gene for efficient resistance ofArabidopsisto infection byBotrytiscinerea[J].Plant Physiology, 1999, 121(4):1093-1102.
[8] 王秀. 台湾烟草生产概况与品种改良成果[J]. 台湾农业情况, 1992(3): 26-27.
[9] 代帅帅,任民,蒋彩虹,等.烟草骨干亲本主要病毒病抗性鉴定及遗传多样性分析[J].中国烟草科学,2015(6):1228-1239.
[10]Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling [J]. Current Opinion in Plant Biology, 2007,10(4): 366-371.
[11]Yu Feifei, Huaxia Yifeng, Lu Wenjing, et al.GhWRKY15, a member of the WRKY transcription factor family identified from cotton (GossypiumhirsutumL.), is involved in disease resistance and plant development [J]. BMC Plant Biology, 2012, 12: 144.
[12]Xie Zhen, Zhang Zhonglin, Zou Xiaolu, et al. Annotations and functional analyses of the rice WRKY gene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells [J]. Plant Physiology, 2005, 137(1): 176-189.
[13]Oh S K, Baek K H, Park J M, et al.CapsicumannuumWRKY protein CaWRKY1 is a negative regulator of pathogen defense [J]. New Phytologist, 2008, 177(4): 977-989.
[14]Li Jing, Brader G, Palva E T.The WRKY70 transcription factor: a node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense [J]. Plant Cell, 2004, 16(2): 319-331.
[15]Ren X J, Huang W D, Li W Z, et al. Tobacco transcription factor WRKY4 is a modulator of leaf development and disease resistance [J]. Biologia Plantarum, 2010, 54(4): 684-690.
[16]Lai Zhibing, Vinod K M, Zheng Zuyu, et al. Roles ofArabidopsisWRKY3 and WRKY4 transcription factors in plant responses to pathogens [J]. BMC Plant Biology, 2008, 8: 68.
[17]Liu B, Hong Y B, Zhang Y F, et al. Tomato WRKY transcriptional factor SlDRW1 is required for disease resistance againstBotrytiscinereaand tolerance to oxidative stress[J]. Plant Science, 2014, 227: 145-156.
[18]Chen Ligang, Zhang Liping, Li Daibo, et al. WRKY8 transcription factor functions in the TMV-cg defense response by mediating both abscisic acid and ethylene signaling inArabidopsis[J]. The Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21): 1963-1971.
[19]Carr J P, Lewsey M G, Palukaitis P.Signaling in induced resistance [J].Advances in Virus Research, 2010, 76: 57-121.
[20]Alazem M, Lin N S. Roles of plant hormones in the regulation of host-virus interactions[J]. Molecular Plant Pathology, 2015, 16(5): 529-540.
(责任编辑:田 喆)
Expression patterns of WRKY transcription factor genes in tobacco plantsupon CMV infection and phytohormone treatment
Zhang Jie1, Zhang Dingyu1, Ding Yongqiang1, Chen Dexin1, Wang Jing1, Feng Chao1,Wang Fenglong1, Jiao Fangchan2, Zeng Qingbin3, Wang Wenjing1
(1. Key Laboratory of Tobacco Pest Monitoring, Controlling & Integrated Management, TobaccoResearch Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China;2. Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650021, China; 3. PanzhihuaBranch, Sichuan Tobacco Company, Panzhihua 617026, China)
WRKY transcription factors play an important role in the regulation of plant resistance to pathogens. However, there is no report on the mechanism of WRKY transcription factors regulating the resistance of tobacco CMV (Cucumbermosaicvirus). In the present study, the expression patterns of WRKY transcription factor genesWRKY11,WRKY2,WRKY4 andWRKY1 were analyzed between tobacco varieties ‘K326’ (a CMV susceptible variety) and TT8 (a CMV resistant variety). The results showed that the expression levels of WRKY genes were significantly increased in ‘TT8’ after CMV infection, while their expression in ‘K326’ was tremendously different. The expression ofWRKY2,WRKY4 andWRKY11 were not induced and that ofWRKY1 was strikingly decreased in ‘K326’. The transcription patterns of these WRKY transcription factor genes were consistent with the CVM resistance of ‘TT8’ and ‘K326’, as ‘TT8’ and ‘K326’ are resistant and susceptible to CMV, respectively. Exogenous application of phytohormone salicylic acid, jasmonate and ethylene resulted in a complicated transcription pattern of WRKY transcription factor genes in tobacco varieties ‘K326’ and ‘TT8’. Meanwhile, the observations suggested that the overall expression levels ofWRKY1,WRKY2 andWRKY4 in ‘TT8’ were induced by phytohormone salicylic acid, jasmonate and ethylene in ‘TT8’, but no obvious induction was observed in ‘K326’. The results of this study are valuable for revealing the roles of WRKY transcription factors in regulating tobacco resistance to CMV, and are helpful for investigating the molecular basis of CVM resistance between the tobacco varieties ‘K326’ and ‘TT8’.
tobacco; CMV; WRKY transcription factor; salicylic acid; jasmonate; ethylene
2016-06-30
2016-09-07
中国农业科学院科技创新工程(ASTIP-TRIC04);云南省烟草公司科技项目(2015YN01);中国烟草总公司四川省公司项目(SCYC201604)
S 435.72
A
10.3969/j.issn.0529-1542.2017.03.009
* 通信作者 E-mail:wangwenjing@caas.cn
