5,10-亚甲基四氢叶酸还原酶C677T基因多态性与不明原因复发性流产相关性的Meta分析
2017-06-05王韦韦张宏秀
张 丹 王韦韦 张宏秀*
1.南京医科大学第一附属医院妇产科(210029); 2.江苏省昆山市淀山湖人民医院妇产科
·专题研究·
5,10-亚甲基四氢叶酸还原酶C677T基因多态性与不明原因复发性流产相关性的Meta分析
张 丹1,2王韦韦1张宏秀1*
1.南京医科大学第一附属医院妇产科(210029); 2.江苏省昆山市淀山湖人民医院妇产科
目的:评价5,10- 亚甲基四氢叶酸还原酶(MTHFR)C667T 基因多态性与不明原因复发性流产(URSA)的相关性。方法: 在PubMed数据库、中国知网数据库(CNKI)、万方数据库、中国生物医学文献数据库(CBM)和维普中文期刊全文(VIP)数据库中全面检索关于 MTHFR C667T 基因多态性与URSA相关的文献,按照既定的筛选标准进行筛选,对纳入的文献进行质量评价,并采用RevMan5.3软件进行meta分析。结果: 共有 31 篇文献被纳入本次的 meta 分析,累计病例组3706人,对照组3937人。meta分析结果显示MTHFR C677T基因多态性与URSA的发生呈相关性T/C:OR=1.41,95%CI1.23~1.61,P<0.05;CT/CC:OR=1.23,95%CI1.03~1.47,P<0.05;(TT+CT)/CC:OR=1.45,95%CI1.21~1.74,P<0.05;TT/CC:OR=1.98,95%CI1.51~2.59,P<0.05)。病例组与对照组有统计学差异(P<0.05)。在亚组分析中发现,国内人群中基因型为TT的女性发生URSA的风险较基因型为CC的女性高3.56倍,基因型TT和等位基因T是URSA的遗传性风险因素TT/CC:OR=3.56,95%CI2.71~4.69,P<0.05;T/C:OR=1.88,95%CI1.66~2.13,P<0.05;CT/CC:OR=1.67,95%CI1.36~2.04,P<0.05;(TT+CT)/CC:OR=2.07,95%CI1.71~2.50,P<0.05,病例组与对照组的差异均有统计学意义(P<0.05),但在国外人群中,包括亚洲其他国家人群中,各基因型分布URSA病例组与正常对照组差异并无统计学意义(P>0.05)。结论: MTHFR C667T基因多态性与URSA呈相关性,在中国人群中MTHFR C667T基因多态性是URSA的遗传性高风险因素,但在国外人群中包括亚洲其他国家中并未显示相关性,仍有待加大样本进一步论证。
5,10-亚甲基四氢叶酸还原酶;基因多态性;不明原因复发性流产;Meta分析
复发性自然流产(RSA)是指与同一配偶连续发生≥2次自然流产者,其发生率为1%~2%[1]。导致 RSA 的病因复杂,主要包括胚胎染色体异常、生殖器官解剖异常、遗传性疾病、内分泌因素、免疫紊乱、营养不良、感染、全身性疾病及环境因素等。临床上除以上因素外仍有 40% ~55% 的复发性流产原因不明,称为不明原因复发性流产(URSA)[2]。近年研究表明,血栓形成倾向即易栓症与RSA发生有关[3-4]。易栓症的发病原因分为获得性和遗传性两类,其中获得性因素中如抗心磷脂抗体已被确定是URSA的致病因素之一[5]。而在遗传因素方面,遗传性因素所致的凝血功能异常增强和纤溶功能的降低与凝血因子基因多态性所致的蛋白表达异常有关。目前研究较多的几种易栓症的基因多态性包括凝血因子V基因G1691A、5,10-亚甲基四氢叶酸还原酶(MTHFR) C677T多态性、凝血酶原G20210A多态性。其中凝血因子V基因G1691A和凝血酶原G20210A多态性主要发生在欧洲的白种人中,其他种族少见,汪希鹏和许丽娜等[6-7]的相关研究亦表明在我国人群中罕见。现今,国内外针对MTHFR C667T基因多态性与URSA的相关性进行了大量的研究,然结果却不尽相同。因此,本研究主要通过对MTHFR C667T基因多态性与URSA相关性的中英文文献进行收集系统分析,进而对MTHFR C667T与URSA之间的关联进行评价,为URSA的遗传学病因提供科学依据。
1 资料与方法
1.1资料收集方法
1.1.1 文献纳入标准 ①研究设计为病例对照研究;②研究中所包含的 URSA患者与健康个体均来自统一总体,年龄、民族、生活习惯等基本资料均严格匹配,均衡可比;③文献中明确URSA的定义,病例组人群应为排除其他临床上可查的致流产因素,连续自然流产≥2次流产个体;④对照组人群应至少有≥1次成功妊娠史且无不良孕产史的妇女,通过辅助受孕者除外,MTHFRC667T 各基因型频率分布应符合Hardy-Weinberg遗传平衡定律;⑤文献中应分别列出病例组和对照组中各基因型分布(即CC、CT、TT)个体的例数或通过给出的各基因型频率可计算出相应的人数;⑥重复发表或重叠文献选择数据最完整、质量最好的。
1.1.2 文献排除标准 ①研究设计非病例对照研究;②病例组未排除临床可致流产因素;③文献中基因型频率及等位基因频率的数据不完整或描述不清。
1.2 检索策略
使用计算机在PubMed数据库、中国知网数据库、万方数据库、中国生物医学文献数据库和维普中文期刊全文数据库中检索2015年12月以前国内外发表的关于MTHFR基因多态性与流产关系的病例对照研究文献并获取全文, 文献包括期刊和博士硕士论文及会议、报纸文献,并对文章的参考文献也进行了人工检索。前者主要用于检索国外发表的英文文献,而后三者则用于检索中文相关文献。英文检索式为“[(recurrent abortion) or (recurrent spontaneous abortion) or (repeating abortion)] 和mthfr”,中文检索主题词为“流产and MTHFR”。
1.3 数据提取及质量评价
通过阅读文献的标题和摘要进行初筛,而后阅读全文进行二次筛查,最终根据纳入标准确定符合条件的文献,整理每篇纳入文献提取相关数据:第一作者姓名、出版年限、国家、病例组和对照组的基因型例数。使用病例对照研究的Newcastle-Ottawa Scale(NOS)量表评价所纳入文献的质量,其包括研究对象选择、组间可比性和暴露因素测量3个方面,评价标准满分为9分,0~4分为低质量,5~9分为高质量。
1.4 统计学处理
使用RevMan 5.3软件进行数据分析,并完成相关图表的绘制。首先使用Q检验和I2对所纳入的文献进行异质性检验,当P<0.05时证明各研究之间存在异质性,则使用随机效应模型,反之则使用固定效应模型。为了寻找潜在的异质性来源,主要对种族和研究对象分别进行了亚组分析。为了评估合并结果的稳定性,通过每次去除一个病例对照研究后再重新统计的方法对meta分析结果进行敏感性分析。采用Begg漏斗图评估潜在的发表偏倚,最后利用RevMan5.3软件的森林图显示meta分析的结果。对分析P<0.05为有统计学意义。
2 结果
2.1 纳入文献的基本特征
通过计算机共检索出310篇相关的文献,其中PubMed检索出132篇,中国知网检索出62篇,万方数据库检索出50篇,中国生物医学文献数据库检索出45篇,维普中文期刊全文数据库检索出21篇。根据文献的纳入和排除标准,最终将31篇文献纳入此次的meta分析中(表1),共累计病例组3706人,对照组3937人。其中国外文献19篇,病例组2563人,对照组2831人;中文文献12篇,病例组1143人,对照组1106人。研究对象分别来自于德国、巴西、英国、爱尔兰、韩国、日本、印度、伊朗、以色列、奥地利、埃及、中国。所有纳入文献均按照NOS量表评价,均高于5分属高质量文献。
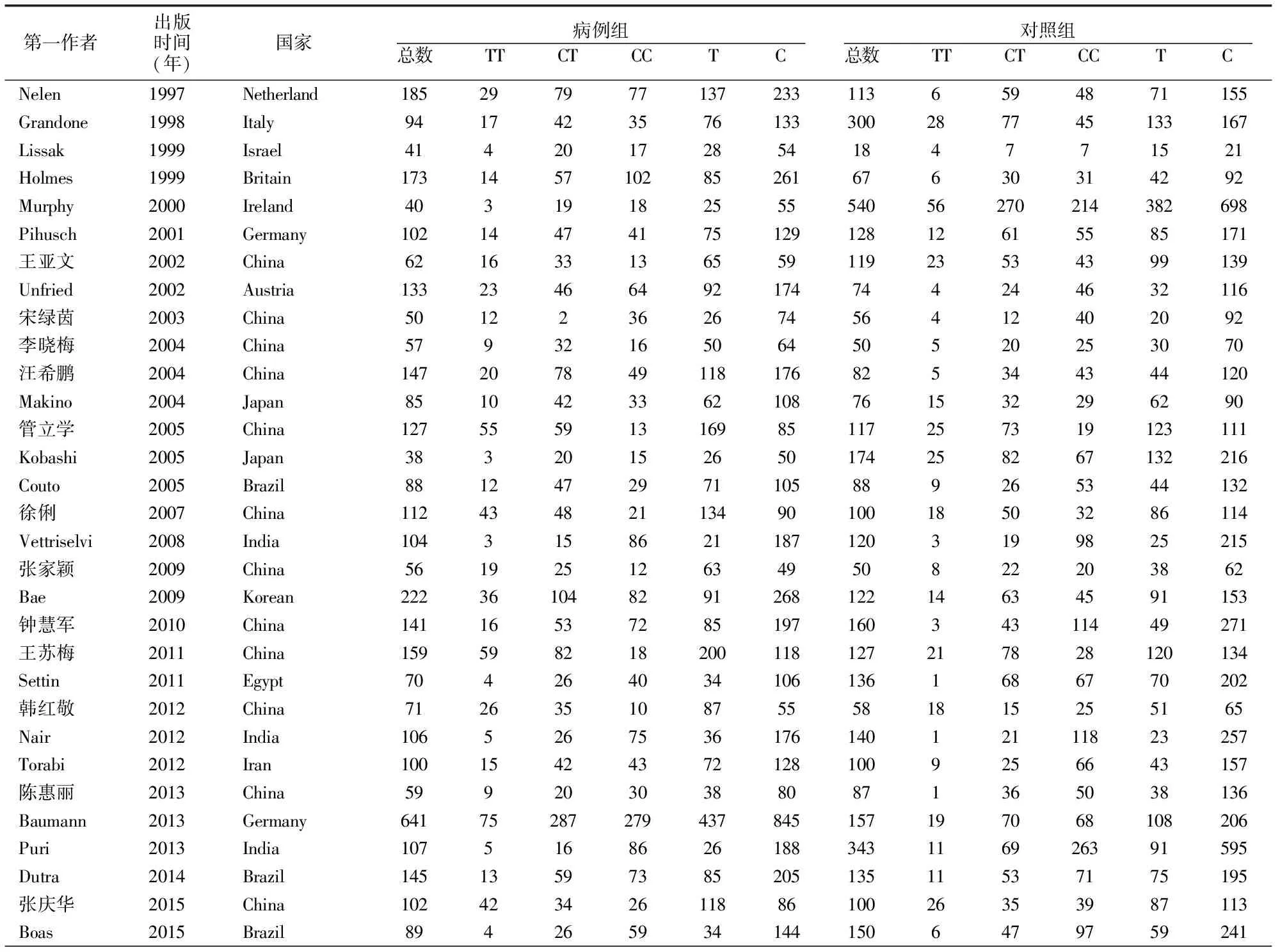
表1 纳入文献一般特征(例)
2.2 meta分析结果
2.2.1 MHTFR C677T基因多态性与URSA关系 因存在异质性,故数据分析采用随机效应模型。meta分析显示:MTHFR C677T中等位基因T可能会增加发生URSA的风险,其中基因型为TT的女性发生URSA的风险是基因型CC女性的1.98倍(图1)。T/C:OR=1.41,95%CI1.23~1.61,P<0.05;CT/CC:OR=1.23,95%CI1.03~1.47,P<0.05;(TT+CT)/CC:OR=1.45,95%CI1.21~1.74,P<0.05;TT/CC:OR=1.98,95%CI1.51~2.59,P<0.05。病例组与对照组的差异均有统计学意义(P<0.05)。
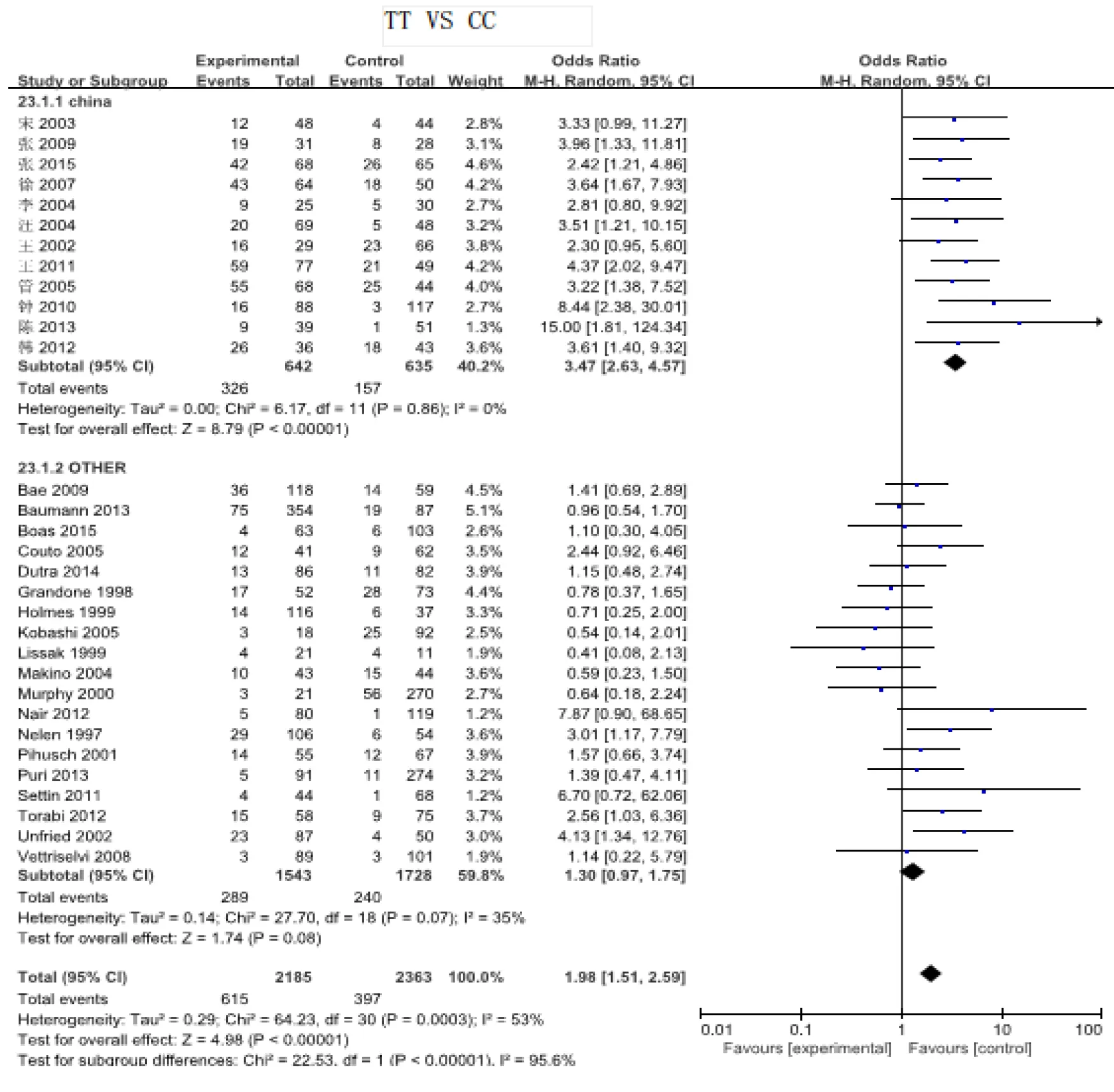
图1 MHTFR基因型TT与URSA相关性meta分析森林图
2.2.2 国内外人群亚组分析 分别对国内和国外人群进行亚组分析,同时对国内人群和其他亚洲国家人群进行亚组分析。经异质性检验,在T/C、CT/CC、(TT+CT)/CC、TT/CC 4组数据中,国内各独立研究中并未发现异质性,数据分析采用固定效应模式。结果显示基因型为TT的女性其发生URSA的风险较基因型为CC的女性高3.56倍(TT/CC:OR=3.56,95%CI:2.71~4.69,P<0.05),等位基因T的频率与URSA的发生呈相关性(图2)。T/C:OR=1.88,95%CI1.66~2.13,P<0.05;CT/CC:OR=1.67,95%CI1.36~2.04,P<0.05;(TT+CT)/CC:OR=2.07,95%CI1.71~2.50,P<0.05,病例组与对照组的差异均有统计学意义(P<0.05)。
对国外各独立研究中发现T/C、(TT+CT)/CC、CT/CC、TT/CC 4组数据均存在异质性,数据分析采用随机效应模式。结果显示各基因型的分布在URSA病例组与正常对照组的差异并无统计学意义(P>0.05)。T/C:OR=1.18,95%CI0.99~1.40,P>0.05;CT/CC:OR=1.05,95%CI0.86~1.27,P>0.05;(TT+CT)/CC:OR=1.19,95%CI0.96~1.49,P>0.05;TT/CCOR=1.30,95%CI:0.97~1.75,P>0.05。对8篇纳入文献中亚洲国家人群进行了亚组分析,研究对象来自于韩国、日本、印度、伊朗、以色列,其中病例组803人,对照组1093人,经异质性检验,各组均存在异质性,数据分析采用随机效应模式。结果显示各基因型的分布在URSA病例组与正常对照组的差异并无统计学意义(P>0.05)(图3)。T/C:OR=1.02,95%CI0.71~1.48,P>0.05;CT/CC:OR=1.19,95%CI0.86~1.65,P>0.05;(TT+CT)/CC:OR=1.20,95%CI0.86~1.66,P>0.05;TT/CC:OR=1.20,95%CI0.86~1.66,P>0.05。
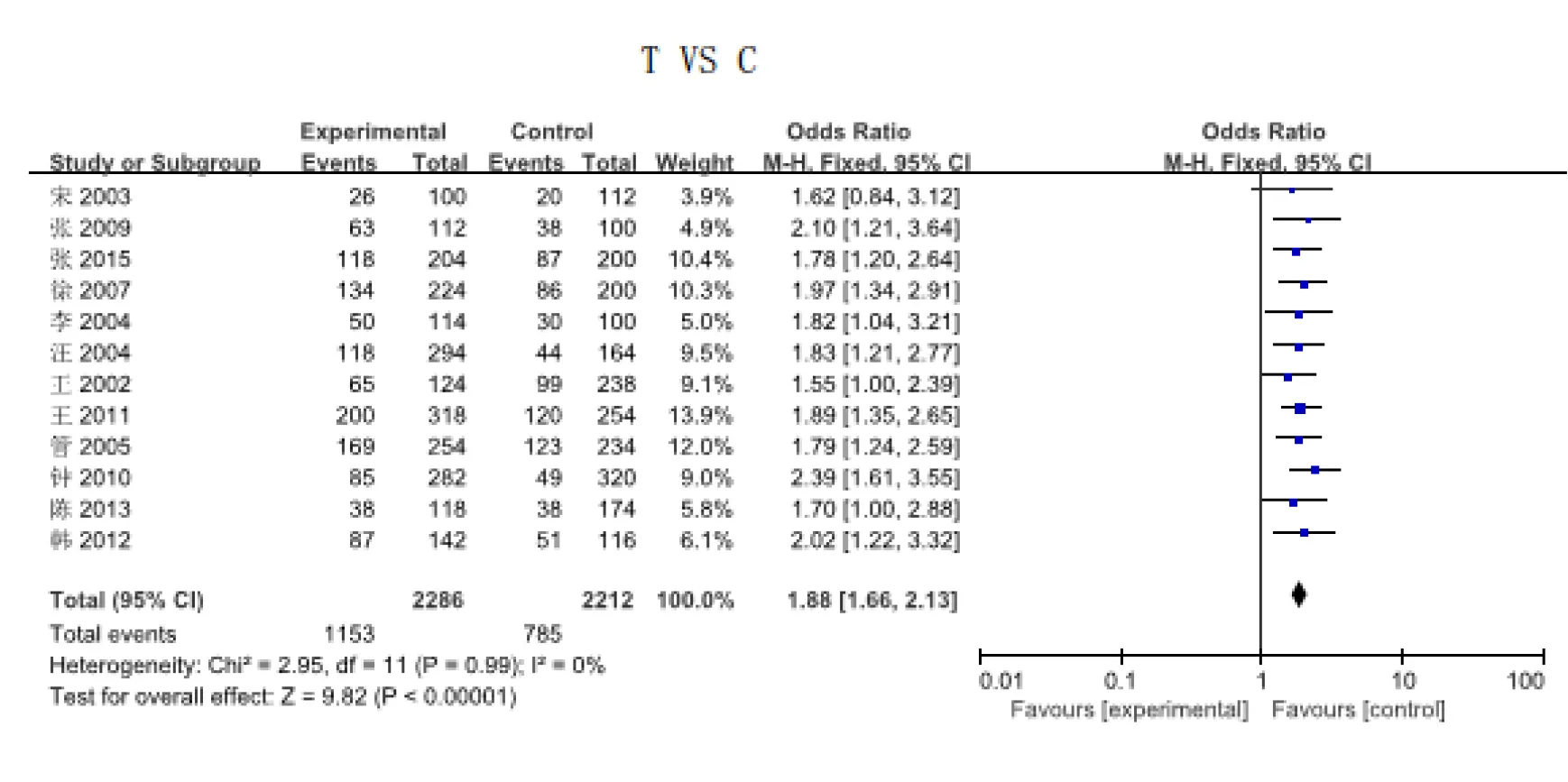
图2 国内MTHFR基因型T与URSA相关性meta分析
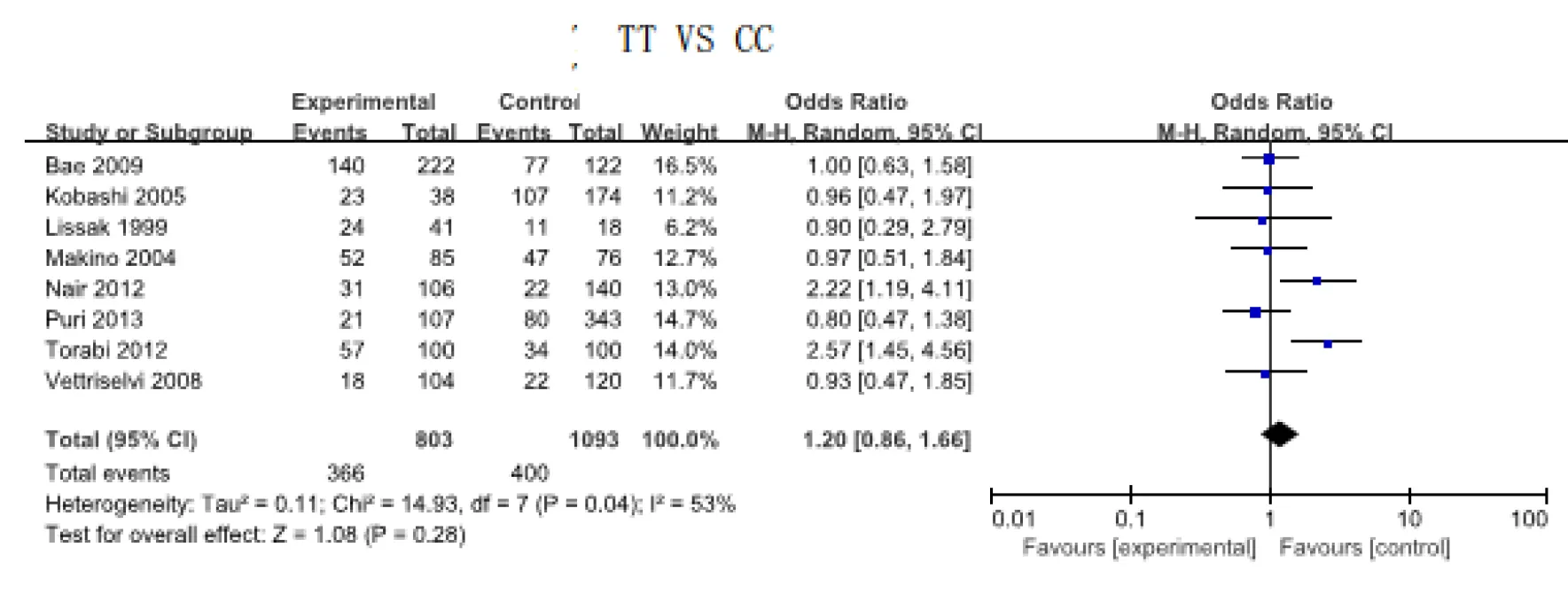
图3 亚洲国家MTHFR基因型TT与URSA相关性meta分析森林图
2.3 敏感性分析
使用RevMan 5.3软件进行敏感性分析,通过每次排除一个病例对照研究后再重新统计分析以确保整体的结果不受任何一项单一研究的影响。本研究中未发现任何一篇研究会影响到结果的稳定性。
2.4 发表偏倚
利用RevMan 5.3软件对各基因型绘制Begg漏斗图评估各研究之间是否存在潜在的发表偏倚。结果显示所绘漏斗图基本对称近似倒漏斗状,未显示明显的不对称(图4)。
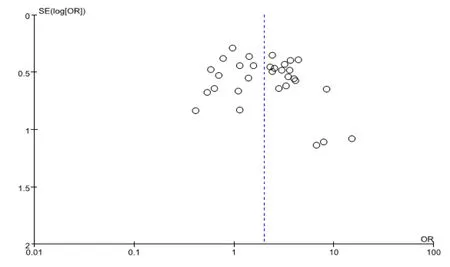
图4 纳入文献发表性偏倚的Begg漏斗图
3 讨论
3.1 MTHFR基因生理功能
MTHFR是叶酸代谢和同型半胱氨酸( HCY)通路中的关键代谢酶[8],维持体内同型半胱氨酸的正常代谢过程。人类的MTHFR基因氨基酸序列高度保守,目前已发现存在多个突变位点,达20余种[9]。其中研究最多的是MTHFR 667C→T的突变,是位于MTHFR催化域的第4号外显子区,第677核苷酸位由胞嘧啶C突变为胸腺嘧啶T,对应氨基酸由丙氨酸错义突变为缬氨酸,导致MTHFR热稳定性降低,酶活性降低。有研究表明,若以个体携带677CC基因型时其MTHFR活性为100%时,则携带CT基因型的活性为CC的71%,基因型为TT的活性仅有34%[10]。Khot等[11]研究发现与基因型CC相比,CT者体内叶酸含量降低10%,TT 型则降低18%,携带T 等位基因的对象有降低叶酸水平和升高HCY 的特点。目前认为,叶酸代谢异常导致的高同型半胱氨酸血症是血液高凝状态形成的重要原因之一,是多种动静脉栓塞性疾病的独立危险因素[12],由其所致的胎盘动脉栓塞可进一步引发胚胎供血不足、绒毛坏死,成为导致自然流产发生的重要原因[13]。也有文献报道,HCY水平升高可诱导滋养细胞凋亡和减少分泌孕妇体内促性腺激素导致妊娠丢失[14]。同时MTHFR参与体内的核酸代谢,当MTHFR C667T位点发生多态性改变时,核酸代谢障碍,胎儿所需的DNA和蛋白质合成减少,导致胚胎发育异常或停止发育[15]。
3.2 MTHFR C667T基因多态性与URSA相关性分析
本研究经过对31篇纳入的文献统计分析后发现,MTHFR C667T基因多态性与URSA的发病存在相关性,MTHFR基因型为TT的女性其发生URSA的风险较基因型为CC的女性高98%,但需注意到各研究间的明显异质性。异质性的存在可能与病例选择差别、样本量的大小及人种、地域、生活习惯等环境因素不同有关。有研究表明,MTHFR C→T的突变频率在不同国家、同一国家的不同地区及同一地区不同民族中的分布有差异[16-18]。故本文再次进行了亚组分析。首先,对国内人群同国外人群进行了亚组分析,结果显示在国内人群中各研究无异质性,携带等位基因T及基因型TT的个体是URSA的高危遗传性因素,基因型为TT的个体与URSA的发生密切相关。但在国外人群中,MTHFR C677T基因多态性与URSA的发病未见关联,这与Ren等[19]和刘宇岩等[20]的meta分析结论相同。在国内人群分层中,本研究较Ren等[19]和刘宇岩等[20]纳入了更多的中文文献,样本量的增多让MTHFR C667T基因多态性与URSA发生的相关性及关联强度更客观、可信。
此外,有研究报道,MTHFR C667T等位基因的突变率欧洲18.6%,亚洲20.8%,非洲6.6%,美洲32.2%,澳洲4.7%[21]。不同地域MTHFR C667T等位基因的突变率不同。Ren等[19]的meta分析中将中国人群和欧洲人群进行分层,而忽视了中国相邻的其他亚洲国家,因此本研究将国内人群和其他亚洲国家人群进行再次分层分析,结果显示在其他亚洲国家人群中,MTHFR C677T基因多态性与URSA的发病并无关联。这同样可能与样本量、种族、地区差异有关。
3.3 叶酸在MTHFR基因多态性与URSA相关性之间的作用
目前认为,血HCY的浓度与MTHFR基因多态性相关取决于血液中叶酸水平[22],而血中叶酸水平与URSA风险相关[23],因此叶酸水平在MTHFR多态性和URSA风险相关性间起到重要的作用。尽管从1993年起我国开始实施围孕期女性增补叶酸的政策,但叶酸总服用率仅为20.7%[24],加上地域、饮食习惯、文化差异等因素, MTHFR的基因型分布仍有着明显的地域差异。贺宪民等[25]曾在部分中国女性中进行了多中心、大样本的MTHFR 分子流行病学研究,结果表明 TT 基因型的频率北方显著高于南方,比例相差 27%左右。本次研究纳入的中文文献中有9篇来自北方,3篇来自南方,而胡晓东等[26]报道,在南方深圳市MTHFR C677T基因多态性可能与URSA无显著相关性。因此笔者推测北方人群是URSA的易感人群,提高全国育龄妇女围孕期叶酸服用率的同时更应加强对北方育龄妇女增补叶酸的管理。
3.4 夫妻双方MTHFR基因多态度性与URSA发生相关性
同时,也应注意到基因与环境、基因与基因间的相互作用。王亚文等[27]研究了MHTFR基因多态性在夫妻间的不同存在形式与RSA之间的关系,发现夫妻双方都是CT或TT基因型,其基因型分布与流产发生的危险性增高高度相关;夫妻双方有一人是677CT或TT,另一人为CC,其基因型分布与流产发生的危险性无关联,夫妻双方都是677CC,其基因型分布与发生流产的危险性降低高度相关。Vanilla等[28]报道在RSA病例组中发现父亲的T等位基因频率的增加,提出父系MTHFR C667T 基因多态性也应进入产前筛查。也有相关研究表明MTHFR基因多态性的组合可导致RSA的风险增高[29]。
3.5 本研究的局限性
当然,该研究仍存在一定的局限性。首先,meta分析属于描述性二次分析,是建立在已有的研究基础之上,因此选取的文献异质性、变量的研究设计、不同的判断标准即统计方法都可能影响到meta分析的结果。其次,本次研究所选文献中中文文献高达12篇,而英文文献相对较少,涉及的地域较广、种族较多,无法进行更加细致的分层分析,因而考虑所观察到的整体关联程度很大程度上归因于国内的12篇研究文献。最后,URSA的发生是多因素、多方面的,本研究中仅对单一MTHFR C667T基因多态性分析,忽略了其血中叶酸水平、其他基因位点的多态性及配偶基因多态性情况,结论可能仍存在偏颇。因此,本研究的结论仍然需要进行多中心、大样本、多方面科学的病例对照研究进一步证实。
综上所述,在中国,MTHFR C667T基因多态性与URSA的发病存在明显相关性,携带等位基因T及基因型TT的个体是URSA的独立高危遗传性因素,可作为URSA患者的遗传性筛查指标。但在国外人群中,包括其他亚洲国家,MTHFR C677T基因多态性与URSA的发病未见到关联。
[1] 徐磊,刘睿智. IL-1b、 IL-1RA 基因多态性与习惯性流产研究进展[J]. 中国妇幼保健,2010,25(14):2011-2012.
[2] Kim JH,Jeon YJ,Lee BE, et al. Association of methionine synthase and thymindylate synthase genetic polymorphisems with idiopathic recurrent pregnancy loss [J]. Fertil Steril, 2013, 99 (6) :1674-1680.
[3] 马水清,白春梅,盖铭英. 遗传性易栓症与流产[J] .中华妇产科杂志,2001,36:691-692.
[4] Foka ZJ,Lambropoulos A,Saravelos H ,et al.Leiden and prothrombin G20210A mutations,but not methylenetetrahydrofolate reductase C677T,are associated with recurrent miscarriages[J] .Hum Reprod,2000,15:458-462.
[5] 胡晓东,梁佩燕,刁梁辉,等. 亚甲基四氢叶酸还原酶基因突变与不明原因复发性流产的关系[J].中国优生与遗传杂志,2014,22(11):87-89.
[6] 汪希鹏,林其德,洪燕,等. 原因不明复发性流产遗传性血凝因素研究[J]. 上海交通大学学报(医学版),2006,12:1361-1364.
[7] 许丽娜,王仙萍. 某区原因不明复发性流产与遗传性血凝因素的研究[J].中国医药指南,2015,12(13):191-192.
[8] Sereshki N, Gharagozloo M, Ostadi V, et al. Variations in T-helper 17 and Regulatory T Cells during The Menstrual Cycle in Peripheral Blood of Women with Recurrent Spontaneous Abortion[J].International journal of fertility sterility, 2014, 8 (1): 59-66.
[9] 鲁衍强,芮欣忆.亚甲基四氢叶酸还原酶基因多态性与不孕不育症的研究进展[J].新医学,2012,43(07):511-514.
[10] 赵加洪,李瑛,鲁衍强,等. MTHFR基因多态性检测在生殖健康领域的临床价值[J]. 中国妇幼卫生杂志,2015,9(6):79-83.
[11] Khot V,Chavan-Gautam P,Joshi S. Proposing interactions between maternal phospholipids and the one carbon cycle: A novel mechanism influencing the risk for cardiovascular diseases in the offspring in later life[J]. Life Sci,2015,129(10): 16-21.
[12] 王素敏,石晓燕,沈嵘,等. 叶酸代谢酶基因多态性与反复自然性流产易感性的研究[J].中国优生与遗传杂志,2009,17(3):12-13.
[13] Choll TO,Johnson WG. Folie acid:Influence on the outcome of pregnancy[J].Arn J Clin Nutr,2000,71(5):1295-1303.
[14] di Simone N, Maggiano N, Caliandro D, et al. Homocystein induces trophoblast cell death with apoptopic features[J] . Biol Reprod, 2003,69:1129-1134.
[15] 戴晓婧, 钟慧军, 焦海燕, 等. 宁夏回、汉族人群5,10-亚甲基四氢叶酸还原酶C677T多态性研究[J]. 宁夏医学院学报, 2008, 30(2):152-154.
[16] Cao Y,Xu J,Zhang Z,et al.Association study between methylenetetrahydrofolate reductase polymorphisms and unexplained recurrent pregnancy loss:a meta-analysis[J].Gene,2013,514(2):105-111.
[17] 贺宪民,张群,杨琦,等. 亚甲基四氢叶酸还原酶和甲硫氨酸合成酶还原酶基因多态性研究[J]. 中国计划生育学杂志,2010,18(1): 13.
[18] 杨玉清 唐菊香 鲁衍强,等.银川市回族和汉族女性MTHFR和MTRR基因单核苷酸多态性分析[J]. 中国妇幼保健,2015,30(35):6267-6269.
[19] Ren A,Wang J.Methylenetetrahydrofolate reductase C677T polymorphism and the risk of unexplained recurrent pregnancy loss:A meta analysis[J].Fertil Steril,2006,86(6):1716-1722.
[20] 刘宇岩,杨博逸,李永芳,等. 5,10亚甲基四氢叶酸还原酶 MTHFR基因多态性与原因不明复发性流产关联的Meta分析[J].中国全科医学,2013,9(16):2992-2997.
[21] van Beynum IM,den Heijer M,Blom HJ,et al. The MTHFR 677C->T polymorphism and the risk of congenital heart defects: a literature review and meta-analysis[J].QJM,2007,100(12):743-753.
[22] Vaughn JD, Bailey LB, Shelnutt KP, et al. Methionine synthase reductase 66A-G polymorphism is associated with increased plasma homocysteine concentration when combined with the homozygous methylenetetrahydrofolate reductase 677C-T variant[J] . J Nutr ,2004,134:2985-2990.
[23] Li XM, Xu YX, Jiang S. The correlation study on the homocysteine metabolic abnormality and unexplained repeated spontaneous abortion in Chinese[J] . Sheng Zhi Yi Xue Za Zhi, 2003,12:206-210.
[24] 王宏伟,茅群霞,刘庆.育龄妇女受教育程度与其对叶酸补充认知及服用关系的Meta分析[J].国际生殖健康/计划生育杂志,2015,1(34):43-47.
[25] 贺宪民,张群,杨琦,等. 亚甲基四氢叶酸还原酶和甲硫氨酸合成酶还原酶基因多态性研究[J]. 中国计划生育学杂志,2010,18(1) : 13.
[26] 胡晓东,梁佩燕,刁梁辉,等. 亚甲基四氢叶酸还原酶基因突变与不明原因复发性流产的关系[J]. 中国优生与遗传杂志,2014,22 (11) :87-89.
[27] 王亚文, 李芬, 李义平,等.夫妻配对MTHFR基因型分布与不明原因反复流产的关系[J].西安交通大学学报(医学版),2002,23(4):357-359.
[28] Vanilla S, Dayanand CD, Kotur PF, et al.Evidence of Paternal N5,N10-Methylenetetrahydrolate Reductase (MTHFR)C667T Gene Polymorphism in Couples with Recurrent Spontaneous Abortions (RSAs) in Kolar District-A South West of India[J]. Clin Diagn Res,2015,9(2):15-18.
[29] Hubacek JA, Rynekrova J, Kasparova D, et al.Association of MTHFR genetic variants C677T and A1298C on predisposition to spontaneousabortion in Slavonic population[J].Clin Chim Acta, 2015,440:104-107.
[责任编辑:张 璐]
A meta analysis on correlation between polymorphisms of methylenetetrahydrofolate reductase and unexplained recurrent spontaneous abortion
ZHANG Dan1,2,WANG Weiwei1,ZHANG Hongxiu1*
1.DepartmentofObstetricsandGynecology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Jiangsu, 210029; 2.DepartmentofObstetricsandGynecology,DianshanLakePeople'sHospitalofKunshancityinJiangsuprovince
*Correspondingauthor:hongxiuz@hotmail.com
Objective: To analyze correlation between polymorphisms of the 5, 10 methylenetetrahydrofolate reductase (MTHFR) C667T and unexplained recurrent spontaneous abortion (URSA). Methods: Literatures of correlation between polymorphisms of MTHFR C667T and URSA were comprehensively searched in database such as PubMed, CNKI, Wanfang、CBM and (VIP). Literature screening was conducted according to the included criteria, literatures quality was evaluated, and the RevMan 5.3 software was used for meta-analysis. Results: A total of 31 literatures were included, and 3706 subjects were in URSA group, and 3937 subjects were in healthy control group. The results showed that the polymorphism of MTHFR C677T was correlated with URSA (T/C :OR=1.41, 95%CI1.23-1.6,P<0.05; CT/CC:OR=1.23 ,95%CI1.03-1.47,P<0.05; (TT+CT)/CC:OR=1.45, 95%CI1.21-1.74,P<0.05; TT/CC:OR=1.98, 95%CI1.51-2.59,P<0.05). There was significant difference between URSA group and healthy control group (P<0.05); The risk of URSA of domestic women with genotype TT was 3.56 times higher than that of domestic women with genotype CC when subgroup analysis was conducted. Genotype TT and allele T genetic were the risk factors of URSA (TT/CC:OR= 3.56, 95%CI2.71-4.69,P<0.05; T/C:OR=1.88, 95%CI1.66-2.13,P<0.05; CT/CC:OR=1.67, 95%CI1.36-2.04,P<0.05; (TT+CT)/CC:OR=2.07, 95%CI1.71-2.50,P<0.05), and there was significant different between URSA group and healthy control group (P<0.05 ), but there was no significant different between URSA group and healthy control group for foreign women, which including other Asian women (P>0.05). Conclusion: The gene polymorphism of MTHFR C667T is associated with URSA. And gene polymorphism of MTHFR C667T is the high risk factor of URSA for Chinese women, but there is no any correlation with foreign women including other Asian women.
5, 10 methylenetetrahydrofolate reductase; Polymorphism; Unexplained recurrent spontaneous abortion; Meta analysis
2016-03-21
2016-12-10
10.3969/j.issn.1004-8189.2017.02
*通讯作者:hongxiuz@ hotmail.com
