TLR4基因敲除对小鼠内脏脂肪组织免疫细胞及脂肪因子的影响①
2017-06-05孟晓燕张国俊刘国燕王秀丽宋向凤
孟晓燕 张国俊 杨 灿 刘国燕 王秀丽 宋向凤
(新乡医学院基础医学院/河南省分子诊断与医学检验技术协同创新中心,新乡453003)
TLR4基因敲除对小鼠内脏脂肪组织免疫细胞及脂肪因子的影响①
孟晓燕 张国俊 杨 灿 刘国燕 王秀丽 宋向凤
(新乡医学院基础医学院/河南省分子诊断与医学检验技术协同创新中心,新乡453003)
目的:探讨TLR4基因敲除对小鼠免疫细胞及脂肪因子的影响。方法:取20周龄的雄性野生型C57BL/6小鼠和TLR4-/-小鼠的脾脏和附睾脂肪组织,分离细胞,用流式检测F4/80、CD11b、CD11c、CD3、CD4、CD8分子的表达;qPCR检测附睾脂肪组织内IL-6、HMGB1、TNF-α、脂联素和抵抗素的表达。结果:与野生型C57BL/6小鼠相比,TLR4-/-小鼠脾脏和附睾脂肪组织中M1型(F4/80+CD11b+CD11c+)巨噬细胞比例上升(P<0.05),M2型(F4/80+CD11b+CD11c-)巨噬细胞比例下降(P<0.05),这种趋势在附睾脂肪组织中表现更为显著。同时发现附睾脂肪组织中CD4+T细胞比例下降(P<0.05),CD8+T细胞比例上升(P<0.05);IL-6、HMGB1、抵抗素表达升高(P<0.05);TNF-α和脂联素表达降低(P<0.05)。结论:TLR4基因敲除可导致内脏脂肪组织脂肪因子和免疫细胞的紊乱。
Toll样受体4;脂肪因子;巨噬细胞;T淋巴细胞
肥胖相关的慢性炎症是内脏脂肪组织发生胰岛素抵抗的始动因素[1]。Toll样受体(Toll-like receptors,TLRs)是一类主要的模式识别受体,目前在哺乳动物中已经发现的TLR有13种[2]。TLR4是最早发现也是研究最深入的TLR,主要分布在单核细胞、巨噬细胞、NK细胞和脂肪细胞的胞膜上[3],与配体结合后可通过NF-κB信号途径生成并释放大量的促炎细胞因子。近年来研究表明食物中的饱和脂肪酸可通过与TLR4结合激活相关信号通路,若缺失TLR4基因,可缓解高脂饮食诱导的小鼠肥胖和胰岛素抵抗的发生[4]。但TLR4基因缺失的小鼠其内脏脂肪组织中免疫细胞及脂肪因子如何改变少见报道,本研究探讨TLR4基因敲除对小鼠附睾脂肪组织中免疫细胞及脂肪因子的影响。
1 材料与方法
1.1 实验材料 FITC-anti-CD11b、APC-anti-F4/80、PE-anti-CD11c、PE-cy5.5-anti-CD4、V500-C-A-anti-CD8、PE-cy7-anti-CD3流式抗体购于达科为生物技术公司;胶原酶Ⅱ购于Sigma 公司;RPMI1640培养基购于Gibco;RNAiso Plus试剂和M-MLV逆转录酶购于TaKaRa公司;qPCR试剂盒购于Thermo fisher; 引物由Introvigen 公司合成;TLR4-/-小鼠由北京协和医学院韩代书教授馈赠;小鼠常规饲养,保持室内温度在22~26℃,湿度40%~60%,随意自由饮水和给予标准饲料进食。
1.2 方法
1.2.1 总RNA提取和qPCR 取0.1 g附睾脂肪组织于液氮预冷的研钵中,研磨成粉末状,加入1 ml RNAiso Plus试剂研磨至液体,按照TaKaRa公司RNAiso Plus试剂说明书操作步骤提取总RNA;按照TaKaRa公司M-MLV逆转录酶试剂盒说明书操作步骤逆转录RNA获取cDNA;应用SYBR Green 荧光嵌合法在ABI PRISM 7500 Real-time cycler 进行qPCR实验。用相对定量的方法,测定目的基因及内参基因PCR产物荧光强度达到一定值所需Ct值,用2-ΔΔCt方法计算各基因相对表达量。
1.2.2 脂肪组织内细胞的分离及流式检测 取小鼠附睾脂肪组织0.2 g,剪碎后加入1 mg/ml的Ⅱ型胶原酶2 ml,消化(37℃,1.5 h),离心(4℃,1 000 r/min,5 min),取沉淀中的细胞,用PBS洗涤2次,分别用F4/80、CD11b、CD11c、CD3、CD4、CD8抗体冰上孵育30 min,洗涤抗体,进行流式检测。
1.2.3 脾脏内细胞的分离及流式检测 取小鼠脾脏,用毛玻璃片研磨分离细胞,加4 ml RPMI1640培养基混匀,取100 μl细胞悬液,分别用F4/80、CD11b、CD11c抗体冰上孵育30 min,洗涤抗体,进行流式检测。
2 结果
2.1 TLR4基因敲除对附睾脂肪组织内巨噬细胞的影响 与野生型C57BL/6小鼠相比,TLR4基因敲除小鼠附睾脂肪组织内M1型(F4/80+CD11b+CD11c+)巨噬细胞比例上升(P<0.05),M2型(F4/80+CD11b+CD11c-)巨噬细胞比例下降(P<0.05,图1)。
2.2 LR4基因敲除对附睾脂肪组织内T淋巴细胞 与野生型C57BL/6小鼠相比,TLR4基因敲除小鼠附睾脂肪组织内CD4+T细胞比例下降(P<0.05),但CD8+T细胞比例上升(P<0.05,图2)。
2.3 TTLR4基因敲除对脾脏巨噬细胞的影响 与野生型C57BL/6小鼠相比,TLR4基因敲除小鼠脾脏内M1型(F4/80+CD11b+CD11c+)巨噬细胞比例上升(P<0.05),M2型(F4/80+CD11b+CD11c-)巨噬细胞比例下降(P<0.05,图3A);同时发现附睾脂肪组织中M1/M2比脾脏中M1/M2升高更显著(图3B)。
2.4 TLR4基因敲除对附睾脂肪组织内脂肪因子的影响 与野生型C57BL/6小鼠相比,TLR4基因敲除小鼠附睾脂肪组织内Resistin、IL-6和HMGB1表达升高(P<0.05),TNF-α和Adiponectin表达降低(P<0.05),见图4。
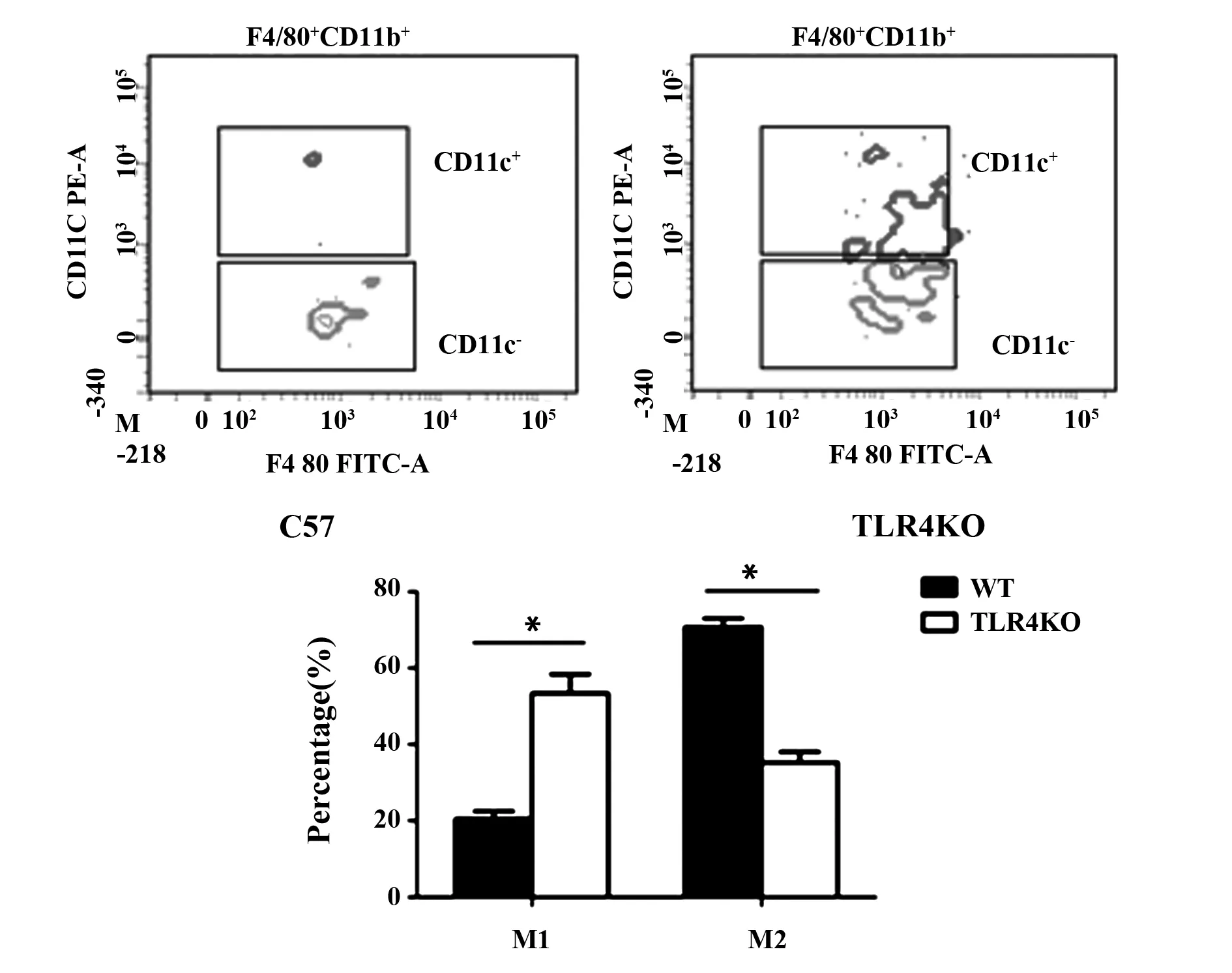
图1 TLR4基因敲除对附睾脂肪组织内巨噬细胞的影响Fig.1 Effect of TLR4 knockout on macrophages in epididymal adipose tissueNote: *.P<0.05 compared with WT mice.

图2 TLR4基因敲除对附睾脂肪组织内T淋巴细胞亚群的影响Fig.2 Effect of TLR4 knockout on T cells in epididymal adipose tissueNote: *.P<0.05 compared with WT mice.
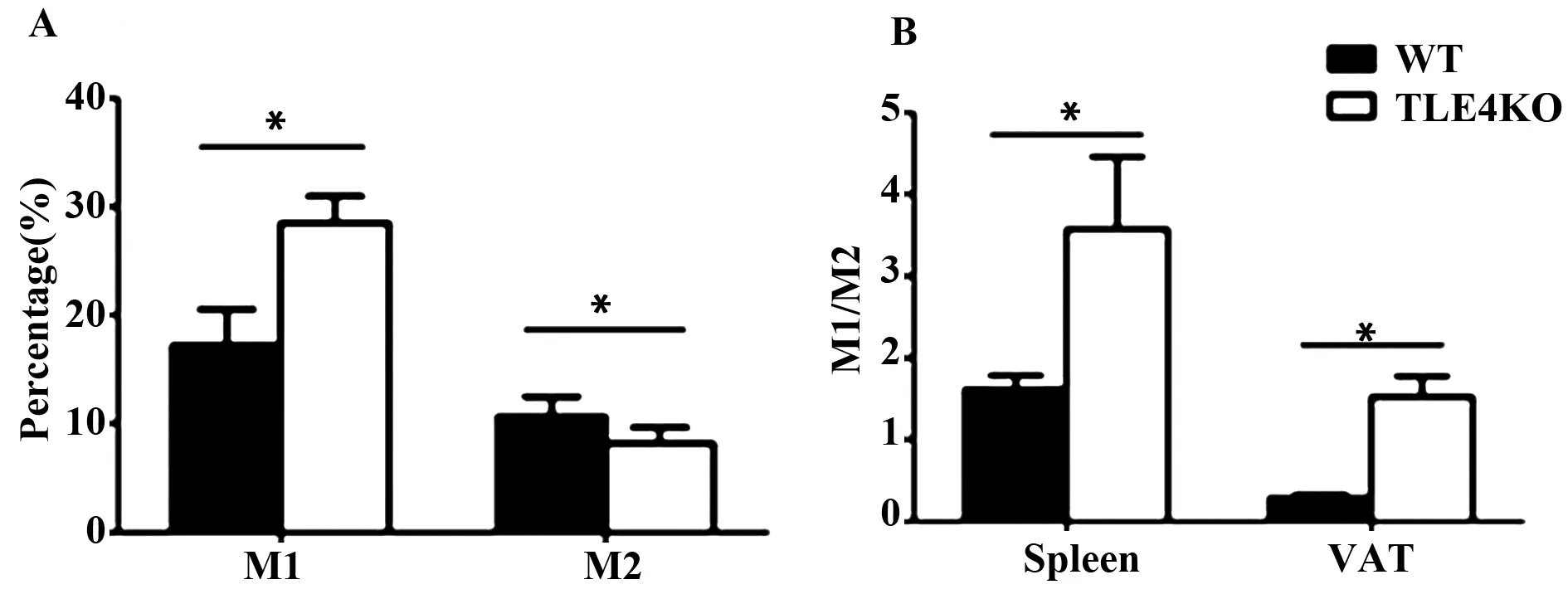
图3 TLR4基因敲除对脾脏巨噬细胞的影响Fig.3 Effect of TLR4 knockout on macrophages in spleenNote: A.M1 and M2 macrophage in spleen;B.M1/M2 ratio in spleen and epididymal adipose tissue.

图4 TLR4基因敲除对附睾脂肪组织内脂肪因子的影响Fig.4 Effect of TLR4 knockout on adiponeckines in epididymal adipose tissueNote: *.P<0.05 compared with WT mice.
3 讨论
脂肪组织不仅是机体储存能量的“仓库”,而且能分泌大量的脂肪因子[5]。脂肪组织中也存在大量的免疫细胞,对维持脂肪组织的炎症平衡具有重要的调节作用。T淋巴细胞和巨噬细胞是脂肪组织内两群重要的免疫细胞。巨噬细胞根据其生物学作用可分为M1促炎型巨噬细胞和M2抗炎型巨噬细胞两大类[6]。T细胞根据其表面分化抗原的表达可分为CD4+T细胞和CD8+T细胞[7]。我们的结果发现,TLR4基因敲除后,小鼠脾脏和附睾脂肪组织中的M1型巨噬细胞比例上升,M2型巨噬细胞比例下降,并且这种现象在附睾脂肪组织更为明显。与野生型小鼠相比, TLR4-/-小鼠的附睾脂肪组织中CD4+T细胞减少,CD8+T细胞增多;IL-6的表达明显上调,这些结果提示TLR4基因敲除可使机体尤其是内脏脂肪组织处于低度炎症状态,免疫细胞的数量和比例失调。脂联素是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,能改善小鼠的胰岛素抗性和动脉硬化症;抵抗素是由脂肪细胞分泌的一种多肽类激素,被认为可引起胰岛素抵抗,与肥胖病、2型糖尿病的发病存在着密切关系[8]。本结果发现,TLR4基因敲除可使内脏脂肪组织内脂联素表达下调、抵抗素表达上调。但有意思的是TNF-α的表达在TLR4-/-小鼠的内脏脂肪组织是下调的,这种机制值得进一步研究。
高迁移率族蛋白1(High mobility group,HMGB1)是高度保守的核蛋白,广泛分布于哺乳动物细胞中。HMGB1是一种重要的晚期致炎因子,近年来已成为研究热点之一[9,10]。目前研究显示脂肪细胞可以产生HMGB1,在机体慢性低度炎症的发生发展中发挥着至关重要的作用[11],通过qPCR发现TLR4-/-小鼠的内脏脂肪组织中HMGB1的表达升高,这进一步提示TLR4基因敲除可影响炎症因子的分泌,导致机体的内环境紊乱。HMGB1的受体之一是TLR4,那么TLR4的敲除对HMGB1-TLR4信号通路和肥胖的影响是下一步研究的方向。
[1] Jagannathan-Bogdan M,McDonnell ME,Shin H,etal.Elevated proinflammatory cytokine production by a skewed T cell compartm-ent requires monocytes and promotes inflammation in type 2 diabetes [J].J Immunol,2011,186(2):1162-1172.
[2] Hua Z,Hou B.TLR signaling in B-cell development and activation[J].Cell Mol Immunol,2013,10(2):103-106.
[3] Pahwa R,Devaraj S,Jialal I.The effect of the accessory proteins,soluble CD14 and lipopolysaccharide-binding protein on Toll-like receptor 4 activity in human monocytes and adipocytes[J].Int J Obes(Lond),2016,40(6):907-911.
[4] Pierre N,Deldicque L,Barbé C,etal.Toll-like receptor 4 knockout mice are protected against endoplasmic reticulum stress induced by a high-fat diet[J].PLoS One,2013,8(5):e65061.
[5] 马祎喆,周红文.免疫细胞在脂肪组织炎症中的调控作用[J].南京医科大学学报(自然科学版),2016,36(1):19-25.
[6] Wynn TA,Chawla A,Pollard JW.Macrophage biology in development, homeostasis and disease[J].Nature,2013,496(7446):445-455.
[7] Vieira Braga FA,Hertoghs KM,van Lier RA,etal.Molecular characterization of HCMV-specific immune responses: Parallels between CD8(+) T cells,CD4(+)T cells,and NK cells[J].Eur J Immunol,2015,45(9):2433-2445.
[8] Parvaresh Rizi E,Teo Y,Leow MK,etal.Ethnic differences in the role of adipocytokines linking abdominal adiposity and insulin sensitivity among asians[J].J Clin Endocrinol Metab,2015,100(11):4249-4256.
[9] Wang X,Xiang L,Li H,etal.The role of HMGB1 signaling pathway in the development and progression of hepatocellular carcinoma:a review[J].Int J Mol Sci,2015,16(9):22527-22540.
[10] Hu Z,Wang X,Gong L,etal.Role of high-mobility group box 1 protein in inflammatory bowel disease[J].Inflamm Res,2015,64(8):557-563.
[11] 张国俊,于莉莉,宋向凤.HMGB1与脂肪组织炎症[J].中国免疫学杂志,2016,32(8):1228-1231.
[收稿2016-08-26 修回2016-10-31]
(编辑 许四平)
Effects of TLR4 knockout on immune cells and adipokines in mouse visceral adipose tissue
MENGXiao-Yan,ZHANGGuo-Jun,YANGCan,LIUGuo-Yan,WANGXiu-Li,SONGXiang-Feng.
SchoolofBasicMedicalSciences,XinxiangMedicalUniversity/HenanCollaborativeInnovationCenterofMolecularDiagnosisandLaboratoryMedicine,XinxiangMedicalUniversity,Xinxiang453003,China
Objective:To investigate the effects of TLR4 knockout on immune cells and adipokines in mouse visceral adipose tissue.Methods: Cells were isolated from the spleen and epididymal adipose tissue of 20-week-old male wild type mice C57BL/6 and TLR4-/-.The expression of F4/80,CD11b,CD11c,CD3,CD4 and CD8 in these cells were analyzed by flow cytometry.The expression of IL-6,HMGB1,TNF-α,adiponectin and resistin in epididymal adipose tissue were detected by qPCR.Results: Compared with wild type C57BL/6 mice,the percentage of M1 macrophage which marked F4/80+CD11b+CD11c+in spleen and epididymal adipose tissue of TLR4-/-mice increased(P<0.05) greatly,while that of M2 macrophage which marked F4/80+CD11b+CD11c-was decreased(P<0.05)significantly.This trend was more remarkable in epididymal adipose tissue than in spleen(P<0.05).In epididymal adipose tissue,the percentage of CD4+T cells decreased but that of CD8+T cells increased in TLR4-/-mice.Moreover,the high-level expressions of IL-6,HMGB1,resistin were found in epididymal adipose tissue of TLR4-/-mice.However,the expressions of TNF-α and adiponectin decreased obviously.Conclusion: TLR4 knock-out could lead to a disorder in adipokine and immune cells in visceral adipose tissue.
Toll like receptor 4;Adipokine;Macrophage;T lymphocyte cell
10.3969/j.issn.1000-484X.2017.05.006
①本文为2015年地方高校国家级大学生创新创业训练计划项目(201510472002)、河南省自然科学基金(162300410225)(14A310016)和河南省教育厅科学技术研究重点项目(14A310016)。
孟晓燕(1993年-),女,主要从事代谢与免疫方面的研究,E-mail:858298626@qq.com。
及指导教师:宋向凤(1970年-),女,博士,教授,主要从事代谢与免疫的研究,E-mail:xiangfsong@163.com。
R392.11
A
1000-484X(2017)05-0665-03
