利用X射线相衬CT技术观察胆管结扎诱导肝纤维化微脉管的变化
2017-06-05秦莉莉QINLili
秦莉莉QIN Lili
简建波1JIAN Jianbo
赵新颜2ZHAO Xinyan
胡春红1HU Chunhong
利用X射线相衬CT技术观察胆管结扎诱导肝纤维化微脉管的变化
秦莉莉1QIN Lili
简建波1JIAN Jianbo
赵新颜2ZHAO Xinyan
胡春红1HU Chunhong
目的肝纤维化是慢性肝病向肝硬化发展的必然病理过程,本研究拟探讨X射线相衬CT(PCCT)技术评估胆管结扎诱导肝纤维化中微脉管变化的价值。材料与方法 胆管结扎诱导大鼠肝纤维化组和对照组肝脏组织各5例,成像实验在上海同步辐射装置的BL13W1线站进行,成像后样品进行天狼星红染色和CK19免疫组织化学染色。实验利用PCCT技术重建肝脏组织中的三维(3D)微脉管结构,并分析微脉管密度与纤维面积比之间的相关性。结果PCCT技术清晰地展示了肝脏中的血管、扩张胆管和增生胆管等脉管结构。与对照组相比,肝纤维化组3D微脉管密度和纤维面积比均明显增大(P<0.01),并且两者呈正相关(r=0.812,P<0.01)。结论PCCT成像能够清晰展示肝纤维化组织微脉管结构的3D特征,并且3D微脉管密度与纤维面积比具有高度相关性,表明在肝纤维化发展中,微脉管的变化与纤维化程度密切相关,这为利用微脉管的变化评价纤维化疾病的发展提供了一种新思路。
肝硬化;体层摄影术,X线计算机;X线衍射;图像处理,计算机辅助;病理学;疾病模型,动物;大鼠,Sprague-Dawley;男(雄)性
肝纤维化是肝脏对慢性损伤的一种愈合反应,随着胶原糖蛋白等细胞外基质的不断沉积,胶原会过度增生,纤维面积不断增加,肝内微脉管也会出现受压变形等现象[1-4]。在肝纤维化研究中,肝脏微脉管的三维(3D)可视化对评估肝纤维化疾病发展有重要意义[1]。目前,肝活检和病理切片为临床诊断肝纤维化的“金标准”,但该技术为有创检查,且存在取样主观性强、取样误差及反复取材对机体产生破坏性等缺点[5]。X线透视、超声、CT和MRI等传统的成像方法由于受分辨率和成像衬度的限制,对肝纤维化微脉管结构的成像还存在难度[6-8]。X射线相衬CT(phase-contrast computed tomography,PCCT)是利用X线透过样品后携带的相位信息对样品内部结构进行清晰成像[9],能够获得高分辨率的3D图像,在肝脏显微影像分析方面应用广泛[4,10-12]。本研究利用PCCT成像揭示肝脏微脉管结构,并探讨3D微脉管密度与纤维面积比的相关性,为更好地评价肝纤维化疾病的发展提供新的方向。
1 材料与方法
1.1 实验动物分组及模型建立 选择10只清洁级、体重为180~200 g的Sprague-Dawley雄性成年大鼠,由首都医科大学附属北京友谊医院动物研究中心提供(许可证号:12-1004)。实验前,大鼠在标准实验室饲养条件下喂养,水料充足。为建立胆管结扎诱导的肝纤维化动物模型[4],将大鼠随机分为对照组和实验组,每组5只。实验组大鼠通过麻醉、剖腹、游离胆总管、行双重结扎胆总管建成肝纤维化模型,于胆管结扎术后6周处死大鼠。对照组大鼠只进行麻醉、剖腹、游离胆总管,不结扎胆总管,于6周时一并处死。剥离大鼠肝脏,并立即放入10%福尔马林溶液中进行固定。PCCT成像时将样品固定于样品旋转台上扫描,成像后样品继续放回福尔马林溶液,以备后续制作病理切片。实验动物处理过程遵循动物福利和伦理准则,并经实验动物伦理委员会审核批准。
1.2 PCCT实验装置和参数设置 实验在上海同步辐射装置的BL13W1线站进行,装置见图1。实验采用类同轴相位衬度成像方法。在成像中,光子能量为24 keV,曝光时间为12 ms,探测器分辨率为9 μm,样品与探测器之间的距离为0.8 m。将样品固定于旋转台上,以0.35°/s旋转180°。每个样品采集总投影数733张,背景图10张,暗电流图像10张,用于后续图像校正。
1.3 PCCT数据处理 为了排除噪声干扰和能量波动的影响,需要利用背景图像和暗电流图像对原始投影图像进行校正,随后需对校正后的图像进行相位恢复处理,提取投影图中的相位信息[13]。然后再对相位恢复后的投影数据进行断层重构,最后将获得的断层图像按顺序导入3D可视化软件Amira 5.2(美国,Visage Imaging Inc)进行3D重构分析。
1.4 病理学分析及3D图像分析 将大鼠肝脏样品从固定液中取出,经常规脱水和石蜡包埋,切成4 μm厚连续薄片,进行天狼星红染色和CK19免疫组织化学染色,这两种染色方法分别标记胶原纤维和胆管上皮细胞,然后利用光学显微镜进行成像。观察天狼星红染色切片并计算纤维面积比来表征胶原沉积量。由1名具有10年以上临床经验的肝脏病理科副主任医师对染色切片进行观察,每组分别随机选取不重叠的20张切片作为感兴趣区。应用Image-Pro Plus 6.0(Media Cybernetics,USA)软件计算纤维面积比:利用软件将切片中的胶原纤维分割出来,计算分割的纤维面积,然后除以整张切片中肝样品的面积进而得到纤维面积比。微脉管数量的变化可以通过3D微脉管密度来表征,计算方法为:在某一断层中随机选取200像素×200像素正方形,然后连续采样200层断层图像,最后重建出一个200像素×200像素×200像素的3D感兴趣立方体,利用Amira软件计算得到立方体内微脉管的体积。将立方体内微脉管的体积除以整个立方体的体积得到体积百分比,微脉管所占体积的百分比为3D微脉管密度。两组分别随机重建不重叠的20个小立方体用于统计分析。最后将3D微脉管密度与纤维面积比进行相关性分析。
1.5 统计学方法 采用SPSS 20.0软件,符合正态分布的计量资料组间比较采用成组资料t检验,3D微脉管密度与纤维面积比进行Pearson相关分析,P<0.01表示差异有统计学意义。

图1 实验装置示意
2 结果
2.1 病理切片观察 天狼星红染色可见,在对照组中,胶原纤维仅少量地存在于汇管区周围且较为纤细(图2A)。实验组中,肝小叶结构被完全破坏,胶原增粗,大量的胶原纤维沉积于增生的脉管周围(图2B)。随着胶原沉积加剧,肝纤维化程度越来越严重,纤维面积增加,并且出现弥漫性胆管增生(图2C)。
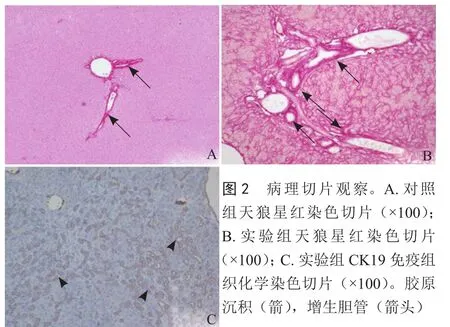
图2 病理切片观察。A.对照组天狼星红染色切片(×100);B.实验组天狼星红染色切片(×100);C.实验组CK19免疫组织化学染色切片(×100)。胶原沉积(箭),增生胆管(箭头)
2.2 肝脏微脉管结构3D可视化 对照组肝脏微脉管轮廓较为清晰,脉管分支由粗到细,整体走行较为自然,树形结构明显(图3A)。实验组肝脏3D微脉管扭曲变形严重,末支脉管杂乱,胆管增生丰富,脉管结构整体紊乱(图3B、C)。胆管结扎后,肝内胆管膨胀易于成像,且根据肝内脉管的空间解剖学结构特征,可见胆管伴行于门静脉周围(图3D),提示在肝纤维化发展过程中,除胶原沉积外,肝脏微脉管的形态和数量均发生了明显的变化。

图3 肝脏微脉管3D形态结构。A.对照组样品表面绘制与体绘制结合的3D微脉管结构;B.实验组表面绘制与体绘制结合的3D微脉管结构,可见增生胆管(箭);C. B中对应同一样品的CT图像;D. B中3D微脉管不考虑胆管增生的脉管类型分割结构。C中脉管(紫箭)对应D中的肝静脉(紫色);脉管(红箭)对应D中的门静脉(红色);脉管(绿箭)对应D中的胆管(绿色)
2.3 感兴趣立方体微脉管重建 在成像实验中,对照组由于肝内胆管不存在膨胀而无法成像,因此重建出的脉管类型只有血管(图4A)。实验组脉管类型除血管外,还包括扩张的胆管和大量增生的胆管(图4B)。与对照组相比,实验组除脉管形态发生改变外,脉管数量明显大于对照组。
2.4 3D微脉管密度与纤维面积比的相关性分析 在肝纤维化疾病中,除纤维面积会发生变化外,肝脏微脉管的数量也会发生变化。3D微脉管密度与纤维面积比的分析结果发现,对照组纤维面积比为(0.29±0.14)%,所占比例较小;而实验组纤维面积比明显增大(17.42± 4.41)%,两组纤维面积比差异有统计学意义(P<0.01),见图5A。此外,实验组的3D微脉管密度为(7.36±3.05)%,是对照组(1.02±0.35)%的7.22倍,两组间的3D微脉管密度差异有统计学意义(P<0.01),见图5B。微脉管密度和纤维面积比的变化趋势相同,实验组均高于对照组。将3D微脉管密度与胶原面积比呈正相关(r=0.812,P<0.01),表明肝脏微脉管的数量变化与纤维面积比之间具有高度相关性。

图4 感兴趣立方体3D微脉管结构重建。A.对照组感兴趣立方体微脉管重建(对应图3A中白色方框);B.实验组感兴趣立方体微脉管重建(对应图3B中白色方框),可见增生胆管(箭),门静脉与胆管伴行(箭头)。蓝色方框表示重建的200像素×200像素×200像素小立方体
3 讨论
X射线相位衬度成像作为一种全新的X射线成像技术,在肝脏成像领域得到广泛应用,尤其是肝脏微脉管成像方面[14-16]。Hu等[2]基于相位衬度成像计算出肝纤维化不同阶段的二维微脉管密度,发现随着肝纤维化的发展,纤维面积比逐渐增大,微脉管密度也逐渐增大,表明微脉管密度变化与肝纤维化程度密切相关。然而,基于二维的成像会导致肝内微脉管结构发生重叠,影响对微脉管结构的分析[17-19]。结合三维可视化,PCCT能够重建出肝纤维化不同阶段肝脏精确的微脉管结构,所能探测到的最小脉管直径能达到微米级别[4,12,20]。Hu等[20]利用PCCT成像方法探测到腹腔内注射硫代乙酰胺制备肝纤维化模型中胶原纤维组织的存在,并对肝脏3D微脉管密度进行分析,发现随着肝纤维化的发展,微脉管密度明显增大,与本研究中的胆管结扎肝纤维化模型3D脉管密度变化趋势一致。本研究利用PCCT技术,在不加造影剂的情况下,重建了胆管结扎肝纤维化模型的3D微脉管结构,基于天狼星红染色切片和重建的3D微脉管结构,定量分析了两组间3D微脉管密度和纤维面积比的变化。结果提示,随着纤维化的发展,肝纤维化微脉管密度和纤维面积比均明显增大。
在肝纤维化疾病中,胶原沉积和纤维的牵拉作用会造成肝内脉管发生形态学改变,并且随着纤维化的发展,情况愈发严重[20]。在胆管结扎诱导的肝纤维化模型中,胆管结扎会增加胆道内的阻力,从而引起结扎部位以上胆管扩张、胆汁淤积,诱发胆管增生,而在对照组中则观察不到此现象。本研究中PCCT成像能探测到的肝内脉管类型包括血管、扩张胆管和增生胆管。在肝纤维化发展中,除胶原纤维沉积会导致肝内脉管形态结构改变外,微脉管数量也发生改变。本研究利用3D微脉管密度与纤维面积比进行相关分析,结果发现纤维增生与微脉管数量的变化具有高度相关性,表明微脉管数量变化也可表征肝纤维化发展的程度。纤维面积比的计算过分地依赖复杂且有创的病理染色处理,染色操作失误、取样误差及医师的主观判断对结果准确度影响很大,而且纤维面积比是基于二维切片的计算,无法考虑肝脏微脉管的3D空间分布。而基于PCCT技术的3D微脉管密度评估肝纤维化病变程度会更有优势。考察肝纤维化微脉管密度的变化可以从一个新角度评估肝脏疾病的发展。
本研究的局限性:①胆管结扎时间选择6周是为了展现明显的肝纤维化微脉管的数量改变。但是对于疾病的有效治疗来说,肝纤维化的早期诊断非常重要。因此,以后将针对纤维化发展的不同时间进程对微脉管密度变化进行分析。②PCCT虽然能探测到增生胆管的存在,但是由于探测器分辨率的限制,无法重建出完整的管腔结构。后续实验将继续提高分辨率,探讨增生胆管的成像。此外,本研究是一个离体实验,由于受呼吸和成像视野等的影响,该技术要应用于临床成像目前还存在一些困难,但是相衬成像同步辐射造影术已经展示了其应用于活体的可能性[21]。未来如何应用于临床,有待进一步研究。
总之,本研究利用PCCT清晰展示出对照组和肝纤维化组织中的3D微脉管结构,并定量分析了微脉管密度和纤维面积比的变化及相关性。随着相衬成像的发展,PCCT作为一种放射学诊断工具,为通过微脉管变化评估肝纤维化的严重程度提供了一种新思路和方向。
[1] 段敬豪, 胡春红, 罗述谦. 基于相衬CT的肝纤维化血管三维可视化研究. 光电子﹒激光, 2012, 23(10): 2040-2044.
[2] Hu DD, Chen Y, Bihi A, et al. A new conversation between radiology and pathology-identifying microvascular architecture in stages of cirrhosis via diffraction enhanced imaging in vitro. PLoS One, 2014, 9(2): e87957.
[3] Zhao XY, Wang BE, Li XM, et al. Newly proposed fibrosis staging criterion for assessing carbon tetrachloride- and albumin complex-induced liver fibrosis in rodents. Pathol Int, 2008, 58(9): 580-588.
[4] Xuan RJ, Zhao XY, Hu DD, et al. Three-dimensional visualization of the microvasculature of bile duct ligation-induced liver fibrosis in rats by x-ray phase-contrast imaging computed tomography. Sci Rep, 2015, 5:11500.
[5] Rockey DC, Caldwell SH, Goodman ZD, et al. Liver biopsy. Hepatology, 2009, 49(3): 1017-1044.
[6] 王一娇, 唐少珊, 赵国家. 超声实时组织弹性成像评价大鼠肝纤维化分期. 中国医学影像学杂志, 2013, 21(4): 245-248.
[7] 王向阳. MR弹性成像及其临床应用. 中国医学影像学杂志, 2013, 21(5): 392-394.
[8] 伍亚军, 叶安培, 王霄英, 等. 基于MRI的动物肝脏脉管分割与三维重建. 中国医学影像技术, 2005, 21(8): 1275-1277.
[9] Momose A, Takeda T, Itai Y, et al. Phase-contrast X-ray computed tomography for observing biological soft tissues. Nat Med, 1996, 2(4): 473-475.
[10] Duan JH, Hu CH, Chen H. High-resolution micro-CT for morphologic and quantitative assessment of the sinusoid in human cavernous hemangioma of the liver. PLoS One, 2013, 8(1): e53507.
[11] Jian JB, Yang H, Zhao XY, et al. Visualization of microvasculature and thrombi by X-ray phase-contrast computed tomography in hepatocellular carcinoma. J Synchrotron Radiat, 2016, 23(2): 600-605.
[12] Duan JH, Hu CH, Luo SQ, et al. Microcomputed tomography with diffraction-enhanced imaging for morphologic characterization and quantitative evaluation of microvessel of hepatic fibrosis in rats. PLoS One, 2013, 8(10): e78176.
[13] Chen RC, Rigon L, Longo R. Quantitative 3D refractive index decrement reconstruction using single-distance phase-contrast tomography data. J Phys D Appl Phys, 2011, 44(49): 495401-495409.
[14] 周密, 谷圣美, 赵俊. 适用于三维微血管成像的定量分析方法. 北京生物医学工程, 2013, 32(2): 143-148, 168.
[15] 向秋静, 李晶, 刘苹, 等. 基于同步辐射的不同时期肿瘤新生血管形态结构定量的初步分析. 中国医疗器械杂志, 2012, 36(2): 85-89.
[16] 刘骏桢. 同步辐射X线相衬技术在肝血管成像中的研究进展. 中国医学影像学杂志, 2011, 19(12): 935-937.
[17] 李蓓蕾, 张一秋, 蔡良, 等. 同步辐射衍射增强和类同轴相衬技术离体人肝内胆管扩张成像. 中华肝脏病杂志, 2015, 23(4): 292-294.
[18] Li H, Zhang L, Wang XY, et al. Investigation of hepatic fibrosis in rats with X-ray diffraction enhanced imaging. Appl Phys Lett, 2009, 94(12): 124101-124104.
[19] Zhang X, Yang XR, Chen Y, et al. Visualising liver fibrosis by phase-contrast X-ray imaging in common bile duct ligated mice. Eur Radiol, 2013, 23(2): 417-423.
[20] Fu Y, Peng HJ, Zhang X, et al. Assessment of fibrotic tissue and microvascular architecture by in-line phase-contrast imaging in a mouse model of liver fibrosis. Eur Radiol, 2016, 26(9): 2947-2955.
[21] Lin X, Miao P, Mu Z, et al. Development of functional in vivo imaging of cerebral lenticulostriate artery using novel synchrotron radiation angiography. Phys Med Biol, 2015, 60(4): 1655-1665.
(本文编辑 饶亚岚)
Observation on Microvascular Change of Bile Duct Ligation-induced Liver Fibrosis by X-ray Phase-contrast Computed Tomography
PurposeLiver fibrosis is the common pathological process of cirrhosis developed by chronic liver disease. This study aims to explore the application of microvascular change in assessing the liver fibrosis induced by bile duct ligation based on X-ray phasecontrast computed tomography (PCCT).Materials and MethodsTen rats were equally divided into the group of bile duct ligation-induced liver fibrosis and the control group at random. Then ten excised liver tissues were imaged at beamline BL13W1 of Shanghai Synchrotron Radiation Facility in China. After the imaging studies, the liver samples were stained with Sirius red and immunostained with antibodies against cytokeratin 19 (CK19). The microvasculature in livers was reconstructed via PCCT, and the correlation analysis on microvascular density and the proportion of fibrosis area was performed.ResultsThe microvasculature including blood vessels, dilated bile ducts and ductular proliferation were clearly revealed by PCCT technology. Moreover, the 3D microvascular density and proportion of fibrosis area in the liver fibrosis group increased significantly compared with those in the control group (P<0.01), and the correlation between them was obvious (r=0.812, P<0.01).ConclusionMicrovascular 3D characteristics of liver fibrosis are well demonstrated by PCCT, and 3D microvascular density is significantly correlated with the proportion of fibrosis area. Those findings indicate that microvascular change is closely related to the degree of liver fibrosis induced by bile duct ligation, and thus it provides a novel means to assess the severity of liver fibrosis through microvascular change.
Liver cirrhosis; Tomography, X-ray computed; X-ray diffraction; Image processing, computer-assisted; Pathology; Disease models, animal; Rats, Sprague-Dawley; Male
1. 天津医科大学生物医学工程与技术学院天津 300070
2. 首都医科大学附属北京友谊医院 北京100050
胡春红
College of Biomedical Engineering, Tianjin Medical University, Tianjin 300070, China
Address Correspondence to: HU Chunhong
E-mail: chunhong_hu@hotmail.com
国家自然科学基金(81371549,81671683,81670545);天津市自然科学基金(16JCYBJC 28600);中国肝炎防治基金会-王宝恩肝纤维化研究基金资助课题(CFHPC20131033)。
R445.3;R657.3
2016-09-26
修回日期:2016-11-15
中国医学影像学杂志
2017年 第25卷 第3期:165-168,173
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 165-168, 173
10.3969/j.issn.1005-5185.2017.03.002
