体素内不相干运动与直肠腺癌预后病理因素之间的相关性
2017-06-05朱海滨ZHUHaibin
朱海滨 ZHU Haibin
李晓婷 LI Xiaoting
王 帅 WANG Shuai
孙应实 SUN Yingshi
体素内不相干运动与直肠腺癌预后病理因素之间的相关性
朱海滨 ZHU Haibin
李晓婷 LI Xiaoting
王 帅 WANG Shuai
孙应实 SUN Yingshi
目的探讨体素内不相干运动(IVIM)的D、D*、f值与直肠腺癌病理预后因素之间的相关性。资料与方法回顾性分析2015年9月—2016年7月北京大学肿瘤医院未行新辅助治疗而直接手术的86例直肠腺癌患者的影像资料,包括直肠多b值扩散加权成像(DWI)检查,测量病灶相应的D、D*、f值。根据术后病理分化程度、T/N分期、脉管神经侵犯状态、表皮生长因子受体(EGFR)及人表皮生长因子受体-2(Her-2)表达水平进行分组,分析各定量参数与肿瘤病理学指标的关系。结果直肠腺癌不同分化程度(高、中、低)的D值分别为(0.541±0.093)×10-3mm2/s、(0.490±0.156)×10-3mm2/s、(0.342±0.147)×10-3mm2/s, 差异有统计学意义(P<0.05);直肠腺癌脉管神经侵犯组D值为(0.511±0.154)×10-3mm2/s,未受侵犯组D值为(0.387±0.130)×10-3mm2/s,差异有统计学意义(P<0.05)。不同病理T、N分期肿瘤D、D*、f值差异无统计学意义(P>0.05)。EGFR及Her-2高表达组的f值均高于低表达组(0.379±0.076比0.298±0.099、0.356±0.097比0.298±0.098),差异有统计学意义(P<0.05)。结论直肠腺癌IVIM定量参数可望无创地评估肿瘤的生物学行为并预测患者的预后。
直肠肿瘤;腺癌;磁共振成像;扩散加权成像;表观扩散系数;受体,表皮生长因子;基因,erbB-2;预后
MR扩散加权成像(DWI)是一种功能MRI技术,可以定量计算表观扩散系数(ADC)值间接反映水分子的微观运动[1]。Le Bihan等[2]在1986年提出的体素内不相干运动成像(intravoxel incoherent motion,IVIM)理论,采用多b值扫描、双指数扩散衰减模型计算,可将分子的扩散和灌注效应相分离,使体素内水分子的扩散更接近生物组织的实际特征。IVIM参数包括纯扩散系数(D)、灌注分数(f)、灌注相关假扩散系数(D*)。D值可以更真实地反映组织内水分子的扩散;D*值及f值则反映组织的灌注信息。直肠癌分化程度、T/N分期、脉管神经侵犯状态及表皮生长因子受体(epidermal growth factor receptor,EGFR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)表达水平是评价其侵袭性的重要指标,也是影响患者预后的主要因素,对于选择合适的治疗策略至关重要[3]。本研究旨在探讨盆腔MR的IVIM各定量参数与直肠腺癌主要病理预后因素的关系,以期为临床诊治提供参考。
1 资料与方法
1.1 研究对象 回顾性收集2015年9月-2016年7月北京大学肿瘤医院接诊的直肠腺癌患者86例,其中男56例,女30例;年龄18~82岁,中位年龄59岁。纳入标准:①术前未接受放、化疗且有完整MRI资料;②MRI检查后1周内接受手术治疗;③术后病理确诊为直肠腺癌。排除标准:①有既往盆腔手术史;②伴有其他肿瘤并接受过盆腔放疗和(或)化疗;③MRI图像缺失或无法测量;④直肠黏液腺癌和印戒细胞癌。
1.2 仪器与方法 检查前在无禁忌证(青光眼、前列腺过度肥大或严重心脏病)的情况下,肌内注射盐酸山莨菪碱20 mg,使肠道处于低张状态。采用GE Signa Horizon HDXT 3.0 T MR扫描仪和8通道相控阵腹部线圈,线圈中心定位于耻骨上缘。
多b值DWI采用单激发自旋回波平面成像(SEEPI)序列,采用12个b值(0、20、50、100、200、400、600、800、1000、1200、1400及 1600 s/mm2),激励次数分别为1、1、1、1、1、2、2、2、4、4、6、8。TR 2800 ms,TE 70 ms;反转恢复时间 240 s;矩阵128×128;视野 340 mm×272 mm;层厚 4 mm;间距1 mm。图像为轴位采集,覆盖全部肿瘤区域,总扫描时间为4.5 min。每个多b值DWI序列后扫描轴位及矢状位、冠状位T2WI序列。
增强扫描对比剂采用钆喷替酸葡甲胺,经高压注射器以3.0 ml/s注射(0.1 mmol/kg),随后注射20 ml生理盐水。
1.3 图像处理 由2位放射科主治医师采用盲法共同在GE AW 4.6工作站采用Functool-MADC软件进行DWI图像处理,得到D、 D*及f值。感兴趣区(ROI)在b=800 s/mm2的图像上手动勾画,选取肿瘤最大层面,重复测量3次并取平均值;勾画时参考相应层面T2WI、动态增强MRI(dynamic contrast enhanced MRI,DCEMRI)图像以确定肿瘤边界,勾画时避开黏液、坏死、囊变及出血区,区域内不包括肠腔、伪影和血管。
1.4 病理学分析 所有患者均接受根治性切除手术。依据国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)制订的第7版肿瘤TNM分期[4]为标准。肿瘤分化程度、是否伴有脉管神经侵犯等相关信息均由术后病理报告获得。
EGFR染色依据阳性细胞所占比例分为4级,0:肿瘤细胞无着色;+:肿瘤细胞着色比例<25%;++:肿瘤细胞着色比例25%~50%;+++:肿瘤细胞着色比例>50%。参照美国临床肿瘤协会/美国病理医师协会提出的Her-2检测指南[5],Her-2的表达状态也可分为4级,0:肿瘤细胞无着色或≤10%的肿瘤细胞膜染色;+:>10%的肿瘤细胞有微弱或隐约可见的细胞膜着色;++:>10%的肿瘤细胞有弱到中度的基底侧膜、侧膜或完全性染色;+++:>10%肿瘤细胞基底侧膜、侧膜或完全性膜较强着色。根据EGFR、Her-2免疫组织化学结果将患者分为低表达组(0、+、++)、高表达组(+++)[5-6]。
1.5 统计学方法 采用SPSS 17.0软件,连续变量数据以±s表示,肿瘤分化程度、T/N分期组间的IVIM参数值比较采用单因素方差分析及LSD检验;脉管神经侵犯状态及EGFR、Her-2状态组间IVIM参数值比较均采用两独立样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 IVIM定量参数与直肠癌分化程度、脉管癌栓及病理分期的关系 ①直肠癌分化程度:D值随着组织学分化程度增高而逐渐增高,差异有统计学意义(P<0.01);D*及f值差异均无统计学意义(P>0.05)。②病理分期:f值随T、N分期的增加呈现逐渐递增趋势,但差异无统计学意义(P>0.05);不同T、N分期的D、D*值差异无统计学意义(P>0.05)。③脉管神经侵犯:脉管神经侵犯组D值高于未侵犯组,差异有统计学意义(P<0.05);而相应D*及f值差异均无统计学意义(P>0.05)。见表1。
表1 IVIM定量参数与直肠癌分化程度的关系(±s)

表1 IVIM定量参数与直肠癌分化程度的关系(±s)
指标 例数 D值(×10-3mm2/s) D*值(×10-3mm2/s) f值分化程度高4 0.541±0.093 14.9±3.48 0.259±0.017中67 0.490±0.156 23.2±11.2 0.304±0.099低15 0.342±0.147 27.4±13.9 0.343±0.109 F值 6.643 2.010 1.498 P值 <0.05 >0.05 >0.05脉管神经侵犯无55 0.387±0.130 23.2±11.1 0.298±0.099有31 0.511±0.154 24.2±12.8 0.327±0.100 t值 3.773 -0.393 -1.268 P值 <0.05 >0.05 >0.05 T分期T1 5 0. 512±0.093 22.9±12.3 0.261±0.067 T2 19 0. 431±0.152 23.3±13.2 0.293±0.102 T3 56 0. 472±0.157 24.2±11.5 0.315±0.099 T4 6 0. 506±0.218 20.8±9.2 0.336±0.130 F值 0.609 0.148 0.764 P值 >0.05 >0.05 >0.05 N分期N0 50 0.479±0.143 22.2±10.4 0.289±0.095 N1 24 0.481±0.181 25.7±12.2 0.324±0.102 N2 12 0.384±0.149 25.1±15.2 0.358±0.103 F值 1.990 0.859 2.796 P值 >0.05 >0.05 >0.05
2.2 IVIM定量参数与免疫组织化学状态的关系EGFR及Her-2高表达组肿瘤的f值均明显高于低表达组(P<0.05),而两组间D及D*值差异均无统计学意义(P>0.05)。见表2、图1、2。
表2 IVIM定量参数与直肠癌组织EGFR及Her-2状态的关系(±s)

表2 IVIM定量参数与直肠癌组织EGFR及Her-2状态的关系(±s)
指标 例数 D值(×10-3mm2/s) D*值(×10-3mm2/s) f值EGFR状态高表达 11 0.450±0.101 19.6±10.1 0.379±0.076低表达 75 0.469±0.164 24.1±20.8 0.298±0.099 P值 >0.05 >0.05 <0.05 Her-2状态高表达 15 0.406±0.139 21.2±11.1 0.356±0.097低表达 71 0.479±0.158 24.1±11.8 0.298±0.098 P值 >0.05 >0.05 <0.05
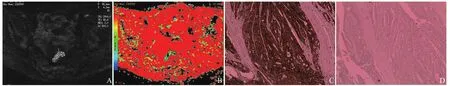
图1 男,66岁,直肠上段中分化腺癌。轴位DWI(b=800 s/mm2)示病灶呈中等至稍高信号(A);平均f值为0.256(ROI内,B);EGFR染色(+)(EnVision法,×200,C); Her-2染色(0)(Ventana仪器染色,×200,D)
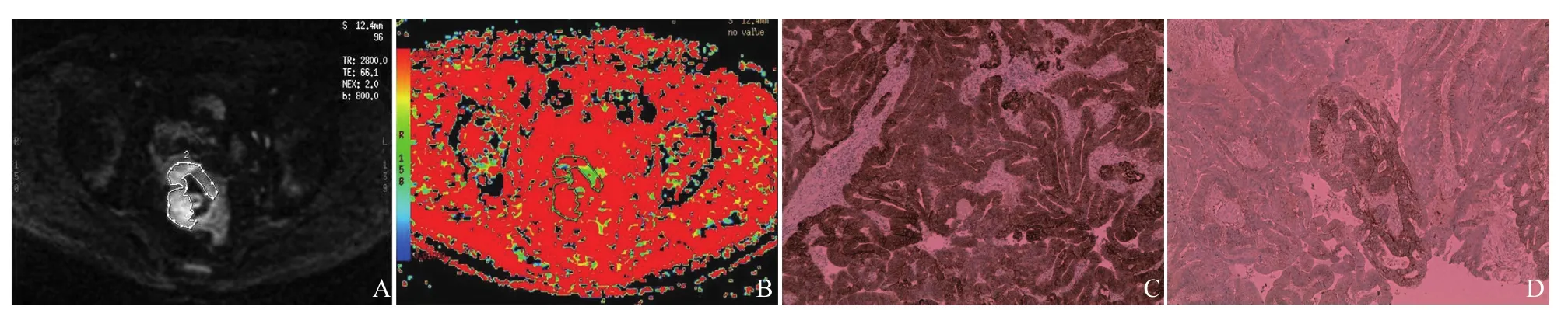
图2 男,48岁,直肠上段低分化腺癌。轴位DWI(b=800 s/mm2)示病灶呈明显高信号(A);平均f值为0.461(ROI内,B);EGFR染色(+++)(EnVision法,×200,C);Her-2染色(++)(Ventana仪器染色,×200,D)
3 讨论
本研究显示,D值在直肠腺癌不同分化程度差异有统计学意义(P<0.05),即肿瘤分化程度越低,D值越低,与Aoyagi等[7]的报道基本一致,说明可以借助于D值的变化来鉴别不同直肠腺癌的分化程度,其原因可能是肿瘤分化程度越低,其细胞的异型性越显著,肿瘤细胞密度增加,同时细胞外间隙结构改变如间隙内成纤维细胞、浆细胞、淋巴细胞及中性粒细胞增多导致细胞外间隙减少,故影响水分子扩散受限,D值下降。
肿瘤的浸润深度及淋巴结转移情况是提示患者预后的重要指标。目前关于单指数模型ADC值与直肠癌的T、N分期是否具有相关性仍存在较大争议。Sun等[8]研究认为直肠癌不同病理T、N分期间相应ADC值差异有统计学意义。本研究中,尽管f值随直肠腺癌T、N分期提高有增加趋势,但差异无统计学意义(P>0.05);同时,相应D及D*值差异也无统计学意义(P>0.05),与既往研究[9-10]一致。肿瘤T、N分期增加,肿瘤细胞异型性、数目及细胞内、外间隙可能未发生明显变化,即肿瘤组织内部的微观结构未发生显著变化,而仅仅是浸润深度增加,这一推测还有待结合病理学研究进一步证实[11]。导致这种争议的原因可能与T4期患者多数因为行新辅助放化疗而未纳入本研究有关;也可能与不同T3亚分期患者组成不同,T3期直肠癌具有很强的异质性,其系膜侵犯距离不同,5年生存率有较大差别,肿瘤特异性生存率为54%~85%[12]。关于T3亚分期与IVIM定量参数间的相关性研究仍需要多中心、大样本研究证实。
肿瘤脉管神经侵犯状态是病变发生淋巴结转移及远处转移的关键,Hogan等[13]研究提示脉管神经侵犯患者发生淋巴结转移的概率显著提高(59%比25%,P<0.001),5年生存率显著下降(24%比5%,P<0.001)。本研究显示脉管神经侵犯组相应D值高于未侵犯组(P<0.05),D值可以用来判断肿瘤对脉管神经的侵袭性,为临床进一步诊治提供依据。
EGFR和Her-2是促进直肠癌发生、发展的重要分子生物学标志物,其高表达可促进肿瘤细胞的增殖、血管生成,与肿瘤侵袭和转移密切相关,是直肠癌预后不良的独立危险因子。EGFR和Her-2表达水平可以用于预测肿瘤治疗的疗效,具有EGFR高表达的直肠癌患者可能对抑制EGFR信号通路的靶向药物(如西妥昔单抗、吉非替尼)更敏感,而Her-2过度表达的直肠癌患者可能在曲妥珠单抗(赫赛汀)靶向治疗中获益[14-15]。然而,必须在直肠癌术后才能进行Her-2和EGFR的免疫组织化学检测。DWI是目前临床中广泛应用的技术、无创的影像学检查方法,结合IVIM模型可定量测量D、D*及f值。本研究对IVIM定量参数与分子生物学标志物EGFR、Her-2的关系进行分析,结果显示EGFR、Her-2低表达组相应肿瘤f值均低于高表达组,差异有统计学意义(P<0.05)。既往研究尝试通过应用DCE-MRI定量参数区分不同直肠癌EGFR的表达水平,其结果提示更高的k21和更小的达峰时间可能用来区分EGFR的表达水平[16-17],与本研究结果类似,由于f值反映组织内毛细血管的丰富程度,提示灌注参数可能与EGFR和Her-2表达水平相关。
本研究存在一定的局限性:①多项研究证实b值的选择对IVIM的结果会产生显著影响,一般小于200 s/mm2的b值应尽可能多一些,而高b值上限一般为1000 s/mm2[18-19],但本研究中的高b值上限达到1600 s/mm2,可能会影响IVIM结果。②仅收集了直肠腺癌而排除了黏液腺癌和印戒细胞癌,可能对结果造成选择偏倚。③ROI的选择可能对结果有较大影响。本研究中采用的是手动勾画最大层面ROI,而非全肿瘤ROI和实性肿瘤取样ROI。因为ROI的大小、位置均会对观察者间的一致性产生较大影响,关于不同ROI选择对于结果的影响仍需进一步研究。
总之,直肠癌IVIM定量参数与直肠癌病理预后因子具有一定的相关性,通过无创检查更为便捷地预估直肠癌的生物学行为,为直肠癌的个体化治疗方案及预后评估提供客观量化指标。
[1] Schnapauff D, Zeile M, Niederhagen MB, et al. Diffusionweighted echo-planar magnetic resonance imaging for the assessment of tumor cellularity in patients with soft-tissue sarcomas. J Magn Reson Imaging, 2009, 29(6): 1355-1359.
[2] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1988, 168(2): 497-505.
[3] Boras Z, Kondza G, Sisljagić V, et al. Prognostic factors of local recurrence and survival after curative rectal cancer surgery: a single institution experience. Coll Antropol, 2012, 36(4): 1355-1361.
[4] Kim MS, Hur H, Min BS, et al. Clinical outcomes for rectal carcinoid tumors according to a new (AJCC 7th edition) TNM staging system: a single institutional analysis of 122 patients. J Surg Oncol, 2013, 107(8): 835-841.
[5] Wolff AC, Hammond ME, Schwartz JN, et al. American society of clinical oncology/college of american pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med, 2007, 131(1): 18-43.
[6] Linggi B, Carpenter G. ErbB receptors: new insights on mechanisms and biology. Trends Cell Biol, 2006, 16(12): 649-656.
[7] Aoyagi T, Shuto K, Okazumi S, et al. Apparent diffusion coefficient correlation with oesophageal tumour stroma and angiogenesis. Eur Radiol, 2012, 22(6): 1172-1177.
[8] Sun Y, Tong T, Cai S, et al. Apparent diffusion coefficient (ADC) value: a potential imaging biomarker that reflects the biological features of rectal cancer. PLoS One, 2014, 9(10): e109371.
[9] Curvo-Semedo L, Lambregts DM, Maas M, et al. Diffusionweighted MRI in rectal cancer: apparent diffusion coefficient as a potential noninvasive marker of tumor aggressiveness. J Magn Reson Imaging, 2012, 35(6): 1365-1371.
[10] Akashi M, Nakahusa Y, Yakabe T, et al. Assessment of aggressiveness of rectal cancer using 3-T MRI: correlation between the apparent diffusion coefficient as a potential imaging biomarker and histologic prognostic factors. Acta Radiol, 2014, 55(5): 524-531.
[11] 张森, 康钰, 杜湘珂. 扩散加权成像评估结直肠癌区域淋巴结转移预后相关因素分析. 中国医学影像学杂志, 2015, 23(7): 513-516, 522.
[12] Merkel S, Mansmann U, Siassi M, et al. The prognostic inhomogeneity in pT3 rectal carcinomas. Int J Colorectal Dis, 2001, 16(5): 298-304.
[13] Hogan J, Chang KH, Duff G, et al. Lymphovascular invasion: a comprehensive appraisal in colon and rectal adenocarcinoma. Dis Colon Rectum, 2015, 58(6): 547-555.
[14] Ålgars A, Lintunen M, Carpén O, et al. EGFR gene copy number assessment from areas with highest EGFR expression predicts response to anti-EGFR therapy in colorectal cancer. Br J Cancer, 2011, 105(2): 255-262.
[15] Park DI, Kang MS, Oh SJ, et al. HER-2/neu overexpression is an independent prognostic factor in colorectal cancer. Int J Colorectal Dis, 2007, 22(5): 491-497.
[16] Yeo DM, Oh SN, Jung CK, et al. Correlation of dynamic contrast-enhanced MRI perfusion parameters with angiogenesis and biologic aggressiveness of rectal cancer: preliminary results. J Magn Reson Imaging, 2015, 41(2): 474-480.
[17] Lollert A, Junginger T, Schimanski CC, et al. Rectal cancer: dynamic contrast-enhanced MRI correlates with lymph node status and epidermal growth factor receptor expression. J Magn Reson Imaging, 2014, 39(6): 1436-1442.
[18] Lemke A, Stieltjes B, Schad LR, et al. Toward an optimal distribution of b values for intravoxel incoherent motion imaging. Magn Reson Imaging, 2011, 29(6): 766-776.
[19] 周立绥, 杜勇, 杨汉峰. 体素内相位不相干运动成像原理及其在腹部的研究进展. 中国医学影像学杂志, 2015, 23(5): 391-393.
(本文编辑 周立波)
Correlation Between Intravoxel Incoherent Motion and Prognostic Factors of Rectal Cancer
PurposeTo explore the correlation between quantitative parameters from intravoxel incoherent motion (IVIM) with prognostic factors of rectal adenocarcinoma.Materials and MethodsEighty-six patients with rectal adenocarcinoma who were underwent surgery without neoadjuvant therapy in our hospital between September 2015 and July 2016 were selected in this retrospective study. The image data included multiple b-values diffusion weighted imaging (DWI) examination and the corresponding D, D* and f values of the lesions. Relationships between the quantitative parameters and tumor pathology indexes including histological differentiation grade, tumor T/N stage, lymphangiovascular invasion state, the expression level of epidermal growth factor receptor (EGFR) and human epidermal growth factor receptor-2 (Her-2) were assessed.ResultsThe average D values of different differentiation degree (high, middle and low) of rectal adenocarcinoma were (0.541±0.093)×10-3mm2/s, (0.490±0.156)×10-3mm2/s and (0.342±0.147)×10-3mm2/s, and the difference was statistically significant (P<0.05). The D values were significantly different between the lymphangiovascular invasion and non invasion state [(0.511±0.154)× 10-3mm2/s vs (0.387±0.130)×10-3mm2/s, P<0.05)]. However, there were no significant differences in the mean D, D* and f values among different tumor T/N stage (P>0.05). The average f value of EGFR or Her-2 high expression group was higher than that of low expression group (0.379±0.076 vs 0.298±0.099, P<0.01; 0.356±0.097 vs 0.298±0.098, P<0.05, respectively).ConclusionQuantitative parameters of IVIM in rectal adenocarci-noma can be used as noninvasive imaging biomarkers to predict the biologic behavior of tumor and the prognosis of the patients.
Rectal neoplasms; Adenocarcinoma; Magnetic resonance imaging; Diffusion weighted imaging; Apparent diffusion coefficient; Receptor, epidermal growth factor; Genes, erbB-2; Prognosis
北京大学肿瘤医院医学影像科,北京肿瘤医院暨北京市肿瘤防治研究所,恶性肿瘤发病机制及转化研究教育部重点实验室北京 100142
孙应实
Department of Radiology, Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Peking University Cancer Hospital & Institute, Beijing 100142, China
Address Correspondence to: SUN Yingshi
E-mail: sunys27@163.com
R445.2;R735.3
2016-10-17
修回日期: 2016-12-22
中国医学影像学杂志
2017年 第25卷 第3期:211-215
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 211-215
10.3969/j.issn.1005-5185.2017.03.013
