超声造影定量分析失血性休克复苏期肾血流灌注的动物实验
2017-06-05何晶玲HEJingling
何晶玲HE Jingling
王莎莎2WANG Shasha
龙春艳2LONG Chunyan
魏 芳2WEI Fang
刘锐洪2LIU Ruihong
李叶阔1,2LI Yekuo
超声造影定量分析失血性休克复苏期肾血流灌注的动物实验
何晶玲1,2HE Jingling
王莎莎2WANG Shasha
龙春艳2LONG Chunyan
魏 芳2WEI Fang
刘锐洪2LIU Ruihong
李叶阔1,2LI Yekuo
目的超声造影(CEUS)是一种无创性检查技术,可监测器官的血流灌注,本研究探讨CEUS定量监测失血性休克(HS)复苏期肾血流灌注的价值。材料与方法采用前瞻性研究方法,将40只健康新西兰大耳白兔随机分为5 组,选1组为正常对照组(T1);其余采用Wiggers改良法建立HS模型,选1组为休克组(T2),其余按复苏治疗时间分为复苏2 h组(T3)、复苏6 h组(T4)、复苏24 h组(T5)。均进行CEUS检查,获取定量参数峰值强度(A)、达峰时间(TTP)、曲线下面积(AUC)和上升支斜率(Grad),并分析上述参数与病理结果的相关性。结果与T1组比较,T2组TTP延长,A、AUC 及Grad减低(P<0.05),成功建立HS模型。与T2组比较,T3、T4组A、AUC及Grad增加(P<0.05),TTP不缩短(P>0.05)。T5组与T2组比较各参数差异均有统计学意义(P<0.05),与T1组比较各参数差异均无统计学意义(P>0.05),提示复苏后各灌注参数逐渐恢复。病理结果显示,复苏后肾小管上皮细胞肿胀及血管充血病理改变逐渐恢复。结论CEUS能有效地定量评价HS复苏期肾血流灌注的改变,是一种无创性的监测方法。
休克,出血性;复苏术;超声检查;造影剂;血液灌注;肾循环;疾病模型,动物;兔
失血性休克(hemorrhagic shock,HS)是临床常见的急危重症,若不及时处理,可导致多器官功能障碍综合征(multiple organ disfunction syndrome,MODS)[1]。全世界每年超过500 万人死于创伤,其中近40%的死因归于HS或其诱发的MODS[2]。复苏指南中提出改善组织微循环灌注不足、维持良好的氧气供应是关键,而血压、心率等监测指标正常时,仍存在潜在的微循环灌注不足[3]。因此,早期有效的监测有利于指导和调整治疗方案,改善预后。本研究通过建立兔HS及复苏模型,应用超声造影(contrast-enhanced ultrasound,CEUS)定量分析肾血流灌注的表现规律,探讨CEUS在评估休克复苏状态下肾微循环灌注的应用价值。
1 材料与方法
1.1 实验动物 40 只新西兰大白兔,体重(2.78±0.33)kg,雌雄不限[广州军区广州总医院动物实验中心提供,SYXK(粤)2014-0100]。3%戊巴比妥钠(德国默克公司)1 ml/kg麻醉后备皮、固定,耳缘静脉置入留置针作为造影剂注射通道。注射200 U/kg肝素钠(江苏万邦生化医药股份有限公司)肝素化。本研究经广州军区广州总医院实验动物伦理委员会批准。
1.2 动物模型及分组 分离兔右侧颈动脉并插管,经有创血压传感器连接心电监护仪(广东宝莱特医用科技股份有限公司);左侧股静脉作为输液通道,复苏液体是比例为2∶1的晶体、胶体[4](乳酸钠林格注射液,华仁药业股份有限公司;羟乙基淀粉130/0.4氯化钠注射液,北京费森尤斯卡比医药有限公司)。根据Wiggers改良法[5]建立可逆性失血性休克模型,经右侧股动脉放血,速度为2.0 ml/(kg·min),平均动脉压(mean arterial pressure,MAP)稳定在(39.10±2.18) mmHg,放血量为(69.33±8.38) ml,维持1 h后补液,速度与放血速度保持一致,MAP维持于80 mmHg为复苏成功。
实验兔随机分为5 组,随机选择1 组为正常对照组(T1);其余4组均建立HS模型,选其中1组作为休克组(T2),其余3组进行复苏治疗,根据复苏时间的不同,分为复苏2 h组(T3)、复苏6 h组(T4)、复苏24 h组(T5)。
1.3 仪器与方法 应用GE Logiq-E9超声诊断仪,9L-D探头,频率6~9 MHz,造影过程中保持仪器设置一致(输出功率10%,频率Gen,机械指数0.14,增益90%,聚焦深度4 cm)。造影剂SonoVue(Bracco公司)加5 ml注射用生理盐水,振荡形成微泡混悬液(浓度为SF68 μl/ml,pH值4.5~7.5,与人体血浆等渗(287 mOsm/kg)。经兔耳缘静脉团注混悬液0.1 ml/kg,尾推1 ml生理盐水冲管。选取右侧肾脏最大截面,团注造影剂时启动图像采集,观察100 s变化,存储数据以备分析。
应用时间-强度曲线(time-intensity curve,TIC)软件进行定量分析,设置感兴趣区(ROI,直径3 mm的椭圆形取样框)于与声束垂直的外层肾皮质,获得TIC曲线,选择伽马拟合F(t)=AtCexp(-kt)+B得出定量参数,包括峰值强度(amplitude of peak intense,A)、达峰时间(time to peak,TTP)、曲线下面积(AUC)、上升支斜率(curve rising slope rate,Grad)。行CEUS检查后记录心电监护仪上MAP、HR、血氧饱和度(oxygen saturation,SaO2)、呼吸频率(respiration rate,RR)等生理指标,即刻处死动物取部分肾组织作病理切片,观察组织病理变化。
1.4 统计学方法 采用SPSS 20.0软件,计量资料均以±s表示,采用单因素方差分析各组生理指标及肾血流灌注参数,组间比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果
2.1 生理指标比较 与T1组相比,T2组MAP、SaO2水平明显降低,HR、RR加快,差异有统计学意义(P<0.05)。复苏后上述指标逐渐恢复。见表1。
2.2 CEUS表现 团注造影剂后,T1组的肾各级动脉、皮质呈放射状快速充盈,髓质随之向中间缓慢充盈,达峰时皮质显影已逐渐消退。T2组动物造影增强模式同前,但肾动脉分支显影呈“枯枝状”变细,达峰及消退时间延迟。复苏后,造影剂沿肾各级动脉分支迅速显影,微小分支血流丰富,实质血流灌注迅速达高峰。
2.3 CEUS定量分析 T1组TIC迅速上升达峰值,反映了造影剂微泡在肾微循环灌注的渡越过程(图1)。T2组曲线上升缓慢,A值降低,TTP延迟。复苏后曲线逐渐恢复如前。TIC各定量参数结果显示:与T1组比较,T2组TTP延长,A、AUC及Grad减低,差异有统计学意义(P<0.05);T3、T4组TTP延长、Grad减低,差异有统计学意义(P<0.05);至复苏24 h各参数差异均无统计学意义(P>0.05)。与T2组比较,T3、T4组A、AUC及Grad增加,差异有统计学意义(P<0.05),TTP差异无统计学意义(P>0.05);随着复苏的进展,至复苏24 h各参数差异均有统计学意义(P<0.05)。见表2。
2.4 病理结果 正常状态下,肾小球、肾小管结构未见明显病理改变(图3A),休克后肾小球结构未见硬化及萎缩改变,肾小管上皮细胞肿胀,间质中可见炎症细胞浸润,血管内明显充血(图3B);复苏2 h肾小管上皮细胞肿胀不明显,偶见少量炎症细胞,肾血管充血较前减轻(图3C);随着复苏时间的延长,肾小管上皮细胞肿胀及血管充血等病理改变得到恢复(图3D、E)。
表1 各组实验兔基本情况及生理指标比较(±s)
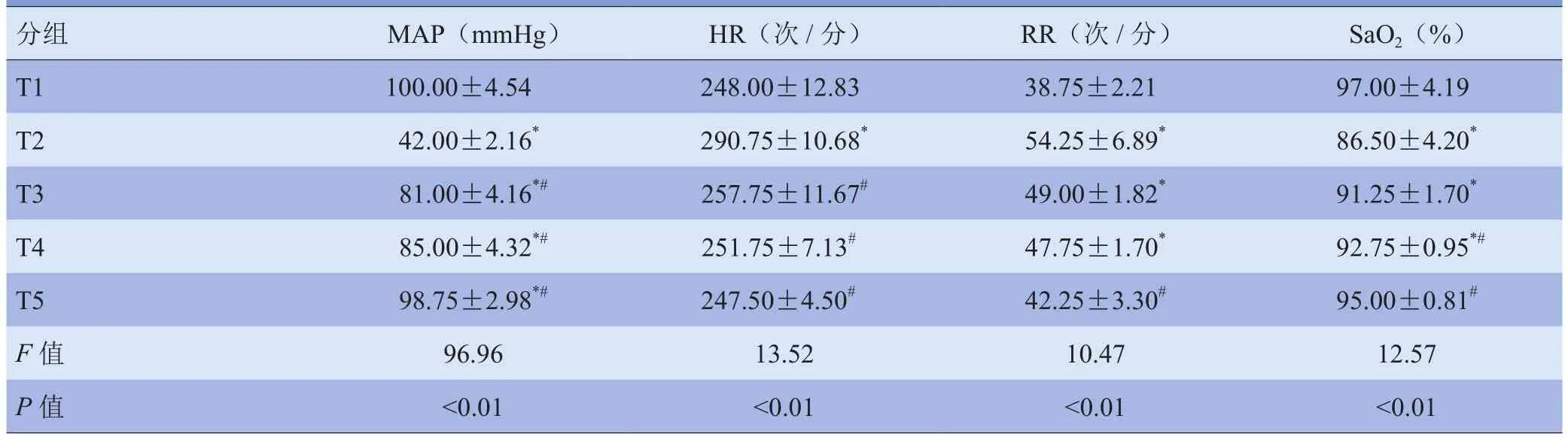
表1 各组实验兔基本情况及生理指标比较(±s)
注:与T1组比较,*P<0.05;与T2组比较,#P<0.05
分组 MAP(mmHg) HR(次/分) RR(次/分) SaO2(%)T1 10 0.00±4.54 248.00±12.83 38.75±2.21 97.00±4.19 T2 42.00±2.16* 290.75±10.68* 54.25±6.89* 86.50±4.20*T3 81.00±4.16*# 257.75±11.67# 49.00±1.82* 91.25±1.70*T4 85.00±4.32*# 2 51.75±7.13# 47.75±1.70* 92.75±0.95*#T5 98.75±2.98*# 2 47.50±4.50# 42.25±3.30# 95.00±0.81#F值 96.96 13.52 10.47 12.57 P值 <0.01 <0.01 <0.01 <0.01

图1 ROI(箭)处获取的T1组TIC曲线
表2 各组实验兔肾皮质CEUS定量参数(±s)
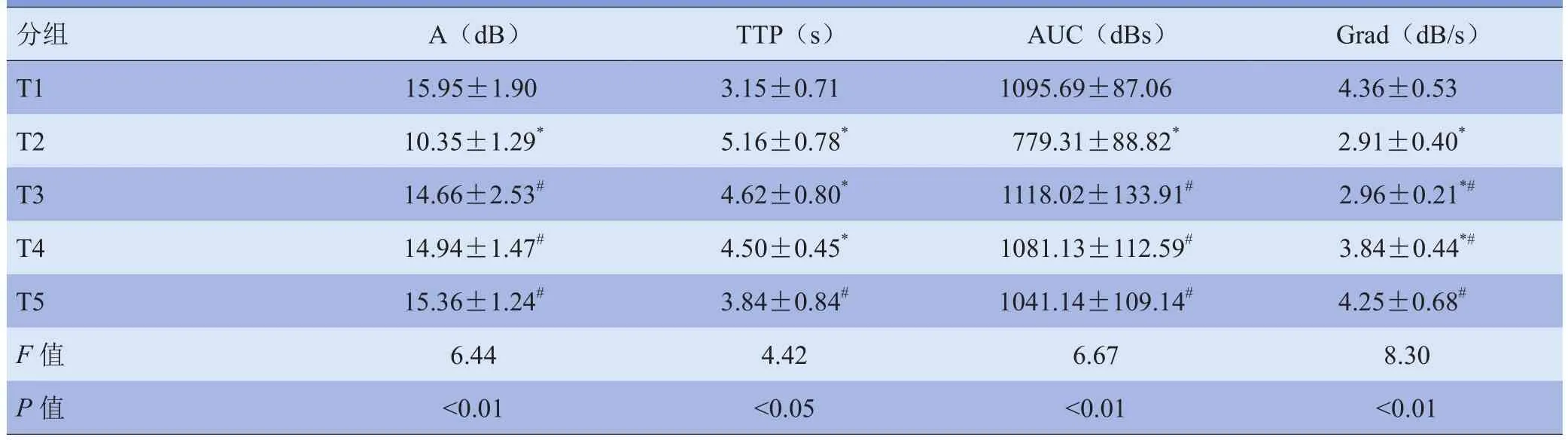
表2 各组实验兔肾皮质CEUS定量参数(±s)
注:与T1组比较,*P<0.05;与T2组比较,#P<0.05
分组 A(dB) TTP(s) AUC(dBs) Grad(dB/s)T1 15.95±1.90 3.15±0.71 1 095.69±87.06 4 . 36±0.53 T2 10.35±1.29* 5.16±0.78* 779.31±88.82* 2 .91±0.40*T3 14.66±2.53# 4.62±0.80* 1118.02±133.91# 2.96±0.21*#T4 14.94±1.47# 4.50±0.45* 1081.13±112.59# 3.84±0.44*#T5 15.36±1.24# 3.84±0.84# 1041.14±109.14# 4.25±0.68#F值 6.44 4.42 6.67 8.30 P值 <0.01 <0.05 <0.01 <0.01

图3 各组肾组织切片HE染色(×200)。T1组(A);休克后肾间质炎症细胞浸润、充血(箭,B);T3组(C);T4组(D);T5组(E)
3 讨论
评价肾血流动力学的影像学方法有CT灌注成像、MRI灌注成像、核素显像及超声造影,前3种检查方法因造影剂有一定的肾毒性、有放射性的危害或仪器限制无法用于床旁等原因限制了其临床应用。而超声具有便捷、实时、无辐射和重复性好的特点,更方便用于床旁检查和重症监护[6]。肾脏血供丰富,肾皮质血流量约占整个肾脏的90%,准确地定量评价肾脏的血流灌注对HS的诊疗有非常重要的意义。目前CEUS在评价肾血流灌注的应用主要在肾移植、肾肿瘤、肾慢性疾病等方面[7-8],对休克复苏的肾实质血流灌注研究较少。前期研究证实,CEUS能准确地评价不同等级HS的肾血流灌注改变[9]。本研究通过建立HS及复苏动物模型,探讨CEUS定量分析技术在评估肾微循环灌注中的应用价值。
本研究结果显示T2组与T1组比较,生理指标及肾血流灌注各参数差异均有统计学意义(P<0.05),表明HS模型建立成功。A值为ROI内造影剂微泡含量达最高峰时的强度。AUC值为渡越过程中TIC的AUC,是一定时间内造影剂强度的积分值。休克后,血容量减少,血压下降,为优先保证脑组织和心脏的血供[1],心脏功能加强同时使血液重新分布,同时压力感受器的负反馈调节冲动减弱,外周血管收缩,肾血流灌注减少,到达肾皮质的微泡数量也减少,表现为A、AUC减少。TTP值为ROI内从出现造影剂至达峰值强度的时间,Grad值为造影剂开始增强的上升速率。缺血、缺氧刺激使组胺、前列腺素等物质释放增多,毛细血管通透性增加,血液浓缩[10];血流速度减慢,红细胞聚集;灌流压力下降,使白细胞黏附于内皮细胞,堵塞毛细血管[11],加重微循环灌注下降,导致肾皮质血流阻力增加,使造影剂到达时间延长,速度减慢,表现为TTP延长,Grad降低。病理结果与之相符,表现为休克后肾脏充血及少许炎症细胞浸润、肾小管上皮细胞肿胀等病理改变。
复苏后动物肾上腺素、去甲肾上腺素和血管紧张素的浓度降低,解除了血管痉挛,降低外周阻力,松弛血管平滑肌,扩张小血管及毛细血管前括约肌,肾血流灌注逐步恢复,表现为A、AUC增加,表明肾血流灌注得以改善。其中T3组AUC较T1组增加,其原因为淤滞于微血管、间质内的炎症细胞吞噬了微泡,导致微泡廓清速度减慢,而微泡仍具有声学活性而被检测到;中性粒细胞和血小板黏附被抑制,血液稀释,加快血液流动,改善了微循环[12],表现为TTP逐渐减低、Grad增加。T5组与T1组比较,各参数差异无统计学意义(P>0.05),表明液体复苏改善了肾微循环灌注。AUC与微泡数量及血流速相关,A及TTP等参数变化也引起了AUC的改变, AUC为反映血流灌注的敏感指标,这与Lucidarme等[13]的研究结果一致。结果显示,复苏可有效地改善肾组织的血流灌注,降低组织耗氧,提高氧摄取,减轻由于组织缺氧引起的细胞水肿,病理结果与之相符。
本研究存在一定的局限性,首先动物模型是建立在麻醉及肝素化前提下,这与临床实际不符;其次建立了一个相对简单的定压型 HS模型,选取具有代表性的复苏药物,而临床情况更为复杂。
总之,CEUS能无创、准确、便捷地监测失血性休克复苏期肾微循环灌注的变化,应用TIC定量分析技术进行量化,可为临床诊断和治疗HS提供一种新的无创性检查方法。
[1] Bonanno FG. Hemorrhagic shock: the "physiology approach". J Emerg Trauma Shock, 2012, 5(4): 285-295.
[2] O'Reilly D, Mahendran K, West A, et al. Opportunities for improvement in the management of patients who die from haemorrhage after trauma. Br J Surg, 2013, 100(6): 749-755.
[3] 中华医学会重症医学分会. 低血容量休克复苏指南(2007).中国实用外科杂志, 2007, 27(8): 581-587.
[4 ] 蔡建强, 陈凛. 失血性休克液体治疗推荐方案. 中国实用外科杂志, 2011, 31(7): 628.
[5] Lomas-Niera JL, Perl M, Chung CS, et al. Shock and hemorrhage: an overview of animal models. Shock, 2005, 24(1): 33-39.
[6] Schneider A, Johnson L, Goodwin M, et al. Bench-to-bedside review: contrast enhanced ultrasonography-a promising technique to assess renal perfusion in the ICU. Crit Care, 2011, 15(3): 157.
[7] Ma F, Cang Y, Zhao B, et al. Contrast-enhanced ultrasound with SonoVue could accurately assess the renal microvascular perfusion in diabetic kidney damage. Nephrol Dial Transplant, 2012, 27(7): 2891-2898.
[8] 段琬璐, 周群芳, 宋竹清, 等. 超声造影评价基于吲哚菁绿的乳腺癌光热治疗效果的实验研究. 中国医学影像学杂志, 2016, 24(5): 329-332, 336.
[9] 刘锐洪, 李叶阔, 孙彬录, 等. 超声造影定量分析急性失血性休克肾血流灌注的实验研究. 中国医学影像学杂志, 2015, 23(9): 641-644.
[10] 金惠铭, 王建枝. 病理生理学. 第6版. 北京: 人民卫生出版社, 2004: 182-183.
[11] Morel N, Biais M, Delaunay F, et al. Erythrocytes and microvascular tone during acute haemorrhagic shock. Ann Fr Anesth Reanim, 2013, 32(5): 339-346.
[12] Taniguchi T, Shibata K, Yamamoto K, et al. Effects of lidocaine administration on hemodynamics and cytokine responses to endotoxemia in rabbits. Crit Care Med, 2000, 28(3): 755-759.
[13] Lucidarme O, Franchi-Abella S, Correas JM, et al. Blood flow quantification with contrast-enhanced US: "entrance in the section" phenomenon-phantom and rabbit study. Radiology, 2003, 228(2): 473-479.
(本文编辑 饶亚岚)
Renal Blood Perfusion During Resuscitation After Hemorrhagic Shock: A Quantitative Analysis on Animals by Contrast-enhanced Ultrasound
PurposeContrast-enhanced ultrasound (CEUS) is a noninvasive technique that can monitor the blood perfusion of organs. The study aims to discuss the value of CEUS in quantitative analysis of renal microcirculation during resuscitation after hemorrhagic shock (HS).Materials and MethodsForty healthy New Zealand white rabbits were randomly divided into five groups in this prospective study. One group was selected as normal control group (T1), the other four groups were established HS model by using the modified Wiggers's method; one of the four HS groups was taken as shock group (T2), and the other three HS groups were named as 2 h group (T3), 6 h group (T4), and 24 h group (T5) according to resuscitation time. CEUS was used to observe the rabbits' renal perfusion and the perfusion parameters were recorded including amplitude of peak intensity (A), time to peak (TTP), area under curve (AUC) and curve rising slope rate (Grad); the correlation of these parameters with histological examination was analyzed.ResultsCompared with T1 group, The TTP of T2 group prolonged and the A, AUC and Grad decreased (P<0.05); the HS model was established successfully. Compared with T2 group, the A, AUC and Grad of T3, T4 groups increased (P<0.05), but the TTP of T3, T4 groups was not shortened (P>0.05). The above parameters were all significantly different between T5 group and T2 group (P<0.05), but the differences did not exist between T5 and T1 groups (P>0.05), which indicated that the perfusion parameters gradually returned to normal level after resuscitation. The histological staining demonstrated that the renal tubular epithelial cell swelling and vascular congestion gradually restored after resuscitation.ConclusionCEUS can quantitatively assess renal perfusion changes during resuscitation as a noninvasive monitor.
Shock, hemorrhagic; Resuscitation; Ultrasonography; Contrast media; Hemoperfusion; Renal circulation; Disease models, animal; Rabbits
1.南方医科大学 广东广州 510000
2. 广州军区广州总医院超声科 广东广州510010
李叶阔
1. Southern Medical University, Guangzhou 510000, China
2. Department of Ultrasound, General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Address Correspondence to: LI Yekuo
E-mail: yekuoli@163. com
全军医学科研“十二五”计划课题项目(CWS12J076);广东省科技计划项目(2014A020212255);广东省自然科学基金项目(2016A030313611)
R445.1;R441.9
2016-09-26
修回日期: 2016-11-09
中国医学影像学杂志
2017年 第25卷 第3期:174-177
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 174-177
10.3969/j.issn.1005-5185.2017.03.004
