重组人血管内皮抑素在非小细胞肺癌患者根治性手术后早期辅助治疗中的临床应用
2017-06-05甄天昌苏功章蒋仲敏
朱 强 臧 琦* 王 伟 曹 明 甄天昌 苏功章 蒋仲敏
(山东大学附属千佛山医院胸外科,山东 济南 250014)
重组人血管内皮抑素在非小细胞肺癌患者根治性手术后早期辅助治疗中的临床应用
朱 强 臧 琦* 王 伟 曹 明 甄天昌 苏功章 蒋仲敏
(山东大学附属千佛山医院胸外科,山东 济南 250014)
目的研究重组人血管内皮抑素(恩度)在非小细胞肺癌术后早期辅助治疗中的临床价值。方法2007年10月至2009年3月在我科接受肺癌根治性手术后早期(术后8~9 d)恩度治疗的非小细胞肺癌(NSCLC)患者共38例,并与同期手术后3周开始单纯行辅助化疗的对照组37例患者相比较,观察两组患者5年的无疾病进展时间(PFS)、总的生存率(OS)等,以及不良反应。结果与对照组比较,恩度治疗组平均PFS延长了9.8个月(P<0.05),中位PFS延长了8.8个月(P<0.05)。在5年生存时间方面,恩度治疗组总生存率、平均生存时间、中位生存时间分别为47.4%、50.1个月、59.3个月,而对照组分别为29.7%、42.1个月、43.5个月,两组之间有显著性差异(P<0.05)。治疗组中仅有1例患者手术切口愈合不良,两组中其他患者均未发生支气管胸膜瘘、感染等不良事件。结论对于根治性手术切除的早、中期NSCLC患者,在术后早期辅助治疗中采用恩度和敏感含铂化疗药物联合治疗可显著提高患者的远期疗效。多靶点抗血管生成药物联合化疗药物用于NSCLC患者术后早期辅助治疗的处理策略,或将广泛应用于临床。
肺肿瘤;重组人血管内皮抑素;治疗结果;临床研究
在世界范围内,肺癌是最常见的恶性肿瘤之一,其病死率居各种恶性肿瘤的首位,其中非小细胞肺癌(NSCLC)约占80%[1]。根治性手术切除加术后辅助化疗已成为早、中期NSCLC的基本治疗方案,但术后患者长期总的生存率仍然很低。如何提高可手术切除的NSCLC患者长期生存率,提高患者生活质量是肿瘤临床工作中面临的一个棘手问题。近年来,抗血管生成药物已成为治疗非小细胞肺癌新的热点,其中重组人血管内皮抑素—恩度(EndostarTM,YH-16)与化疗药物等联合应用治疗晚期NSCLC已显示出较好的疗效,大大提高了化疗等治疗的有效率,显著延长了患者疾病进展时间,改善了患者生活的质量[2]。由此,我们设想是否可将恩度用于NSCLC患者的术后辅助治疗中,以期延长患者的生存时间。于是2007年10月8日至2009年3月15日我们尝试于术后早期将恩度应用于早、中期根治性手术切除术后NSCLC患者的辅助治疗,并与同期术后单纯使用化疗药物行辅助化疗的患者进行对比,旨在探讨恩度联合化疗在NSCLC患者术后早期辅助治疗中的临床应用价值。
1 对象与方法
1.1 研究对象:该研究中的所有患者均签署知情同意书,并经医院伦理审查委员会审查通过。入选标准:①术前未行新辅助治疗;②术前均行胸腹部CT、骨扫描及头颅MRI检查,除外远处转移;③既往无其他部位原发肿瘤;④接受了完全性手术切除和系统淋巴结清扫(肺叶切除、支气管袖状肺叶切除或全肺切除+肺门纵隔淋巴结清扫术);⑤按照2009年国际抗癌联盟第7版肺癌TNM分期标准,术后病理证实为IB~ⅢA期NSCLC;⑥术后身体状况(PS)评分0~2分;⑦心、肝、肾及骨髓功能能够耐受治疗。⑧切除的肿瘤标本药敏试验提示对化疗药物敏感。退出标准:入组者有权自愿退出临床研究,出现以下情况者随时退出研究:①不能按照方案规定治疗,依从性差者;②研究过程中出现与治疗相关的难以耐受的不良反应,如严重血液学毒性,消化道反应,肝肾功能损害等,持续2周以上者;③对化疗药物不敏感者。
按照上述标准共筛选75例病例,随机分为两组,即恩度治疗组和对照组。治疗组38例,其中男性30例,女性8例;年龄42~73岁,中位年龄63.5岁;肺叶切除者29例,支气管袖状肺叶切除者6例,全肺切除者3例。术后病理分期IB期2例,ⅡA期13例,ⅡB期15例,ⅢA期8例。组织细胞学类型为鳞状细胞癌19例,腺癌18例,其他类型癌1例。对照组37例,其中男27例,女10例;年龄45~70岁,中位年龄61岁;肺叶切除者29例,支气管袖状肺叶切除者4例,全肺切除者4例。术后病理分期IB期4例,ⅡA期15例,ⅡB期12例,ⅢA期6例。组织细胞学类型鳞癌20例,腺癌15例,其他类型癌2例。两组患者进入研究时,性别、年龄、术式、病理分期及组织细胞学类型等临床特征均无统计学差异(P>0.05)。
1.2 方法。对照组:术后第21天开始给予含铂二药方案行术后辅助化疗。化疗药物的选择根据术中切除肿瘤标本的药物药敏试验确定,顺铂或卡铂联合多西他赛、吉西他滨、长春瑞滨或培美曲塞。化疗方案组合和药物用量为顺铂75 mg/m2,d2~4,静滴;卡铂AUC5,d1,静滴;多西他赛175 mg/m2,d1,静滴;吉西他滨1000 mg/m2,d1、8,静滴;培美曲塞500 mg/m2,d1,静滴;长春瑞滨25 mg/m2,d1、8,静滴。每3周为1个周期,共4~6个周期。治疗组:术后第8~9天,开始给予重组人血管内皮抑素——恩度(Endostar,YH-16、由山东省烟台市先声麦得津生物工程股份有限公司生产)7.5 mg/m2加入500 mL生理盐水静滴,滴注时间3~4 h,每天1次,连续给药14 d为1个周期。间歇7 d,行下1个周期治疗。本组患者均连续接受4个周期恩度治疗。术后第21天开始给予含铂二药方案化疗,化疗药物选择和使用方案与对照组相同。两组中所有肿瘤复发的患者均采用调整化疗方案继续维持治疗、局部放疗等处理。
1.3 观察指标和随访:①观察术后无病进展时间(progress-free survival,PFS)、术后5年的平均生存时间、中位生存时间以及总的生存时间(overall survival,OS)等。PFS为患者手术后第1天至肿瘤术后复发或转移的时间;OS为自手术治疗之日至末次随访日或死亡的时间,以月为单位计算。随访截止时仍存活者视为截尾数据。②观察支气管胸膜瘘、手术切口愈合等手术并发症情况。随访方式采用门诊复查或电话进行,随访终止时间为2014年3月16日。随访内容包括病史、体检以及胸部CT、腹部CT;当出现症状时,行脑部CT或MRI、骨扫描等检查。随访频次为术后2年内每3个月1次,2年后每6个月1次,直至术后5年。
1.4 统计学方法:应用SPSS13.0统计学软什对数据进行分析。计数资料比较用生存率采用χ2检验。PFS和OS用Kaplan-Meier方法计算,Logrank检验比较生存期的差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 疗效:与对照组比较,恩度治疗组的无病进展时间平均延长了9.8个月(41.6个月和31.8个月,P<0.05),无病进展时间的中位数为42.5个月,而对照组为33.7个月,延长了8.8个月(P<0.05)。在生存时间方面,恩度治疗组5年总生存率、平均生存时间、中位生存时间分别为47.4%、50.1个月和59.3个月,而对照组分别为29.7%、42.1个月、43.5个月(P<0.05),两组之间有显著性差异,提示术后使用恩度可显著提高疗效。见表1、2和图1、2。
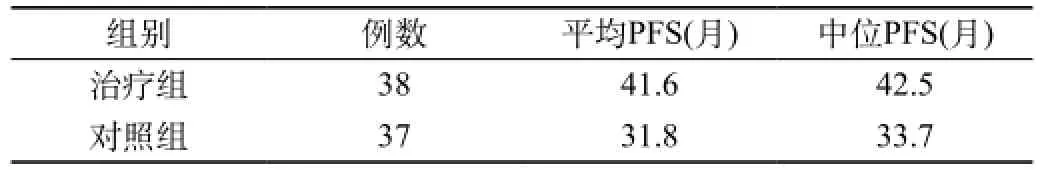
表1 术后5年无病进展时间结果

图1

图2
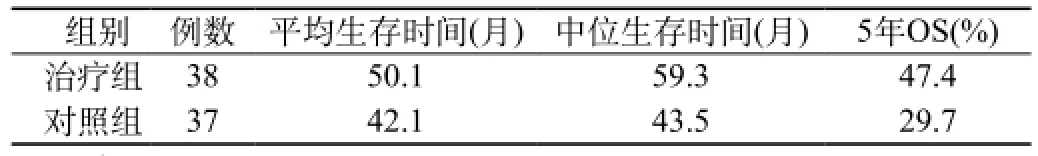
表2 术后5年总的生存结果
2.2 手术并发症情况:本研究病例中,仅治疗组中有1例患者手术切口愈合不良,其他患者均未发生支气管胸膜瘘、感染等不良事件。
3 讨 论
随着人们健康意识的增强和医学诊断技术的提高,肺癌的诊出率逐年提高。然而患者长期生存率没有明显提高,经手术治疗的NSCLC患者5年生存率最好为30%~40%,最常死于肿瘤复发或转移。在恶性肿瘤发展过程中,肿瘤细胞早期即可播散并存活于血液循环、淋巴道、骨髓以及各组织器官中,形成亚临床“微转移灶”。尽管通过改进手术方式较为彻底的切除了原发肿瘤并进行系统性淋巴结清扫,但隐形的肿瘤微转移灶已经存在,这些微转移灶是NSCLC术后复发、转移的根源和基础[3]。手术治疗本身也是促进NSCLC术后复发转移的重要原因之一。手术操作可引起肿瘤细胞播散入血液循环,导致术后的复发、转移。另一方面术后残存在体内的肿瘤细胞大部分发生凋亡,少部分处于休眠状态(G0期),只有极少数发生增殖,而手术、麻醉等对机体的创伤和影响造成术后患者免疫力下降、血液中肿瘤抑制因子改变、肿瘤微转移灶局部区域血流量增加及各种促新生血管生成因子等,这些术后内环境状态的改变均会使瘤细胞摆脱抑制状态,激活休眠状态的瘤细胞,这些瘤细胞不断增殖,发展成为临床显性复发转移。
1971年Folkman首次系统提出肿瘤血管生成学说以及抗血管生成治疗设想和机制。新生血管是肿瘤生长和侵袭的必要条件,也是肿瘤增殖转移的形态学基础。当瘤灶超过2 mm3时,其继续存活、长大依赖于新生血管的生成。如无新生血管长入,瘤组织将发生退化,而一旦新生血管长入其将迅速生长。这些新生血管不但为肿瘤细胞提供营养,而且还为肿瘤细胞转移提供通道。血管新生是肿瘤生长、发展的必经之路。切断微转移瘤灶新生血管生成是防治NSCLC术后复发、转移的关键。
近年来,临床上使用的抗血管生成药主要有贝伐单抗(Avastin)、西妥西单抗、盐酸帕唑尼(Pazopanib)、血管内皮抑制素(Endostatin)等。其中血管内皮抑素是一种内源性糖蛋白,最早在鼠成血管细胞瘤株培养液中进行分离提纯得到的,具有抗血管生成作用。2005年新型重组人血管内皮抑制素—恩度(rh-Endogtatin,Endostar)在中国大陆经官方批准可应用于NSCLC的临床治疗,它可靶向人类基因组血管生成调节基因超过12%,对血管内皮细胞的迁移、附着、生长起抑制作用,抑制新生血管生成,对血管内皮细胞凋亡有着直接影响,从而直接发挥抗血管生成作用;还可通过调节肿瘤细胞表面血管内皮生长因子(VEGF)的表达及蛋白水解酶的活性,多靶点地发挥抗血管生成作用,间接导致肿瘤休眠或退缩[4]。
越来越多的动物实验和临床研究证明,血管内皮抑制素可以阻止多种肿瘤的进展和转移[5]。Wang等[6]在小鼠身上建立肺Lewis细胞癌自发性肺转移的动物模型,通过对该动物模型实验发现恩度可以有效的阻止原发肿瘤病灶切除术后远处转移灶的进展。最近的研究还表明,恩度联合顺铂不但较单独分别使用这两种药物更有效的阻止肺癌肿瘤细胞的生长,而且可通过抑制肿瘤淋巴管的生成从而减少肿瘤细胞的淋巴转移[7]。恩度联合化疗药物对NSCLC治疗所起到的协同治疗作用,大部分研究成果集中在基础动物实验以及治疗晚期NSCLC患者[2,6-7],而将恩度联合化疗药物用于根治性手术切除术后早期NSCLC患者辅助治疗的临床研究极少。我们术后早期,即术后8~9 d开始将恩度应用于NSCLC术后患者,将其作为术后辅助治疗的一部分,并与术后三周含铂两药化疗方案相结合,辅助治疗术后NSCLC取得了较好疗效。我们的研究中,患者的平均DFS为41.6个月,5年平均生存时间50.1个月,5年总体生存率为47.4%,均较对照组显著延长或提高,这提示恩度联合化疗可显著延长NSCLC患者术后长期生存时间,改善了患者生活质量。
肿瘤发生的早期使用恩度具有重要意义,可显著发挥其生物学效应。血管内皮抑素抑制肿瘤血管形成和肿瘤活性的能力,在血管形成期应用的效果大于在血管成熟期应用。Tatyana等[8]对鼠前列腺癌模型的早期和晚期治疗进行了对比研究,发现在肿瘤形成初期,早期的抗血管生成治疗可以抑制肿瘤分化进程,使得肿瘤分化不良且无法产生转移灶,可显著提高存活率。我们选择术后早期,即术后8~9 d开始使用恩度,这可能会更有效的阻断已经存在的亚临床微转移肿瘤病灶新生血管生成,降低瘤灶内血管通透性,破坏不够成熟的血管,从而减缓瘤灶生长,使肿瘤细胞停滞在G2期,待术后三周给予敏感的含铂类化疗药物,以进一步消灭肿瘤细胞。这也可避免由于3周内过早使用化疗药物导致切口愈合不良、支气管胸膜瘘等并发症的发生。
此外,恩度还可增加肿瘤的血管周细胞的募集,募集血管周细胞到达肿瘤血管后可带来短暂的血管稳定并改善缺氧区域的氧气输送。在此肿瘤血管正常化“时间窗口期”内用化疗药物,可提高肿瘤病灶内的药物浓度,达到较好的治疗效果[9]。目前对于使用恩度后所导致的肿瘤血管正常化“时间窗口期”出现时间尚难以准确预测。有人利用CT灌注成像和低氧成像对Ⅱ和Ⅲ期NSCLC病例进行研究,并与对照组对比后发现,单独使用恩度治疗1周左右,肿瘤的血流灌注和低氧状态发生显著改变,故认为该时间点附近是放射治疗的“时间窗口期”[10]。而对于化疗药物的给药“时间窗口期”,一般认为在恩度开始治疗后的第4~10天开始出现肿瘤的血管正常化,该时间内用化疗药物可提高疗效。但该窗口期持续时间较短,大约3 d[11]。而有些研究的作者持有相反观点,他们认为恩度与化疗药物同时或者恩度在应用化疗药物之后使用是最佳方案,可取的更好的疗效;同时他们还认为肿瘤血管正常化“时间窗口期”内给予化疗药物并非是提高疗效的主要机制[12]。在本研究中,我们在治疗组中采用恩度和术后辅助化疗药物各自按照自己的用药时间按时规律给药,这样恩度用药时间有时在化疗药物给药前使用,有时在化疗药物给药结束后使用,有时则二者同时使用,如此可增加化疗药物在肿瘤血管正常化“窗口期”给药的概率,从而提高疗效。同时,化疗药物的细胞毒效应使肿瘤细胞死亡,并且肿瘤细胞对氧和营养物质需求增加,血管内皮抑素抑制肿瘤新生血管生成,直接对肿瘤营养供应进行影响,从而使亚临床转移的微型肿瘤病灶因“饥饿”而死亡。恩度与含铂类化疗药物二者联合使用,可起到协同治疗作用,从而提高术后辅助治疗的治疗效果。
恩度不会增加化疗的不良反应已得到普遍认同,但其是否会影响NSCLC患者术后手术切口、支气管残端的愈合,以及增加感染概率等方面,目前尚无定论。已有的研究发现长期注射血管抑素对伤口愈合及肝、肾功能等不会产生严重影响[13],也不出现体质量减轻、活动减少、食欲下降以及机会性感染。而长期应用贝伐单抗等抗血管生成药物可使正常的血管内皮细胞受损,从而引起高血压、出血、血栓形成等不良反应,其对伤口愈合产生较严重影响。Scappaticci等[14]研究了贝伐单抗对晚期结直肠癌患者伤口愈合的影响,发现治疗前28~60 d进行手术治疗的患者中,贝伐单抗联合化疗组伤口愈合并发症为1.3%,单独化疗组为0.5%;而在治疗期间进行手术的患者中,贝伐单抗联合化疗组伤口愈合并发症为13%,单独化疗组为3.4%,这提示贝伐单抗具有阻断伤口愈合的作用。而本研究中术后早期应用恩度,我们并未发现恩度增加切口愈合不良率和术后支气管残端瘘的发生率,术后8~9 d开始用恩度是安全的。这可能与恩度本身不会增加上述并发症相关,也与我们研究中病例数较少相关。NSCLC患者术后是否可更早期接受恩度治疗,还需要进一步验证。
总之,本研究初步证实对于根治性手术切除的早、中期NSCLC患者,术后早期辅助治疗中使用恩度和敏感含铂化疗药物联合治疗,可显著提高远期疗效。我们相信将来随着更多的多靶点抗血管生成药物研制成功并应用于临床,本研究中采用的治疗策略或将会广泛应用于临床,即抗血管生成药物联合敏感化疗药物用于NSCLC患者术后早期的辅助治疗。
[1] Wu HT,Deng J,Yu SY,et a1.The Inhibitory Effects of Rh-endostatin (YH-16) in Combination with Radiotherapy on lung adenocarcinoma A549 in Mice and the Underlying Mechanisms[J].J Hua zhong Univ Sci Technol,2010,30(1):108-112.
[2] Rong B,Yang S,Li W,et a1.Systematic review and meta-analysis of Endostar (rh-endostatin) combined with chemotherapy versus chemotherapy alone for treating advanced non-small cell lung cancer[J].World J Surg Oncol,2012,10:170.
[3] Felip E,Rosell R.Neoad juvant chem oth erapy in non-sm all cell lung cancer[J].Curr Med Chem,2002,9(9):893-898.
[4] Folkman J.Anti-angiogenes in cancer theraphy-endostatin and its mechanisms of action[J].Expt Cell Res,2006,312(2):594-607.
[5] Te Velde EA,Reijerkerk A,Brandsma D,et a1.Early endostatin treatment inhibits metastatic seeding of murine colorectal cancer cells in the liver and their adhesion to endothelial cells[J].Br J Cancer,2005,92(8):729-735.
[6] Wang HL,Ning T,Li M,et a1.Effect of endostatin on preventing postoperative progression of distant metastasis in a murine lung cancer model[J].Tumori,2011,97(6):787-793.
[7] Dong XP,Xiao TH,Dong H,et a1.Endostar combined with cisplatin inhibits tumor growth and lymphatic metastasis of lewis lung carcinoma xenografts in mice[J].Asian Pac J Cancer Prev,2013,14(5):3079-3083.
[8] Tatyana L,Diptiman C,Lisa K,et a1.Effects 0f sustained antiangiogenic therapy in multistage prostate cancer in TRAMP model [J].Cancer Res,2007,67(12):5789-5797.
[9] Huang G,Chen L.Recombinant human endostatin improvesanti-tumor efficacy of paclitaxel by normalizing tumor vasculature in Lewis lung carcinoma[J].J Cancer Res Clin Oncol,2010,136(8):1201–1211.
[10] Jiang XD,Dai P,Qiao Y,et al.Clinical study on the recombinant human endostatin regarding improving the blood perfusion and hypoxia of non-small-cell lung cancer[J].Clin Transl Oncol, 2012,14(6):437-443.
[11] Li N,Zheng DW,Wei XY,et al.Effects of recombinant human endostatin and its synergy with cisplatin on circulating endothelial cells and tumor vascular normalization in A549 xenograft murine model[J].J Cancer Res Clin Oncol,2012,138(7):1131-1144.
[12] Peng XC,Qiu M,Wei M,et al.Different combination schedules of gemcitabine with endostar affect antitumor efficacy[J].Cancer Chemother Pharmacol,2012,69(2):239–246.
[13] Kirsch M,Strasser J,Allende R,et al.Angiostatin suppress malignant glioma growth in vivo[J].Cancer Res,1998,58(23): 4654-4659.
[14] Scappaticci FA,Fehrenbacher L,Cartwright T.Surgical wound healing complications in metastatic colorectal cancer patients treated with bevacizumab[J].J Surg Oncol,2005,91(3):173-180.
Clinical Application of Rh-endostain in Early Postoperative Adjuvant Treatment of Non-small Cell Lung Cancer Patients
ZHU Qiang, ZANG Qi, WANG Wei, CAO Ming, ZHEN Tian-chang, SU Gong-zhang, JIANG Zhong-min
(Department of Thoracic Surgery, Qianfoshan Hospital Affiliated Shandong University, Jinan, 250014, China)
ObjectiveTo evaluate the clinical effect of rh-endostain (EndostarTM) in early adjuvant treatment of non-small cell lung cancer patients undergoing radical surgical treatment.MethodsFrom October 2007 to March 2009, 38 patients with radical pneumonectomy and systemic lymph node resection received rh-endostain injection as early adjuvant treatment. As a control group, 37 patients simultaneously underwent radical resection, and only received adjuvant chemotherapy subsequently after operation 3 weeks. The clinical outcomes including progress-free survival (PFS), overall survival(OS) as well as incidence of serious complications were compared between the two groups.ResultsCompared with control group, the average PFS and the median PFS in EndostarTM treatment group respectively prolonged for 9.8months and 8.8 months (P<0.05). There was significant difference in overall 5-year survival parameters between two groups. The 5-year overall survival rate,the average survival time and the median survival time in treatment group and control group were 47.4% VS 29.7%, 50.1months VS 42.1months and 59.3 months VS 43.5 months respectively(P<0.05). Only one patient in treatment group had poor healing of chest incision. The others in the two groups had no complications including bronchopleural fistula, infection and so on.ConclusionsCompared with adjuvant chemotherapy after radical resection 3 weeks alone in early to moderate NSCLC patients, the addition of EndostarTM to adjuvant chemotherapy regimen results in significantly improvement in long-term effect. The therapeutic strategy of Multi-targeted antiangiogenic drug combined with adjuvant chemotherapy in NSCLC patients’early adjuvant treatment after operation will be used widely in future.
Carcinoma, non-small-cell lung; Recombinant human endostatin; Treatment outcome; Clinical trial
R734.2
B
1671-8194(2017)12-0027-04
*通讯作者:E-mail: qizang2005@sina.com
