18F-FDG PET/CT诊断肾细胞癌
2017-06-05祝安惠张卫方
祝安惠,张卫方
(北京大学第三医院核医学科,北京 100191)
生殖泌尿影像学
18F-FDG PET/CT诊断肾细胞癌
祝安惠,张卫方*
(北京大学第三医院核医学科,北京 100191)
目的 探讨18F-FDG PET/CT诊断肾细胞癌(RCC)的价值。 方法 回顾性分析32例确诊为RCC患者的病理及PET/CT影像资料,比较不同病理类型(透明细胞癌与非透明细胞癌)、Fuhrman分级(高级别与低级别透明细胞癌)和临床分期(有无远处转移)RCC的肿瘤直径和最大标准摄取值(SUVmax)差异。结果 32例患者共33个原发灶,PET/CT检出31个,2个假阴性,检出率为93.94%(31/33)。31个原发灶PET/CT表现为肾实质内混杂密度的软组织团块,其18F-FDG摄取可接近、高于或低于正常肾实质;2个原发灶PET/CT未见异常表现。8例伴静脉瘤栓,19例伴远处转移,瘤栓及转移灶的FDG摄取均高于受累器官本底。不同病理类型组和不同Fuhrman分级RCC的肿瘤最长径及SUVmax差异无统计学意义;不同临床分期RCC的肿瘤最长径差异无统计学意义,SUVmax差异有统计学意义(t=3.852,P=0.001)。结论 RCC原发灶的PET/CT表现多样,较小的低级别肾透明细胞癌可无明显异常表现而漏诊;18F-FDG PET/CT在RCC术前分期中具有重要价值。
癌,肾细胞;正电子发射断层显像术;体层摄影术,X线计算机;氟脱氧葡萄糖F18
肾细胞癌(renal cell carcinoma, RCC)是肾脏较常见的恶性肿瘤,早期多无明显临床症状,部分患者于健康体检时发现,至出现症状时部分患者已属晚期。不同组织学类型的RCC预后存在差异,而早期发现病变、准确分期和及时治疗对改善预后至关重要[1-2]。近年来,随着PET/CT在RCC中应用的增多,RCC的PET/CT特征也逐渐被临床医师认识。本文收集在我院进行住院治疗的RCC患者32例,通过与病理对照,回顾性分析其PET/CT特征,旨在为RCC的诊断提供依据。
1 资料与方法
1.1 一般资料 收集2012年8月—2016年3月在我院接受治疗并确诊为RCC的患者32例(共33个原发灶,1例患者左右肾各1个病灶),其中男26例、女6例,年龄37~77岁,平均(56.5±15.0)岁。所有原发肿瘤经手术或穿刺活检证实,所有转移灶均经穿刺或临床随访3~6个月证实。病理诊断参照2004年WHO关于RCC分类标准[3],细胞核分级采用Fuhrman分级系统[4]。32例患者中,4例接受肿瘤切除术,25例接受全肾切除术,3例接受肾脏肿物穿刺活检;33个病灶中,14个为高级别(Fuhrman分级Ⅲ或Ⅳ级)肾透明细胞癌、14个为低级别(Fuhrman分级Ⅰ或Ⅱ级)肾透明细胞癌、1个为肾集合管癌、2个为乳头状肾癌(Ⅱ型)、2个为未分类肾癌。肾静脉或下腔静脉瘤栓8例,肾上腺转移3例,19例伴远处器官转移。临床表现:腰痛3例,骨痛3例,无痛肉眼血尿6例,颈部无痛性肿物1例,其他19例为偶然发现而无临床症状。既往史:1例30年前患膀胱癌,1例1年前患鼻咽癌,1例患直肠癌2年。32例RCC患者均在PET/CT检查前1周内接受过泌尿系增强CT检查。
1.2 仪器与方法 采用Siemens Biograph 64 PET/CT显像仪,PET仪为52环,CT为64排螺旋CT。所有患者检查前均禁食4~6 h,扫描之前30 min常规口服2%的泛影葡胺溶液800~1 000 ml以充盈胃肠道;血糖水平保持在4.4~9.3 mmol/L。18F-FDG由原子高科股份有限公司提供,放化纯度>95%,静脉注射剂量为3.70~4.44 MBq/kg体质量 (0.10~0.12 mCi/kg体质量)。所有患者均在注射18F-FDG后60 min行全身PET/CT常规显像。CT扫描:管电压 140 kV,管电流100 mAs,层厚3 mm。PET采用3D采集模式,头部扫描:8分钟/床位,体部扫描:3分钟/床位,扫描范围:颅顶至股骨上段。PET图像重建采用迭代法。
1.3
图像后处理与分析 将CT与PET图像传至MedEx PET/CT中心与影像信息系统进行图像后期处理与分析,将PET图像与CT图像进行匹配、融合,重建后分别得到全身或局部轴位、冠状位和矢状位PET、CT和PET/CT融合图像。由2名高年资核医学科医师在不知道其他影像检查资料的情况下独立阅片,对判断不一致的病例,经讨论后达成一致。诊断采用目测分析法结合半定量分析法。目测分析法:综合PET上示踪剂分布特点及低剂量CT上所示病变的部位、形态变化进行综合确定:即如果CT上有明确的软组织肿块,不论其18F-FDG 摄取高于、接近还是低于周围正常肾实质则均诊断为RCC;如果CT显示的病变无18F-FDG摄取,表现为放射性缺损区则诊断为正常;同时在CT图像上测量病变最大截面的最长径。半定量分析法:在观察到的病变部位18F-FDG摄取最高的层面设置大小相同的ROI,测量该部位的最大标准摄取值(maximal standard uptake value ,SUVmax),测量时注意避开肾集合系统区放射性浓聚的干扰。
1.4 数据分析 在病变水平,将PET/CT结果与最终病理诊断结果对照:①根据不同病理类型,将所有RCC分为肾透明细胞癌和非透明细胞癌;②根据Fuhrman细胞分级,将所有肾透明细胞癌分为高级别肾透明细胞癌(Ⅲ或Ⅳ级)和低级别肾透明细胞癌(Ⅰ或Ⅱ级)。③根据肿瘤临床分期,即是否发生远处器官转移分为转移与非转移。
1.5 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,计数资料以率或百分比表示。采用独立样本t检验分别对比分析不同病理类型、不同Fuhrman分级和不同临床分期肿瘤的SUVmax及最长径的差异。P<0.05为差异有统计学意义。
2 结果
2.1 RCC的PET/CT表现 33个RCC原发灶,PET/CT正确诊断31个,检出率为93.94%(31/33),假阴性2个。原发灶最大径0.5~12.5 cm,平均 (5.2±2.7)cm;SUVmax1.3~13.1,平均5.3±3.4。31个肾脏原发病灶表现为病变局部肾脏轮廓增大,肾实质内密度高低不均的软组织团块,其中21个18F-FDG摄取高于正常肾实质、4个18F-FDG摄取接近正常肾实质(图1),6个18F-FDG摄取低于正常肾实质;假阴性的2个病灶局部肾脏轮廓正常,肾实质内未见异常密度影,18F-FDG摄取接近正常肾实质(图2)。8例伴肾静脉及下腔静脉瘤栓的患者表现为受累静脉外形局限性不规则增粗伴局限性18F-FDG摄取增高;19例出现远处转移,累及器官包括脑、肺、肝、胰腺、结肠及骨骼,转移灶的18F-FDG摄取高于受累器官的放射性本底。
表1 RCC原发灶PET/CT特征分析(±s)

表1 RCC原发灶PET/CT特征分析(±s)
类别肿瘤最长径(cm)SUVmax不同病理类型(n=33) 肾透明细胞癌(n=28)5.09±2.645.42±4.29 肾非透明细胞癌(n=5)7.20±3.267.98±3.71 t值1.5931.25 P值0.1210.22肾透明细胞癌不同细胞分级(n=28) 高级别(n=14)5.26±1.966.92±4.98 低级别(n=14)4.92±3.173.92±2.76 t值0.3411.971 P值0.7360.063不同临床分期(n=33) 转移(n=19)6.26±2.627.18±4.74 非转移(n=14)4.25±3.942.17±2.67 t值1.7613.852 P值0.0880.001

图1 患者男,72岁,体检超声发现双肾占位,左肾高级别透明细胞癌(Ⅲ级),右肾低级透明细胞癌(Ⅱ级) A~C.CT(B)示左肾肾窦区稍高密度肿块(十字交叉线),密度均匀,右肾未见明显病变(箭),PET(A)及PET/CT融合图像(C)示左肾窦内肿块FDG摄取接近相邻肾实质(十字交叉线),右肾未见异常FDG摄取(箭); D.肾脏增强CT分泌期轴位图像示左肾窦区肿块(白箭)及右肾实质内结节(黑箭)对比剂明显廓清呈相对低密度影
2.2 RCC原发灶PET/CT特征分析 不同病理类型和不同Fuhrman分级组的肿瘤最长径及SUVmax差异无统计学意义(P均>0.05),不同临床分期的肿瘤最长径差异无统计学意义(P>0.05),SUVmax差异有统计学意义(t= 3.852,P=0.001,表1)。
3 讨论
18F-FDG 是最常用的肾脏肿瘤显像剂,它是葡萄糖的类似物,通过与葡萄糖相同的摄取转运过程进入细胞内,在己糖基酶的作用下被磷酸化,但不能被进一步代谢,而滞留堆积在细胞内,因而可以反映出病变组织对葡萄糖的利用情况,其葡萄糖代谢率越高,摄取18F-FDG越多。近年来,随着PET/CT应用的逐渐推广,18F-FDG PET/CT在RCC的研究报道也逐年增多,但PET/CT对RCC诊断的灵敏度各家报道不一(47.0%~94.0%)[5-6]。本组32例RCC患者共33个原发灶,PET/CT检出31个,假阴性2个,检出率为93.94%。2个假阴性病变的漏诊原因可能是:①原发灶较小且位置深在,2个假阴性病变均由超声检出,而后在增强CT上进一步证实,病变直径分别为1.5 cm、0.5 cm,尚未引起肾轮廓改变,并且在PET/CT的定位CT图像上其密度与正常肾实质相似,因此肉眼难以区分;②肿瘤分化程度的影响,低级别肾透明细胞癌因表达GLU-1较低而致18F-FDG摄取较低,因而在PET上常无明显异常放射性摄取[7],本组2例假阴性病变细胞分级均为Ⅰ级肾透明细胞癌,与研究报道相符;③部分容积效应的影响;由于18F-FDG经肾脏排泄,肾实质及集合系统内放射性留存导致肾实质本底放射性较高,有可能掩盖较小的病变。为了减少集合系统放射性的干扰,张建华等[8]通过对22例RCC的早期显像及延迟显像的SUVmax进行对比研究,结果表明二者差异无统计学意义。
研究[7-9]显示,RCC原发灶18F-FDG摄取可高于或接近正常肾实质,刘红杰等[9]对20例RCC原发灶的18F-FDG摄取进行研究,结果显示,其中14例(70.00%)为不同程度18F-FDG摄取增高(包括Ⅰ、Ⅱ级肾透明细胞癌及肾非透明细胞癌),其余6例(30.00%)18F-FDG摄取接近正常肾实质(均为Ⅰ级肾透明细胞癌);本组21例(21/33,63.64%)18F-FDG摄取高于正常肾实质(包括肾透明细胞癌及非肾透明细胞癌),其余11例包括12个低级别肾透明细胞癌中,6个(6/33,18.18%)18F-FDG摄取接近正常肾实质,6个(6/33,18.18%)18F-FDG摄取低于正常肾实质,与研究[9]报道略有不同。另外,本组8例伴静脉瘤栓、19例伴远处转移灶(累及器官包括脑、肺、肝、胰腺、结肠及骨骼)均表现为不同程度的放射性摄取且放射性高于受累器官的放射性本底。因此,尽管部分低级别肾透明细胞癌的18F-FDG摄取可接近或低于正常肾实质、部分小的原发灶可能在PET/CT上无明显异常表现而影响原发灶的检出,但RCC静脉瘤栓及远处转移灶均表现为不同程度FDG摄取增高,因而PET/CT在RCC的术前分期中仍具有重要意义[10]。
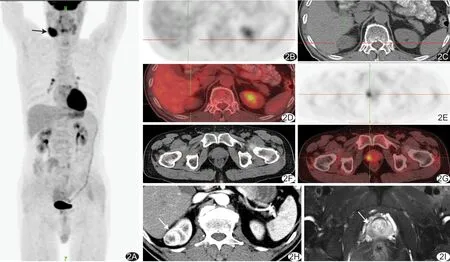
图2 患者男,47岁,右颈部无痛性肿块,右肾占位及前列腺病变;病理:右颈部弥漫大B细胞淋巴瘤,右肾低级别透明细胞癌(Ⅱ级),前列腺腺泡癌
研究[7,11]报道,不同Fuhrman分级的肾透明细胞癌其18F-FDG摄取具有显著差异,因此SUVmax可以预测细胞分级。Takahashi等[7]通过对52例低级别肾透明细胞癌与18例高级别肾透明细胞癌的18F-FDG摄取进行对比分析,结果显示高级别肾透明细胞癌的SUVmean明显高于低级别者。隋时等[11]通过对35例低级别肾透明细胞癌与8例高级别肾透明细胞癌的18F-FDG摄取进行对比分析,结果显示高级别肾透明细胞癌的SUVmax明显高于低级别者。本研究结果显示,高级别肾透明细胞癌与低级别肾透明细胞癌的SUVmax差异无统计学意义,与以上报道存在差异。可能原因如下:本研究高级别与低级别肾透明细胞癌病灶数均为14个,并且19例患者发生了远处转移,而既往研究中高低级别肾透明细胞癌的数量存在较大悬殊且均未发生远处转移,因此研究结果可能因受纳入样本量和临床分期存在差异的影响而有所不同,故尚需更大样本进一步研究加以证实。张瀚等[12]对比分析了9例发生远处转移的RCC的SUVmax(7.7 ± 3.7)与16例未发生远处转移的RCC的SUVmax(3.0 ± 2.3),结果表明二者差异具有统计学意义(P=0.0006);本研究19例发生转移的RCC原发灶SUVmax(7.18 ± 4.74)与13例(14个病灶)未发生远处转移的RCC原发灶SUVmax(2.17 ± 2.67)差异具有统计学意义(P=0.001),与上述报道一致。此外,本研究显示,不同病理类型、不同Fuhrman分级和不同临床分期的RCC原发灶大小不存在差异,与研究[8,12]报道一致。
值得注意的是,本组1例低级别肾透明细胞癌合并颈部弥漫大B细胞淋巴瘤及前列腺癌(图2),患者以右颈部无痛性肿块就诊,PET/CT检查提示右颈部占位18F-FDG摄取明显增高,同时发现右肾占位18F-FDG摄取与正常肾实质接近及前列腺局限性代谢稍高,后行双肾CT增强、前列腺MR检查以及右颈部、肾脏和前列腺病变的穿刺活检确诊为右颈部弥漫大B细胞淋巴瘤、RCC及前列腺癌。1例患者发生结肠转移,PET/CT表现为局限性FDG摄取增高,因肠腔内容物较多而影响对肠壁的观察,难以鉴别是肠道的生理性摄取还是器质性病变所致,后经结肠镜活检证实结肠病变为RCC转移。1例双肾同时发生透明细胞癌,属于多灶性RCC[13],右肾者Fuhrman分级为Ⅱ级,左肾者为Ⅲ级,其中右肾病变最长径1.5 cm且位于肾实质深部尚未引起肾轮廓改变,且18F-FDG摄取与周围肾实质接近,因而PET/CT未检出,该病变由肾脏超声及增强CT检出。因此,RCC患者行PET/CT检查时,当发现肾以外部位出现异常放射性摄取,难以用一元论或生理性摄取解释时,应采取积极的组织学检查以免延误治疗时机,同时还需与其他影像检查紧密结合,以避免漏诊位置深在且放射性摄取接近正常肾实质的多灶性小RCC。
总之,RCC原发灶的18F-FDG摄取表现多样,而静脉瘤栓及远处转移灶的18F-FDG摄取均高于受累器官本底,因此,PET/CT在RCC术前分期中具有重要价值。但对于原发灶较小且位置深在的低级别RCC容易漏诊,且RCC可与其他组织学起源的恶性肿瘤并存,诊断时应密切结合其他影像检查,必要时应积极采取组织学检查以免延误治疗。
[1] Ljungberg B, Campbell SC, Choi HY, et al. The epidemiology of renal cell carcinoma. Eur Urol, 2011,60(4):615-621.
[2] Decastro GJ, McKiernan JM. Epidemiology, clinical staging, and presentation of renal cell carcinoma. Urol Clin North Am, 2008,35(4):581-592.
[3] Lopez-Beltran A, Scarpelli M, Montironi R, et al. 2004 WHO classification of the renal tumors of the adults. Eur Urol, 2006,49(5):798-805.
[4] Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol, 1982,6(7):655-663.
[5] Park JW, Jo MK, Lee HM. Significance of18F-fluorodeoxyglucose positron-emission tomography/computed tomography for the postoperative surveillance of advanced renal cell carcinoma. BJU Int, 2009,103(5):615-619.
[6] Ozülker T, Ozülker F, Ozbek E, et al. A prospective diagnostic accuracy study of F-18 fluorodeoxyglucose-positron emission tomography/computed tomography in the evaluation of indeterminate renal masses. Nucl Med Commun, 2011,32(4):265-272.
[7] Takahashi M, Kume H, Koyama K, et al. Preoperative evaluation of renal cell carcinoma by using18F-FDG PET/CT. Clin Nucl Med, 2015,40(12):936-940.
[8] 张建华,王荣福,范岩,等.18F-FDG PET/CT在肾脏肿物诊断中的应用.中国医学影像技术,2012,28(3):548-553.
[9] 刘红杰,王荣福,张春丽,等.肾脏不同类型恶性病变18F-FDG标准摄取最大值的比较.中国医学影像技术,2015,31(6):913-916.
[10] Fuccio C, Ceci F, Castellucci P, et al. Restaging clear cell renal carcinoma with18F-FDG PET/CT. Clin Nucl Med, 2014,39(6):320-324.
[11] 隋时,辛军.18F-FDG PET/CT预测肾透明细胞癌的Fuhrman分级.中国医学影像技术,2016,32(6):932-936.
[12] 张瀚,梁颖,吴宁,等.18F-FDG PET/CT在肾癌诊断中的应用价值.癌症进展,2012,10(5):445-448.
[13] Dimarco DS, Lohse CM, Zincke H, et al. Long-term survival of patients with unilateral sporadic multifocal renal cell carcinoma according to histologic sub-type compared with patients with solitary tumors after radical nephrectomy. Urology, 2004,64(3):462-467.
18F-FDG PET/CT in diagnosis of renal cell carcinoma
ZHUAnhui,ZHANGWeifang*
(DepartmentofNuclearMedicine,PekingUniversityThirdHospital,Beijing100191,China)
Objective To evaluate the value of18F-FDG PET/CT in diagnosis of renal cell carcinoma (RCC). Methods Totally 32 patients with RCC confirmed by pathology were analyzed retrospectively. The tumor diameter and maximum standard uptake values (SUVmax) of different pathological types (clear and none clear RCC), different Fuhrman grades (high grade and low grade of clear RCC) and different clinical stages (distant and without distant metastases) were analyzed and compared. Results 32 RCC patients including 33 primary tumors, 31 lesions were detected by PET/CT and 2 were false negative, the detection rate was 93.94%. The PET/CT findings of 31 primary lesions were mixed density soft tissue masses, and the18F-FDG uptake accessible, above or below to the normal renal parenchyma; the other 2 lesions of PET/CT findings were normal.18F-FDG uptake of vein tumor thrombus in 8 cases and metastases in 19 cases were higher than the organs affected. The tumor diameter and SUVmaxhad no statistically significant difference in different pathological types and Fuhrman grades; The tumor diameter had no statistically significant difference, and SUVmaxhad statistically significant (t=3.852,P=0.001) between different clinical stages. Conclusion The PET/CT findings of RCC primary lesion are varied, and small clear RCC with low Furhman grade may have no obvious abnormality and missed diagnosis;18F-FDG PET/CT has important value in the preoperative staging of RCC.
Carcinoma, renal cell; Positron-emission tomography; Tomography, X-ray computed; Fluorodexyglucose F18
祝安惠(1976—),女,四川冕宁人,博士,副主任医师。研究方向:肿瘤影像学。E-mail: zhuanhui718@sina.com
张卫方,北京大学第三医院核医学科,100191。E-mail: tsy1997@126.com
2016-08-27
2017-01-10
10.13929/j.1003-3289.201608119
R737.11; R814.42
A
1003-3289(2017)04-0571-05
