2008-2015 年深圳某医院金黄色葡萄球菌血流感染的临床特征和预后分析
2017-06-05郑金鑫王红燕徐芹珍蒲彰雅李多云邓向斌邓启文余治健
郑金鑫, 王红燕, 徐芹珍, 蒲彰雅, 李多云, 陈 重, 邓向斌, 邓启文, 余治健
2008-2015 年深圳某医院金黄色葡萄球菌血流感染的临床特征和预后分析
郑金鑫, 王红燕, 徐芹珍, 蒲彰雅, 李多云, 陈 重, 邓向斌, 邓启文, 余治健
目的 分析深圳市南山区人民医院金黄色葡萄球菌血流感染的临床特征和起病后 30 d 内死亡相关的危险因素。方法 回顾分析 2008-2015 年由金黄色葡萄球菌所致血流感染患者的临床和微生物学资料,分析 30 d 内死亡相关危险因素。结果 共 121 例患者入组,其中 MRSA 血流感染检出率为 17.4%(21/121)。相比较于 MSSA 血流感染,MRSA 血流感染中年龄≥65 岁老年患者更多、医院感染和呼吸道感染更为常见(P 值分别为 0.026、0.035 和 0.001);并且 MRSA 血流感染患者中复数菌感染更多和接受了更多的不恰当初始抗感染治疗(P 值分别为 0.005 和 0.001)。患者起病后 30 d 内的死亡率为 18.2%(22/121)。通过单因素和多因素回归分析示仅实体肿瘤(OR, 8.932, P = 0.004)和感染性休克(OR, 56.721,P <0.001)是患者起病后 30 d 内死亡的独立危险因素。结论 实体肿瘤和感染性休克,比 MRSA 感染在金黄色葡萄球菌血流感染患者死亡中起了更重要的作用。
金黄色葡萄球菌 ; 血流感染 ; 死亡率 ; 危险因素
金黄色葡萄球菌(金葡菌)目前仍然是引起血流感染最常见的病原菌之一,David 等[1]统计全美国年发病率可高达 26/100 000 人次。而 MRSA 引起的血流感染,因较高的发病率和病死率引起较多关注[2]。但近年研究发现自 2000 年以来,MRSA引起的血流感染,特别是医院感染中的血流感染正逐渐减少[3]。而另外一些研究也发现 MSSA 引起的血流感染正在增多或至少处于稳定状态[4-5]。
目前,国内关于金葡菌血流感染发病率等研究的结论仍然较少,而且存在较大分歧。Huang 等[6]报道 MRSA 引起血流感染的发病率仅占金葡菌血流感染的 37.5%, 而国内其他研究则可高达 57.4%甚至 63.6%[7-8]。为研究金葡菌血流感染的临床特征和起病后 30 d 内死亡相关的危险因素,收集深圳大学附属南山区人民医院 2008 年 1 月-2015 年12月金葡菌血流感染患者的临床资料进行分析。
1 材料与方法
1.1 研究对象
对我院 2008 年 1 月-2015 年 12 月血培养分离出金葡菌的全部住院患者病例进行回顾性分析,收集患者临床资料和菌株药敏资料。对每例患者计算 Charlson 合并症评分。对入住 ICU 的患者,通过简化急性生理学评分Ⅱ(SAPS II)以评估患者疾病的危重程度。对每例患者的合并症进行回顾分析。其中心血管病主要包括高血压、冠心病和心脏瓣膜性疾病。
1.2 菌株鉴定与药敏试验
菌株来自我院细菌室从各科患者血标本中分离的金葡菌。鉴定采用法国生物梅里埃公司 VITEK-2 鉴定仪。药敏纸片和专用琼脂由英国 OXOID 公司提供。质控菌株为金葡菌 ATCC 25923。药物敏感试验方法和判断折点采用 CLSI M2-A8 和 M100-S15 标准。
1.3 诊断标准
血流感染诊断标准系根据美国疾病预防控制中心对于血流感染的实验室诊断标准和参考文献标准:①患者≥1次血培养分离出金葡菌;②同时患者有相应感染的临床证据,至少有以下 1 项症状或体征,即发热(>38 ℃)、寒战或低血压[9-10]。血流感染来源部位根据参考文献方法判断:在血流感染前机体某部位有明确感染表现或分离出金葡菌, 则定义该部位为原发感染灶 ; 中心静脉导管末端培养出金葡菌或导管末端培养虽阴性, 但临床上未发现其他明确感染灶, 则定义为导管相关性血流感染 ;如果不能证明有明确感染病灶者, 则定义为原发感染灶不明[9]。
糖皮质激素治疗定义为静脉用激素至少超过1周。恰当的初始抗感染治疗(经验性抗感染治疗)定义为 :在血培养采集后的最初 48 h 内所用抗感染药物,血培养体外药敏结果证实其抗菌活性可覆盖病原菌[8]。复数菌感染定义为 2 种以上细菌不同部位的感染[8]。
感染途径判断根据参考文献方法:医院获得性血流感染,患者入院时不存在感染且不处于感染潜伏期, 在入院 48 h 后血培养阳性。卫生保健相关血流感染,血培养在入院 48 h 内阳性,且符合下列条件中至少 1 项,即入院前的 30 d 内接受过静脉化疗或血液透析治疗 ;入院前的 30 d 内接受家庭静脉输液治疗或伤口护理 ;入院前的 90 d内曾住院治疗超过 2 d ;长期居住在护理保健设施中。除此之外其他血流感染均认为社区获得性感染 [11-12]。
1.4 统计学方法
采 用 SPSS 14.0 软 件 进 行 统 计 分 析, 计 数资 料 组 间 比 较 采 用 χ2检 验 或 Fisher's exact test。P <0.05 为差异有统计学意义。通 过 单 因 素和多因素 Logistic 回归分析与患者起病后 30 d 内死亡相关的危险因素。采用 backward 方法建立多因素Logistic 回归分析模型,单因素分析中 P<0.05 变量纳入模型。
2 结果
2.1 一般资料
剔除重复菌株和临床资料缺失病例, 121 例金葡菌血流感染患者入选最终统计分析。其中男81例, 女 40 例, 起 病 后 30 d 内死 亡 22 例(18.2%,22/121),见表1。本研究病例合并有较多种慢性疾病和危重疾病,14.0%(17/121)患者 Charlson合并症评分≥7。20.7%(25/121)患者入住 ICU,其中 SAPS II ≥40 有 10 例(40.0 %,10/25)。
2.2 单因素分析和患者起病后 30 d 内死亡相关的危险因素
本 研 究 中 患 者 起 病 后 30 d 内 的 死 亡 率 为18.2%。单因素分析示,年龄≥65 岁和男性均不是危险因素。而患者合并慢性疾病,如实体肿瘤、消化道溃疡和脑卒中是患者起病后 30 d 内死亡的危险因素(P 值分别为 0.014、 0.017 和 0.042)。Charlson 合并症评分≥7 和 SAPS II≥40,反映患者具有较多合并症和危急重症疾病,是危险因素(P <0.001 和 P=0.001)。另外,糖皮质激素治疗和导管或其他人工装置,也是患者起病后 30 d 内死亡的危险因素(P=0.001 和 P=0.005)。
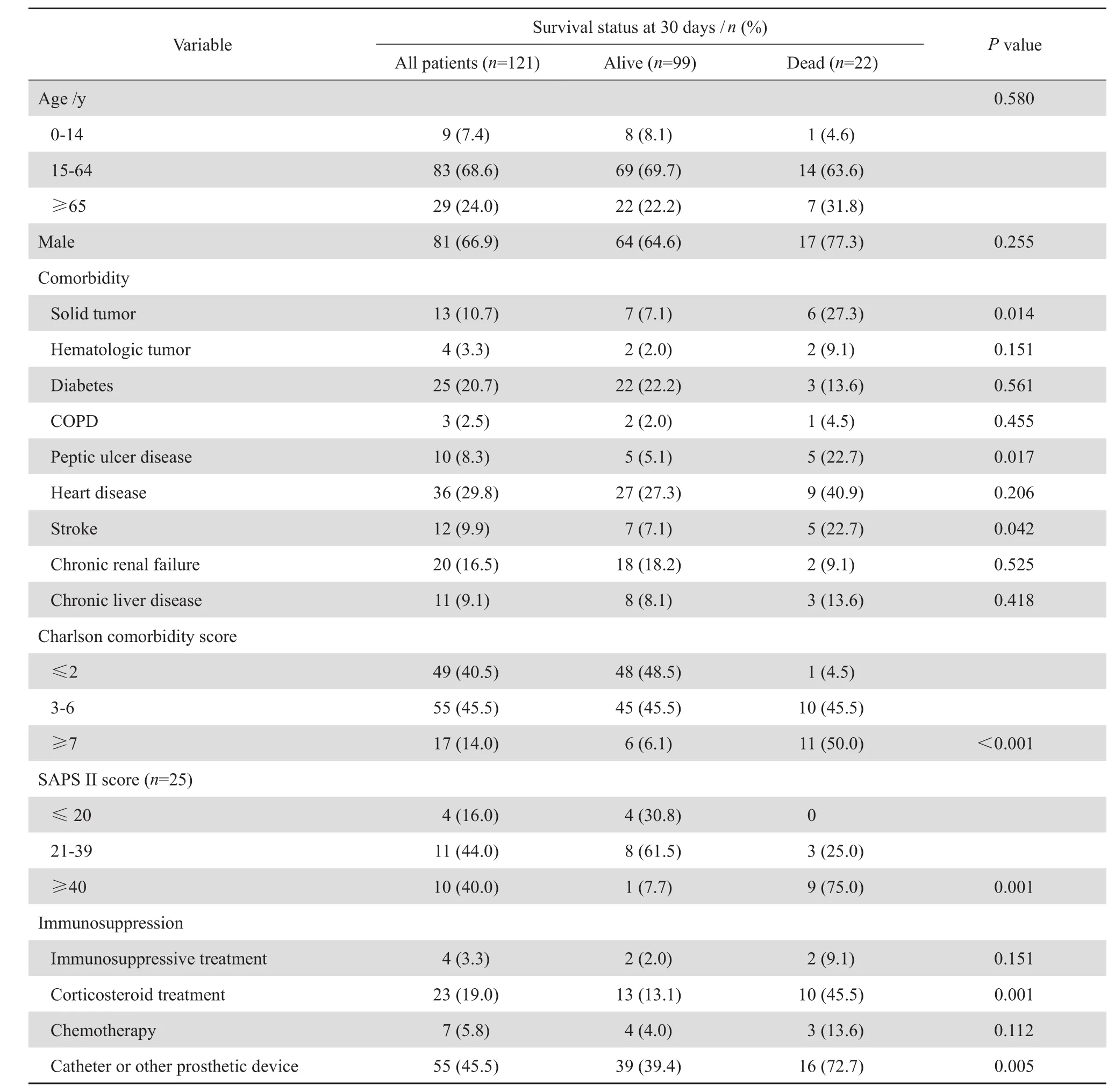
表1 患者一般临床特征和起病后 30 d 内死亡相关的危险因素分析Table 1 Clinical characteristics and risk factors for 30-day mortality in patients with bloodstream infections by univariate analysis
从细菌感染途径和来源部位分析,只有医院感染、ICU内感染和呼吸道来源感染是患者起病后30 d内死亡的危险因素(P值分别为0.005、0.001和0.013)。本研究中38例患者有复数菌感染,起病后30 d内死亡22例患者中有11例患者有复数菌感染,分别合并有其他1~5种细菌感染,常见有鲍曼不动杆菌(痰)、铜绿假单胞菌(痰)、嗜麦芽窄食单胞菌(痰或血)、屎肠球菌(痰或血)、肺炎克雷伯菌(痰)、大肠埃希菌(痰)、阴沟肠杆菌(痰), 其中痰培养细菌阳性患者其胸部X线片或CT检查诊断有支气管炎或肺部感染。复数菌感染经单因素分析是患者起病后30 d内死亡的危险因素(P=0.038)。感染性休克也是患者起病后30 d内死亡的危险因素(P<0.001)。但是本研究中MRSA血流感染和不恰当的初始抗感染治疗并不是危险因素。见表2。

表2 金葡菌血流感染的特点和起病后 30 d 内死亡相关的危险因素分析Table 2 Features of bloodstream infections caused by Staphylococcus aureus and risk factors for 30-day mortality by univariate analysis
2.3 MRSA 和 MSSA 血流感染不同特点及药敏试验
本研究中 MRSA 血流感染患者 21 例,检出率为 17.4%。相比 MSSA 血流感染,MRSA 血流感染患者中 :年龄≥65 岁者比例更高(42.9% 对20.0%,P=0.026);医院感染和呼吸道感染比例更高(61.9% 对 37.0%,P=0.035 和 81.0% 对 42.0%,P=0.001);MRSA 血流感染患者接受了更多的不恰当初始抗感染治疗(28.6% 对 3.0%,P=0.001)。21 例 MRSA 血流感染患者中,12 例为复数菌感染,分别合并其他细菌感染,常见有鲍曼不动杆菌、铜绿假单胞菌、嗜麦芽窄食单胞菌、屎肠球菌、肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌、产气肠杆菌、粪肠球菌、摩根摩根菌,其中痰培养细菌阳性患者其X线胸片或CT检查诊断有支气管炎或肺部感染(57.1% 对 26.0%,P=0.005)。见表3。
药敏试验显示,所有菌株对万古霉素、替考拉宁和利奈唑胺均敏感,但对青霉素的耐药率高达95.0%,对其他抗菌药物的耐药率从 4.1%~50.4%。 MRSA 菌株对庆大霉素、妥布霉素、左氧氟沙星、红霉素、克林霉素、利福平和莫匹罗星的耐药率均明显高于 MSSA 菌株。见表4。
2.4 多 因 素 Logistic 回 归 分 析 与 患 者 起 病 后 3300 dd 内死亡相关的危险因素
之前单因素分析中P<0.05的因素纳入多因素Logistic回归分析模型。由于实体肿瘤、消化道溃疡和脑卒中在Charlson合并症评分中起到重要作用并差异有显著统计学意义,因此这3种因素取代Charlson合并症评分≥7纳入回归分析。由于仅对ICU患者进行SAPS II评分(25例),并且感染性休克在SAPS II评分中起关键性作用,因此取代SAPS II ≥40纳入回归分析。最终实体肿瘤、消化道溃疡、脑卒中、糖皮质激素治疗、导管或其他人工装置、医院感染、ICU内感染、呼吸道来源感染、复数菌感染和感染性休克作为自变量,患者起病后30 d内死亡作为因变量进行多因素Logistic回归分析,见表5。回归分析示仅实体肿瘤(OR,8.932,95% CI,2.020~39.487;
P = 0.004) 和感染性休克(OR,56.721,95% CI,11.651~276.135;P<0.001) 是患者起病后30 d内死亡的独立危险因素。

表3 MRSA 和 MSSA 血流感染不同特点的比较Table 3 Characteristics of patients with MRSA versus MSSA bloodstream infections

表4 MRSA 和 MSSA 血流感染不同药敏特点的比较Table 4 Antibiotic resistance prof i le of MRSA versus MSSA isolates from bloodstream infections
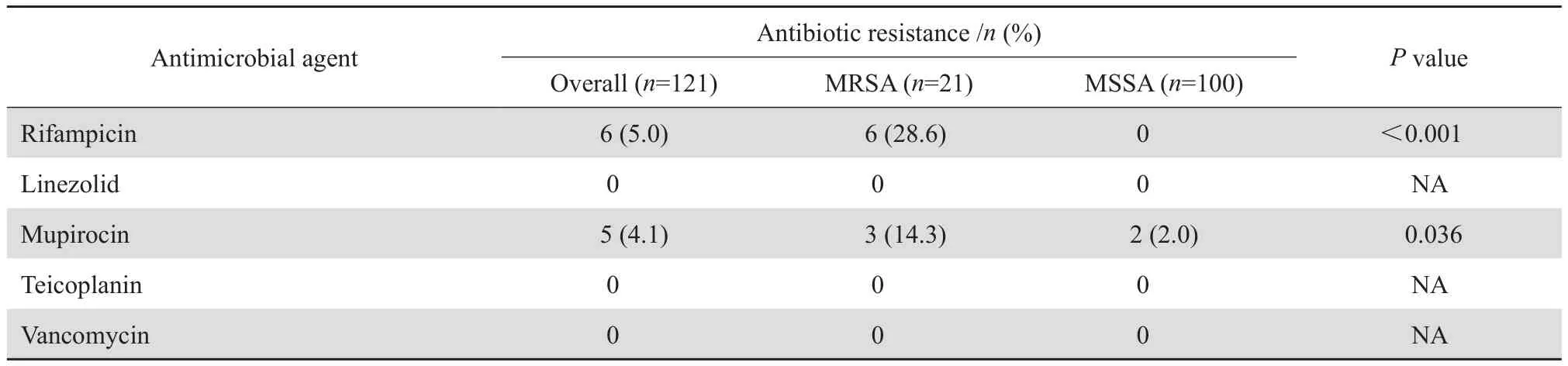
表4 (续)Table 4(continued)

表5 多因素 Logistic 回归分析与金葡菌血流感染起病后30 d 内死亡相关的危险因素Table 5 Multivariate analysis of risk factors associated with 30-day mortality in patients with S. aureus bloodstream infection
3 讨论
本研究中患者合并有较多慢性疾病,如实体肿瘤(10.7%)、心血管病(29.8%)、糖尿病(20.7%)、脑卒中(9.9%)等;大部分为男性和年龄较大患者;47.9% 金葡菌血流感染为社区获得,41.4% 为医院获得,卫生保健相关获得仅占 10.7%。Paulsen 等[13]研究显示,卫生保健相关获得金葡菌血流感染可高达 41.8%,而社区获得和医院获得血流感染仅占29.0% 和 29.2%。这种差异可能是国内患者的疾病谱与国外不同,并且医疗体制和患者就医习惯不同。本研究的 48.8% 金葡菌血流感染为呼吸道感染来源,与 Chen 等[8]研究结果一致。
本研究所有菌株对万古霉素、替考拉宁和利奈唑胺均敏感,MRSA菌株对庆大霉素、妥布霉素、左氧氟沙星、红霉素、克林霉素、利福平和莫匹罗星的耐药率均明显高于MSSA菌株,这与国内的2项研究结果相一致[7-8]。本研究金葡菌血流感染中MRSA检出率为17.4%,明显低于国内其他研究报道的57.4%甚至63.6%[7-8]。原因可能是之前研究在华东地区,而本研究在华南地区,地域不同而MRSA的流行率不同,但这些差异和原因需要更多研究证实。本研究社区获得性MRSA血流感染占到MRSA血流感染的33.3%,发病率高于其他报道[7-8]。而之前有研究将MRSA感染细分为卫生保健相关医院内发病或卫生保健相关社区发病2种感染类型[14]。因此两者存在划分标准问题。但已有研究发现卫生保健相关医院内发病MRSA感染患者更多地合并有肾衰竭、血液透析、长期居住在护理保健机构[14]。所以我们对社区获得性MRSA血流感染病例进行了仔细的回顾分析,发现这些患者感染来源多为呼吸道、皮肤和软组织。而且在本研究卫生保健相关获得血流感染病例中仅发现1例MRSA感染。
本研究对 MRSA 和 MSSA 血流感染的不同特点进行了比较,结果发现相比于 MSSA 感染,MRSA 血流感染患者中,年龄≥65 岁老年患者更多,有更多患者为医院感染和呼吸道来源感染,更高的复数菌感染和接受了更多不恰当初始抗感染治疗,这也与国内其他研究结果相似[8]。尽管在研究中 MRSA 血流感染患者接受了更多的不恰当初始抗感染治疗,但回顾分析发现这些患者随后根据药敏结果,均接受了恰当的针对性抗感染治疗,对预后未造成影响。有研究发现,MRSA血流感染患者在最初 24 h 内接受了不恰当初始抗感染治疗与起病后 30 d 内死亡密切相关[15]。
本 研 究 中 患 者 起 病 后 30 d 内 的 死 亡 率 为18.2%,通过单因素和多因素分析发现实体肿瘤和感染性休克是独立的危险因素,这与其他研究结论相似[14-15]。实体肿瘤和感染性休克不仅是金葡菌血流感染患者死亡的危险因素,也是其他病原菌如肠球菌等血流感染死亡的危险因素[16]。
综上所述,在本次研究中实体肿瘤和感染性休克是金葡菌血流感染患者死亡的危险因素。因此,在金葡菌血流感染的治疗中,应重视基础疾病的积极治疗,并注意密切监测感染性休克的发生,争取在休克早期给予及时的抗休克治疗以改善预后。
[1] DAVID MZ, DAUM RS, BAYER AS, et al. Staphylococcus aureus bacteremia at 5 US academic medical centers, 2008–2011 : significant geographic variation in community-onset infections [J]. Clin Infect Dis, 2014, 59(6): 798-807.
[2] TONG SY , DAVIS JS , EICHENBERGER E , et al. Staphylococcus aureus infections : epidemiology,pathophysiology, clinical manifestations, and management [J]. Clin Microbiol Rev, 2015, 28(3): 603-661.
[3] DANTES R, MU Y, BELFLOWER R, et al. National burden of invasive methicillin-resistant Staphylococcus aureus infections,United States, 2011 [J]. JAMA Intern Med, 2013, 173(21):1970-1978.
[4] SAN-JUAN R, VIEDMA E, CHAVES F, et al. High MICs for vancomycin and daptomycin and complicated catheter-related bloodstream infections with methicillin-sensitive Staphylococcus aureus [J]. Emerg Infect Dis, 2016, 22(6): 1057-1066.
[5] LAUPLAND KB, LYYTIKAINEN O, SOGAARD M, et al. The changing epidemiology of Staphylococcus aureus bloodstream infection : a multinational population-based surveillance study [J]. Clin Microbiol Infect, 2013, 19(5):465-471.
[6] HUANG YC, XIE Y, CHEN ZX, et al. Bloodstream infections in southwestern China : 2012 Whire Union report on bacterial susceptibility to antibiotics [J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2015, 46(1): 75-81.
[7] CHEN X, WANG WK, HAN LZ, et al. Epidemiological and genetic diversity of Staphylococcus aureus causing bloodstream infection in Shanghai, 2009-2011[J]. PLoS One, 2013, 8(9):e72811.
[8] CHEN R, YAN ZQ, FENG D, et al. Nosocomial bloodstream infection in patients caused by Staphylococcus aureus : drug susceptibility, outcome, and risk factors for hospital mortality [J]. Chin Med J (Engl), 2012, 125(2): 226-229.
[9] 路明, 姚婉贞, 王筱宏, 等 . 金黄色葡萄球菌血流感染的临床特征分析 [J].中华医院感染学杂志, 2011, 21(8): 1596-1598.
[10] 毛原飞,孙慧平,李军民 . 达托霉素治疗金黄色葡萄球菌血流感染 21 例临床分析 [J].中国感染与化疗杂志, 2016, 16(1): 30-32.
[11] PICOT-GUERAUD R, BATAILLER P, CASPAR Y, et al. Bacteremia caused by multidrug-resistant bacteria in a French university hospital center: 3 years of collection [J]. Am J Infect Control, 2015,43(9):960-964.
[12] TSENG YJ,WU JH, LIN HC, et al. A web-based, hospitalwide health care-associated bloodstream infection surveillance and classification system : development and evaluation [J]. JMIR Med Inform, 2015, 3(3): e31.
[13] PAULSEN J, MEHL A, ASKIM Å, SOLLIGARD E, et al. Epidemiology and outcome of Staphylococcus aureus bloodstream infection and sepsis in a Norwegian county 1996–2011 : an observational study [J]. BMC Infect Dis, 2015, 15 :116.
[14] WANG SH, HINES L, VAN BALEN J, et al. Molecular and clinical characteristics of hospital and community onset methicillin-resistant Staphylococcus aureus strains associated with bloodstream infections [J]. J Clin Microbiol, 2015, 53(5):1599-608.
[15] SIMOR AE, PELUDE L, GOLDING G, et al. Determinants of outcomes in hospitalized patients with methicillin-resistant Staphylococcus aureus bloodstream infection :results from national surveillance in Canada, 2008-2012[J]. Infect Control Hosp Epidemiol, 2016, 37(4): 390-397.
[16] MARSCHALL J, PICCIRILLO ML, FRASER VJ, et al. Catheter removal versus retention in the management of catheterassociated enterococcal bloodstream infections[J]. Can J Infect Dis Med Microbiol, 2013, 24(3): e83-e87.
Bloodstream infections caused by Staphylococcus aureus in a university hospital center in Shenzhen, 2008-2015
ZHENG Jinxin, WANG Hongyan, XU Qinzhen, PU Zhangya, LI Duoyun, CHEN Zhong, DENG Xiangbin, DENG Qiwen, YU Zhijian.
(Department of Infectious Diseases, Shenzhen Key Laboratory for Endogenous Infection, Shenzhen Nanshan Hospital, Shenzhen University, Shenzhen Guangdong 518052, China)
Objective This study was designed to examine the clinical characteristics of bloodstream infections (BSI) caused by Staphylococcus aureus in a teaching hospital and the risk factors for 30-day mortality. Methods A single center retrospective cohort study was conducted for all the patients with BSI caused by S. aureus between 2008 and 2015. The data of clinical features, microbiology, and 30-day mortality were collected from the database of electronic medical records. Results A total of 121 patients with S. aureus BSI were identif i ed. The prevalence of methicillin-resistant S. aureus (MRSA) was 17.4% (21/121). MRSA BSIs were signif i cantly associated with old age (≥65 years) (P=0.026), hospital acquired infection (P=0.035), respiratory tract infection (P=0.001), polyinfection (P=0.005) and inappropriate initial antibiotic therapy (P=0.001) than methicillin-sensitive S. aureus (MSSA) BSIs. The 30-day mortality was 18.2% (22/121). Both univariate and multivariate analysis suggested that solid tumor (OR, 8.932, P=0.004) and septic shock (OR, 56.721, P<0.001) were independently associated with the 30-day mortality. Conclusions The present study confirms that solid tumor and septic shock are more important risk factors than MRSA in mortality of patients with S. aureus BSI.
Staphylococcus aureus; bloodstream infection; mortality; risk factor
R453.2
:A
:1009-7708 ( 2017 ) 03-0238-07
10.16718/j.1009-7708.2017.03.002
2016-05-17
2016-10-16
深 圳 市 科 技 创 新 - 知 识 创 新 计 划 项 目(JCYJ20150402152130167,JCYJ20150402152130173);深圳市卫生计生系统科研项目(201601058)。
深圳大学附属南山区人民医院感染疾病科,深圳市内源性感染诊治重点实验室,广东深圳 518052。
郑金鑫(1982—),男,博士,副主任医师,主要从事细菌耐药机制相关研究。
余治健,E-mail:yuzhijiansmu@163.com。
