急性应激大鼠的海马DG区兴奋性氨基酸在空间学习记忆中的变化
2017-06-05金美玉吴建龙金清华李英顺
金美玉,吴建龙,金清华,李英顺*
(1.吉林大学校医院 内科,吉林 长春130012;2.延边大学医学院 生理学与病理生理学教研室,吉林 延吉133002;3.北京华图宏阳教育问卷发展股份有限公司 吉林分公司,吉林 长春130061)
急性应激大鼠的海马DG区兴奋性氨基酸在空间学习记忆中的变化
金美玉1,吴建龙2,3,金清华2,李英顺2*
(1.吉林大学校医院 内科,吉林 长春130012;2.延边大学医学院 生理学与病理生理学教研室,吉林 延吉133002;3.北京华图宏阳教育问卷发展股份有限公司 吉林分公司,吉林 长春130061)
目的 观察海马齿状回(DG)区两种兴奋性氨基酸在急性应激模型大鼠空间学习记忆中的变化,初步探讨应激影响空间学习记忆的部分神经化学机制。方法 本实验采用束缚大鼠2 h的方法制备急性应激模型,观察大鼠空间学习记忆能力和海马DG区的谷氨酸(Glu)和天冬氨酸(Asp)的含量变化,分别利用Morris水迷宫和脑部微量透析法和高效液相色谱法。 结果 1)在Morris水迷宫的定位航行实验中,急性应激组的平均逃避潜伏期明显长于对照组(P<0.05);而在空间探索实验中,穿越原站台区次数两组间无显著性差异(P>0.05)。2)在MWM训练第二天,海马DG区Asp含量在对照组有增加趋势,而在急性应激组有下降趋势,两组间比较有统计学意义(P<0.05);两组大鼠海马DG区Glu的含量均未出现明显的变化。结论 急性应激降低大鼠的空间学习能力,这可能与海马DG区Asp的降低相关。
急性应激;海马齿状回;空间学习和记忆;兴奋性氨基酸
(ChinJLabDiagn,2017,21:0893)
应激反应是指机体受到诸如寒冷、疼痛、饥饿、创伤、紧张、焦虑等一些有害刺激时伴随着肾上腺皮质激素等多种激素升高的一系列非特异性适应性反应,可提高机体对伤害性刺激的耐受力[1]。有研究表明,与适度应激刺激可提高学习记忆能力相比,过强的急性应激或长期的慢性应激刺激反而会使人和动物的学习记忆能力受到明显的损害[2]。海马和前额叶是脑区中与学习记忆功能有密切相关的重要结构,也是应激易受累部位[3]。其中,海马既受应激刺激的影响又参与应激的调节[4-6]。血中糖皮质激素浓度升高作为不良应激危害发生的主要原因之一,常常以海马为其攻击的主要靶区[7,8]。有报道说,当急性应激或长期外源性应激激素(主要为糖皮质激素)处理后,发现海马依赖的学习记忆能力明显损伤,提示应激引起突触体结构和树突形态的改变、神经发生抑制等可能性[9,10]。在动物海马的CA1、CA3和齿状回(dentate gyrus,DG)三个功能亚区中,DG区是成熟动物神经发生的唯一被公认部位,而动物记忆能力受损的强度与海马区细胞数目不同程度的损伤有直接关系[4]。虽然这些研究表明,海马的功能易受应激的影响,但有关应激对海马区学习记忆的作用机制,尤其是涉及神经递质的神经化学机制研究较少。谷氨酸(glutamate,Glu)和天冬氨酸(asparate,Asp)是较为公认的兴奋性氨基酸递质,它们的分布和作用相互重叠,其中Glu是海马信息传递的主要承担者,而且我们先前的研究发现海马DG区的Asp和Glu可能参与主动回避学习的信息传递过程[11]。因此,本实验以海马DG区为主要研究靶区,观察Asp和Glu在学习记忆过程中的含量变化,为急性应激对大鼠空间学习记忆影响的神经化学机制的探讨提供部分依据。
1 材料与方法
1.1 实验动物和分组
选用体重为300±20 g的 Wistar系雄性大鼠,(由延边大学动物实验中心提供),随机分为急性应激组和对照组,每组6只,专用实验室内分笼饲养,室温22-24℃,自由摄食和饮水。
1.2 微量透析探针的插入和急性应激模型的制备
大鼠腹腔注射10%水合氯醛(300 mg/kg)麻醉并固定在脑立体定位仪上。碘伏消毒,剪开头皮,暴露前后囟,参照Paxinos和watson图谱,将透析探针用的外套管固定在一侧海马DG区高于1.5 mm的部位(坐标为:AP 3.2 mm;L/R 1.6 mm;H 2.5 mm),并用牙科水泥固定于颅骨上。术后第二天,在动物清醒状态下经外套管插入自制微量透析探针用蜡固定好,后者超出外套管1.5 mm,尖端为乙酸纤维素半透膜(直径0.2 mm,滤过物质分子量小于50000的物质)。术后第三天制备急性应激模型,其具体步骤如下:大鼠用乙醚麻醉,放入束缚器中,随后将四肢固定在束缚器上,待大鼠清醒后进行2 h的急性束缚应激,对照组除了不进行束缚,其他过程均与急性应激组相同。模型制备完成后马上进行下一步的微量透析和行为学实验。
1.3 Morris水迷宫检测
Morris水迷宫(Morris water maze,MWM)系统中测试用圆形水池直径120 cm、高60 cm,水池中水面高约45 cm,圆形有机玻璃平台任意放置于某一象限的中心位置,其直径10 cm、高40 cm,淹没于水面下约2 cm处。室温及水温均保持在22±2℃。由距水面上方1.5米处连接于路径追踪系统的摄像机跟踪拍摄和采集大鼠游泳图像,通过电脑进行分析。在连续4天的MWM定位航行实验中,记录大鼠自入水到找到站台后四肢爬上站台所需时间即逃避潜伏期作为大鼠学习能力的检测指标。在MWM实验第5天,去除站台,进行空间探索实验。记录大鼠穿越原站台区次数作为大鼠记忆能力的检测指标,即每只大鼠从同一位点入水后120 s内游经原站台区的次数。
1.4 海马DG区的微量透析和两种氨基酸浓度的测定
透析探针连接微量泵灌流Ringer’s液(147 mM NaCl,4 mM KCl,2.3 mM CaCl2,pH 6.5),灌流速度为1.5 μl/min,灌流30分钟后开始收集样本,每个样本收集10分钟,每次收集三个样本,取平均值。将12 μl的样本与3 μl的4 mM OPA溶液混合,常温下反应2.5 min后抽取10 μl的反应液,利用手动进样器注入到生物活性物质微量分析系统(HTEC-300,Eicom,Japan),经高效液相色谱分离柱和电化学检测器测定各个样本中的Glu和Asp的浓度。
1.5 组织学鉴定
实验结束后,将动物断头取脑,用10%福尔马林溶液固定脑组织三天后进行冰冻切片、中性红染色,鉴定微量透析探针到达部位,数据统计只采用探针进到海马DG区者。
1.6 统计学处理

2 结果
2.1 急性应激模型大鼠的空间学习记忆能力的变化
两组大鼠在为期4天的MWM定位航行训练中,其逃避潜伏期均有不同程度的缩短的趋势,提示空间学习的形成过程,但急性应激组在第二天的潜伏期明显长于同一天的对照组(P<0.05,见图1)。急性应激组的平均潜伏期为64.37±8.59s,与对照组(37.73±4.78s)相比明显延长(P< 0.05)。见图1B)。训练第5d移除平台,进行空间探索实验,结果显示,120s内穿越原平台区次数虽然在急性应激组有下降的趋势,但两组间无统计学差异(P>0.05,图2)。
2.2 急性应激对海马DG区Asp和Glu浓度的影响

*P<0.05,与对照组相比

图2 急性应激对MWM空间探索实验中的穿越原站台区次数的影响
与对照组大鼠相比,急性应激组大鼠海马DG区细胞外液中的Asp和Glu基础水平均有下降的趋势,但两组间无显著性差异(均为P>0.05,图3)。在5d的MWM训练过程中,训练第二天的大鼠海马DG区细胞外液中的Asp含量,在对照组有增加趋势,而在急性应激组有下降趋势(但无统计学意义,均为P>0.05),两组间有显著性差异(P<0.05,见图4)。两组大鼠海马DG区细胞外液中的Glu含量在5d的MWM训练过程中均未出现明显的变化(均为P>0.05,图5)。
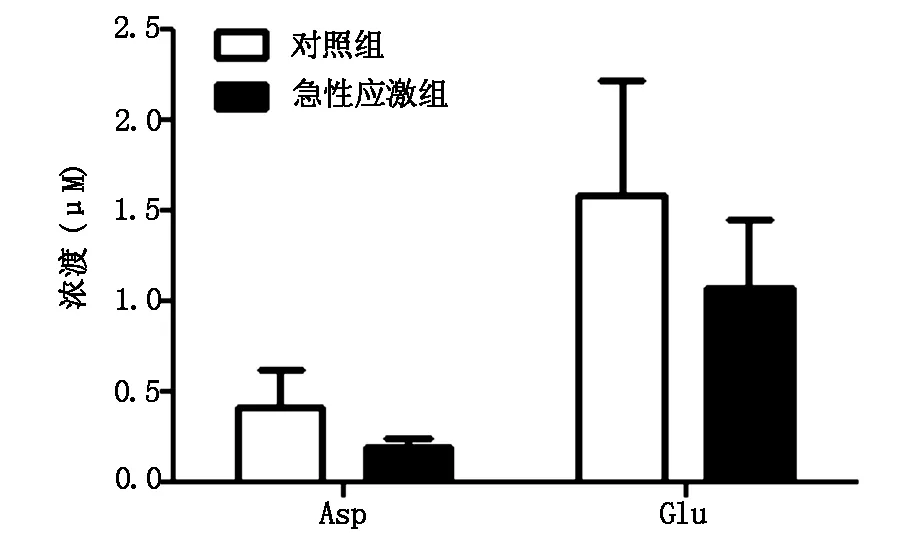
图3 急性应激对海马DG区Asp和Glu基础浓度的影响

*P<0.05,与对照组相比

图5 急性应激对MWM训练过程中的海马DG区Glu浓度的影响
3 讨论
当今世界中人们为了适应节奏逐渐加快的竞争和发展,常常需要承受来自社会不同方面的种种压力,而这些压力经常使人们处于不同程度的应激状态,可见,应激是一种广泛存在于人类生活中的事件。应激作为机体对体内、外有害刺激所做出的非特异性防御反应,对维持机体生命活动具有极其重要的意义,另一方面,它也可能产生负面影响成为许多疾病的重要诱因。应激可以按刺激持续时间的长短分为急性和慢性应激,其中急性应激的应激原一般指的是持续时间较短的突发的、不重复的事件。为了探讨急性应激影响海马学习记忆功能的部分神经化学机制,本实验采用急性束缚2h的方法制备了大鼠急性应激模型,并用MWM系统观察了急性应激对大鼠空间学习记忆的影响,结果显示,急性应激可以部分损害大鼠的空间学习能力。
如前所述,海马作为空间学习和记忆形成的关键部位,在脑区中最容易受急性应激或应激激素的影响[3,7,8]。在中枢神经系统中,Glu和Asp作为典型的兴奋性氨基酸类递质均作用于促离子型谷氨酸能受体,其作用相互交叉[12]。研究表明,兴奋性氨基酸及其NMDA受体在海马内信息传递过程中承担着重要角色[13],且本实验室先前的研究也提示海马DG区的Asp和Glu可能参与主动回避学习过程[11]。因此,本实验以海马DG区Glu和Asp为研究靶点,利用脑部微量透析法和高效液相色谱法测定上述两种物质在空间学习记忆过程中发生的含量变化,探讨急性应激损害空间学习能力的部分神经化学机制。本实验结果显示,在急性应激延长大鼠逃避潜伏期的MWM训练第二天,海马DG区Asp含量明显低于对照组,提示急性束缚应激引起的大鼠空间学习能力下降,可能与学习过程中海马DG区Asp水平减少有关。
[1]BRoozendaal.Stressandmemory:Opposingeffectsofglucocorticoidsonmemoryconsolidationandmemoryretrieval[J].NeurobiolLearnMem,2002,78(3):578.
[2]HSelye.Asyndromeproducedbydiversenocuousagents[J].JNeuropsychiatryClinNeurosci,1998,10(2):230.
[3]SGlazer,TA,Stetz,LIzso.Effectsofpersonalityonsubjectivejobstress:aculturalanalysis[J].Personality&IndividualDifferences,2004,37(3):645.
[4]蔡伟雄,杨德森.应激与海马[J].法医学杂志,2002,18(1):48.
[5]BSMcewen.Effectsofadverseexperienceforbrainstructureandfunction[J].BiolPsychiatry,2000,48:721.
[6]EGould,PTanapat,TRydel,etal.Regulationofhippocampalneurogenesisinadulthood.BiolPsychiatry,2000,48(8):715.
[7]马 强.应激对海马的影响及损伤机理的研究进展[J].解放军预防医学杂志,2000,18(5):456.
[8]RMSapolsky.Whystressisbadforyourbrain[J].Science,1996,273(5276):749.
[9]HBLi,RRMao,JCZhang,etal.AntistresseffectofTRPV1channelonsynapticplasticityandspatialmemory[J].BiologicalPsychiatry,2008,64(4):286.
[10]EGould,BSMcEwen,PTanapat,etal.NeurogenesisinthedentategyrusoftheadulttreeshrewisregulatedbypsychosocialstressandNMDAreceptoractivation[J].JNeurosci,1997,17(7):2492.
[11]刘巧凤,金清华,申贤淑,等.习得性长时程增强中清醒大鼠海马齿状回几种氨基酸的变化[J].中国临床康复,2006,10(38):71.
[12]SNakanishi.Moleculardiversityofglutamatereceptorsandimplicationsforbrainfunction[J].Science,1992,258:597.
[13]GLCollingridge,SJKehl,McLennanH.ExcitatoryaminoacidsinsynaptictransmissionintheSchaffercollateral-commissuralpathwayoftherathippocampus[J].Physiol,1983,334:33.
Changes of excitatory amino acids in hippocampal dentate gyrus during spatial learning and memory in a rat model of acute stress
JINMei-yu,WUJian-long,JINQing-hua,etal.
(DepartmentofInternalMedicine,JinlinUniversityHospital,Changchun130012,China)
Objective To observe the changes of asparete (asp) and glutamate (Glu) levels in the hippocampal dentate gyrus (DG) in a rat model of acute stress (AS) during Morris water maze (MWM) test,and to investigate neurochemical mechanism responsible for spatial learning and memory abnormity induced by acute stress.Methods AS model was prepared by 2 h restraint,and then the spatial learning and memory of rats were measured by Morris water maze (MWM) test,and the extracellular concentration of Asp and Glu in the DG were simultaneously determined by in vivo microdialysis and HPLC.Results 1) Compared with the control group,the mean escape latency was significantly increased in AS group (P<0.05).2) In AS group,the extracelluar concentration of Asp in the DG was significantly lower than that in control group on the 2nd day of MWM test (P<0.05); and Glu levels in the DG were not changed during MWM test in each group.Conclusion The lesion of spatial learning in AS model rats may be associated with the decrease of Asp in the hippicampal DG region.
acute stress; hippocampal dentate gyrus; spatial learning and memory; excitatory amino acids
吉林省卫生厅卫生计生科研计划项目(2015z053);延边大学自然科学基金(602013110)
*通讯作者
1007-4287(2017)05-0893-04
R338
A
金美玉(1968-),女,硕士,副主任医师,研究方向为神经内科学;李英顺(1968-),女,硕士,副教授,研究方向为神经生理学。
2016-11-25)
