DPPH法测定茄叶斑鸠菊不同极性部位的抗氧化活性
2017-06-01史资陈新刘梁
史资,陈新,刘梁
(武汉轻工大学生物与制药工程学院,湖北武汉430023)
DPPH法测定茄叶斑鸠菊不同极性部位的抗氧化活性
史资,陈新*,刘梁
(武汉轻工大学生物与制药工程学院,湖北武汉430023)
通过萃取手段将植物分为不同极性部位,并利用DPPH法研究茄叶斑鸠菊不同极性部位的抗氧化活性。通过试验研究表明,不同极性部位都具有一定的抗氧化能力,且在相同浓度的条件下,氯仿层浸膏、乙酸乙酯层浸膏、正丁醇层浸膏、总提物、石油醚层浸膏所表现出的抗氧化能力依次减弱,且氯仿层和乙酸乙酯层浸膏抗氧化能力突出,具有开发价值。
茄叶斑鸠菊;不同极性部位;DPPH;抗氧化活性
茄叶斑鸠菊(Vernonia solanifolia Benth)为菊科(Compositae)斑鸠菊属(Vernonia)植物的一种,该植物主要产地分布于国内的南方地区、东南亚、南亚等地。迄今为止,自斑鸠菊属植物中分离出的化学成分种类较多,生物活性多样,包括甾体、萜类、黄酮类、苯丙素类、脂肪酸等[1]。药理学研究表明,其药理活性主要集中在抗肿瘤、免疫和抗感染活性[2-4],目前国内对斑鸠菊属植物的抗肿瘤活性成分研究较多,有些研究已在药品、食品及工业等领域得到一定的应用。而对于其抗氧化活性研究较少,杨丹等[5]对叉枝斑鸠菊中低极性成分及不同萃取部分做了抗氧化活性测试,并证实了正丁醇部位具有一定的抗氧化活性。本次试验以维生素C作为阳性对照[6],应用DPPH[7]法研究茄叶斑鸠菊的不同极性部位抗氧化活性能力。
1 材料与方法
1.1 材料与试剂
茄叶斑鸠菊(Vernonia solanifolia Benth):采于福建省,经鉴定为菊科(Compositae)斑鸠菊属(Vernonia)全株植物;DPPH:凯玛生化(天津)有限公司;甲醇、石油醚、氯仿、乙酸乙酯、正丁醇均为分析纯。
1.2 仪器
紫外-可见分光光度计:上海元析仪器有限公司;超声波清洗器:宁波新芝生物科技股份有限公司;电子分析天平:梅特勒-托利多仪器(上海)有限公司;旋转蒸发仪:艾卡(广州)仪器设备有限公司;真空干燥箱:上海新苗医疗器械制造有限公司;粉粹机:天津市泰斯特仪器有限公司;100 μL~1 000 μL、1 mL~5 mL移液枪:上海泰坦科技股份有限公司。
1.3 方法
1.3.1 各极性部位样品制备
取晒干后的茄叶斑鸠菊500 g,粉粹成粗粉,用2 L甲醇超声辅助提取3次,浸提液抽滤合并后用旋转蒸发仪减压回收甲醇,得到总浸膏,取出少量总浸膏作为总提物样品,再将剩余总浸膏用适量水分散,得混悬液,再依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取3次,合并各萃取液减压浓缩得到各部位浸膏,再放入真空干燥箱中干燥24 h后备用。
1.3.2 DPPH溶液的配制
精密称取DPPH 10.1 mg,甲醇溶解,定容至25 mL,再吸取10 mL定容至100 mL容量瓶中得到浓度为40.4 mg/L DPPH储备液。
1.3.3 阳性对照组VC原溶液制备
精密称取VC10 mg,用甲醇定容至10 mL容量瓶,得到浓度为1 mg/mL的VC原溶液。
1.3.4 各极性样品原液的配制
取各极性部位样品50 mg,分别用甲醇溶解并定容至10 mL容量瓶中,得到浓度为5 mg/mL的样品原液。
1.3.5 不同浓度的试验样品液准备
1.3.5.1 不同浓度的VC溶液配制
分别精密吸取VC原溶液0.01、0.02、0.04、0.08、0.12、0.16、0.20 mL,用甲醇定容至10 mL容量瓶中,得到浓度为0.001、0.002、0.004、0.008、0.012、0.016、0.02 mg/mL的VC样品液。
1.3.5.2 不同浓度的各极性部位样品液配制
分别吸取各极性样品原液0.04、0.08、0.12、0.2、0.4、0.8、1.2、1.8 mL,甲醇溶解,定容至10 mL容量瓶中,得到浓度为0.02、0.04、0.06、0.1、0.2、0.4、0.6、0.9 mg/mL的样品液。
1.3.6 各样品溶液与DPPH溶液反应时间的确定
由于许多抗氧化剂与DPPH自由基的反应动力学不同,或者甚至不反应,所以,物质与DPPH自由基的反应达到平衡所用时间不同,因此,针对于不同原料,需要测定其达到反应平衡所需要的时间[8]。
以浓度为0.9 mg/mL的各极性部位样品液为参考,各吸取2 mL样品液与2 mL DPPH溶液混合均匀,以517 nm为测定波长[9],每隔2 min测一次吸光度,记录数值,直到吸光度趋于稳定为止,将吸光度值与时间的关系做一曲线,见图1。
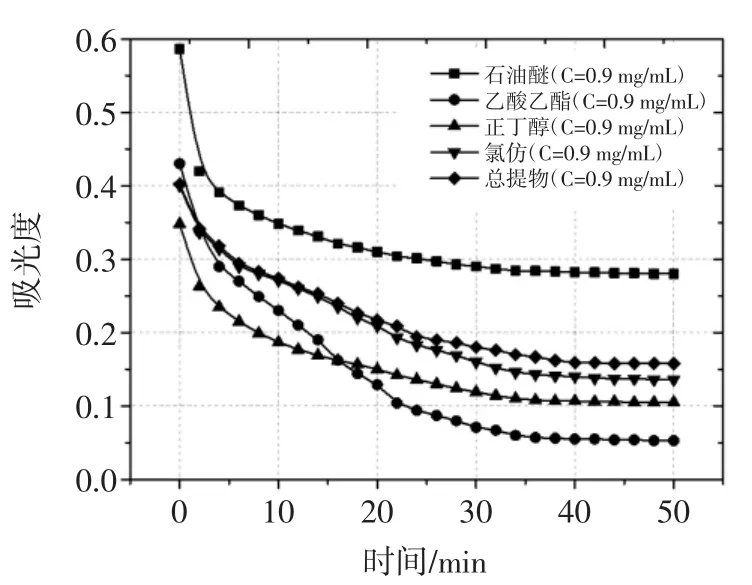
图1 各极性部位样品液吸光度随时间变化的曲线Fig.1Absorbance curve of different polar parts changes over time
由图1可知,不同极性部位样品液加入到DPPH溶液后,吸光度值在0~30 min内,变化较为明显,在30 min~40 min之间,变化趋势趋于稳定,为了使反应充分,测得数据更可靠,所以将反应时间确定为40 min。
1.3.7 样品液对DPPH自由基清除率的测定方法
以517 nm为测定波长,以甲醇为参照调零,先精密吸取2 mL DPPH溶液与2 mL甲醇混合均匀,用紫外-分光光度计测定吸光度,记为A0,再分别量取不同浓度的VC样品液及不同极性部位的样品液2 mL与2 mL甲醇混合均匀,用紫外-分光光度计测各混合液的吸光度,记为Aj,最后吸取不同浓度的VC样品液和不同极性部位的样品液2 mL与2 mL DPPH溶液混合均匀,静置40 min后测定吸光度,记为Ai,每组数据平行测定2次取平均值后代入公式计算清除率(SR)%。

2 结果与分析
2.1 各极性部位对自由基清除率结果
各极性部位对自由基清除率结果见表1。

表1 各极性部位对自由基清除率Table 1Free radical scavenging rate of different polar parts
2.2 各极性部位不同浓度下的清除率曲线
根据表1测得的数据,制作各极性部位不同浓度下的清除率曲线,见图2。
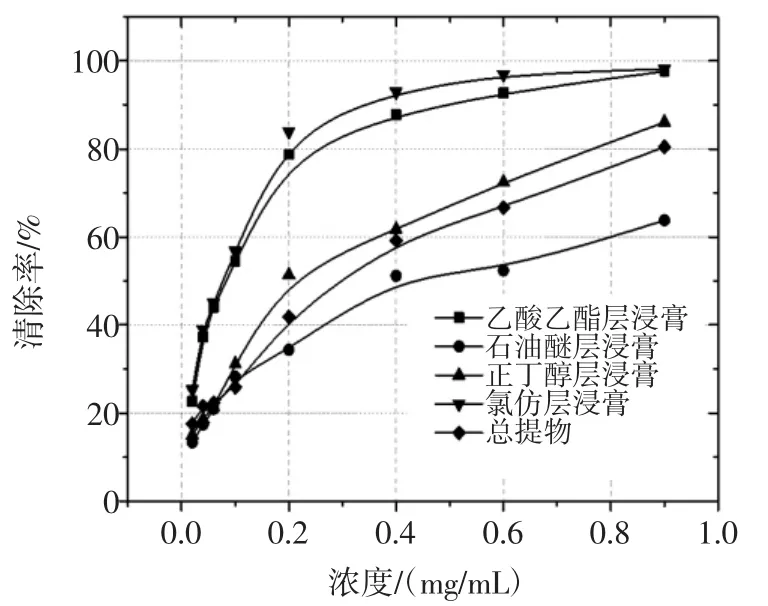
图2 各极性部位不同浓度下的清除率曲线Fig.2Clearance rate curve of different polar parts under different concentrations
从图2所显示的趋势得知,不同极性部位对DPPH自由基的清除效果有差异,各极性部位浓度在0~0.2 mg/mL之间,变化明显,且具有一定的线性关系,浓度在0.2 mg/mL~0.9 mg/mL之间,变化趋势放缓。并且在同一浓度下,各部位表现出的清除自由基能力大小为氯仿>乙酸乙酯>正丁醇>总提物>石油醚,且氯仿和乙酸乙酯部位作用更明显,浓度在0.2 mg/mL的情况下,清除率分别达到83.96%、78.74%。
2.3 VC样品液清除率曲线
根据1.3.7测得的VC样品清除率数据,绘制清除率曲线,见图3。
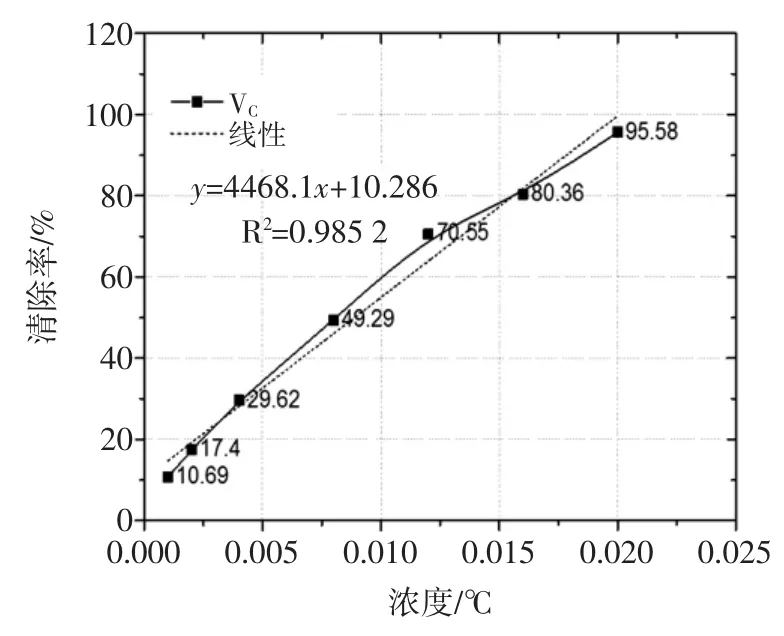
图3 不同浓度的VC样品液清除率曲线Fig.3Clearance rate curve of VCsamples with different concentrations
由图3可知,不同浓度的VC样品液在较低浓度下线性关系较好,表现出的对自由基的清除率较高,可用于与植物提取物的对照当中。
3 结论与讨论
通过试验得出,氯仿和乙酸乙酯部位清除自由基能力明显高于其他部位,浓度在0.9 mg/mL时,清除率分别达到98.05%、97.62%。和图3中VC相比,虽然在同浓度下,VC表现出的抗氧化能力强于氯仿和乙酸乙酯部位,但是这两个部位还处在粗提阶段,相对于VC而言,抗氧化成分所占百分比较小,今后这两个部位可以进一步提纯,纯化抗氧化活性成分,开发出一种天然抗氧化剂。针对于此种植物的抗氧化活性研究尚属第一次,且效果较好,为以后开发其抗氧化产品奠定了理论基础。
DPPH(1,1-二苯基-2-三硝基苯肼)法是一种常用的体外评价和筛选物质抗氧化活性的方法,具有技术成熟、重现性好、灵敏度高、操作简单等优点[10],现已广泛应用于自由基清除能力的分析中。
利用DPPH溶液的深紫色吸光度变化作为清除自由基能力的分光光度测定[11]。在试验过程中,观察到不同浓度的样品溶液加入到DPPH溶液中,溶液的深紫色由低浓度到高浓度逐渐变浅,在较高浓度下,溶液呈黄色溶液,测得的吸光度值也逐渐变小,这一现象符合理论事实。
[1]孙美利,李蕾,张舒媛,等.斑鸠菊属药用植物化学成分研究[J].长春中医药大学学报2014,30(3):414-416
[2]孙力,巴玉兰,于鲁海,等.斑鸠菊属植物药理活性研究进展[J].新疆中医药,2009,27(6):82-85
[3]孙力,李红健,于鲁海,等.驱虫斑鸠菊抗肿瘤化学成分的初步研究[J].中国现代中药,2011,13(12):26-28
[4]梁侨丽,闵知大.咸虾花有效部位的化学成分研究[J].南京中医药大学学报,2008,24(3):192-193
[5]杨丹,刘贤贤,张业,等.叉枝斑鸠菊低极性GC-MS分析及抗氧化活性测试[J].安徽农业科学,2015,43(2):97-99
[6]胡楚娇,王崇云,和兆荣,等.基于DPPH法对紫茎泽兰提取物抗氧化活性的研究[J].杂草科学,2013,31(4):9-12
[7]成兰英,梁书凤,张治强.DPPH法研究麦冬提取物抗氧化活性[J].精细化工,2012,29(9):870-874
[8]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-321
[9]董秀英,吕青涛,张国英,等.DPPH法测定九州虫草不同极性部位抗氧化活性[J].中国实验方剂学杂志,2011,17(10):70-73
[10]JIN Jie,LI Zhixi,ZHANG Feng.Scavenging function of mulberry vinegar extractives for 1,1-diphenyl-2-picrylhydrazyl(DPPH)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry,2006,34(3):135-137
[11]Chandrasekar D,Madhusudhana K.Determination of DPPH free radical scavenging activity by reversed-phase HPLC:A sensitive screening method for polyherbal formulations[J].Journal of Pharmaceutical and Biomedical Analysis,2006,40:460-464
Antioxidant Capacity of Different Polar Parts from the Vemonia solanifolia Benth by DPPH Method
SHI Zi,CHEN Xin*,LIU Liang
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,Hubei,China)
The plants are divided into different polar parts by means of extraction,and to study the antioxidant activity of different polar parts from the Vemonia solanifolia Benth with the method of DPPH.The experimental study shows that different polar parts have certain antioxidant ability,and under the condition of the same concentration,chloroform extract and ethyl acetate layer extract,n-butanol extract,total extract,petroleum ether extract showed the antioxidant capacity decreased in turn,and chloroform and ethyl acetate extract antioxidant capacity is outstanding,it has the development value.
Vernonia solanifolia Benth;different polar parts;DPPH;antioxidant activity
10.3969/j.issn.1005-6521.2017.09.005
2016-09-06
国家自然科学基金项目(31370369)
史资(1990—),男(汉),在读硕士,研究方向:天然活性成分研究与开发。
*通信作者:陈新(1978—),男(汉),教授,博士,研究方向:食品功能成分研究与开发。
