柠檬酸酯化对原淀粉和预糊化淀粉性能的影响
2017-06-01周中凯杨蕊申晓钰
周中凯,杨蕊,申晓钰
(天津科技大学,天津300457)
柠檬酸酯化对原淀粉和预糊化淀粉性能的影响
周中凯,杨蕊,申晓钰
(天津科技大学,天津300457)
以高直链玉米淀粉为原料,通过湿热处理制备预糊化淀粉,然后分别进行柠檬酸酯化处理。利用体外消化模型、傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR)、扫描电镜(Scanning electron microscopy,SEM)和热重分析(Thermogravimetricdifferentialthermalanalyzer,TG)等方法研究两种高直链淀粉性质的差异。结果表明,与原淀粉相比,预糊化处理更显著提高淀粉的酯化程度并相应地降低其消化率。两种酯化淀粉性质比较发现,预糊化淀粉的柠檬酸酯化会导致比原淀粉的柠檬酸酯化样品更低的消化率,这种低消化率的发生与其高取代度有关,其关联性通过傅立叶变换红外光谱的特征吸收验证。同时,TG分析表明,柠檬酸酯化的预糊化淀粉其热分解温度更高,热稳定性更强。这些结构特征均可能与其低消化率有关。本研究的深入对于进一步提高淀粉中的抗性淀粉含量具有一定的指导意义。
高直链玉米淀粉;抗性淀粉;柠檬酸酯化;抗消化性
膳食纤维是指不能被人体消化道酵素分解的多糖类及木植素[1]。在消化系统中有吸收水分的作用;能促进肠胃蠕动,可舒解便秘;同时也能吸附肠道中的有害物质以便排出,改善肠道菌群,为益生菌的增殖提供能量和营养[2]。抗性淀粉就是其中的一种[3]。1992年,世界粮农组织(The world's food and agriculture organization,FAO)根据Englyst和欧洲抗性淀粉研究协作网(EURESTA)的建议,将抗性淀粉定义为:健康者小肠中不易吸收的淀粉及其降解产物[4]。近年的研究已经初步证明,抗性淀粉具有治疗便秘,控制糖尿病,促进脂类、胆固醇代谢,促进矿物质吸收,增强疾病抵抗力等与膳食纤维相似的生理功能[5]。因此,抗性淀粉是一种新型的食品配料,以单独的添加方式应用于食品配方中,是食用纤维及加工食品的理想材料[6]。至今抗性淀粉没有特别精确的分类,目前大体上将其分为四大类:RS1(物理包埋淀粉),指淀粉酶无法接近的淀粉,主要存在于完整或部分研磨的谷粒、豆粒之中。RS2(抗性淀粉颗粒),指未经糊化的生淀粉粒和未成熟的淀粉粒,常存在于生马铃薯、生豌豆、绿香蕉中。RS3(回生淀粉),指糊化后的淀粉在冷却或储存过程中部分重结晶,是凝沉的淀粉聚合物,常存在于冷米饭、冷面包、油炸土豆片中。RS4(化学改性淀粉),是指由基因改造或化学改性引起淀粉分子结构发生变化从而产生抗酶性的一类抗性淀粉,如交联淀粉、接枝频率较高的接枝共聚淀粉等[7]。近年来,化学改性淀粉品种越来越多,其在食品中的用途也越来越广泛。在化学改性淀粉中,柠檬酸酯化是常用的方法之一。在国内,王凯等对柠檬酸酯淀粉制备方法进行了一定的研究[8],而这些研究多集中于对原淀粉的柠檬酸酯化处理及相关性质的研究,而对预糊化淀粉的柠檬酸酯化研究较少,特别是采用高直链玉米淀粉先进行预糊化然后再进行柠檬酸酯化的研究则鲜见报道。
1 材料与方法
1.1 主要材料
高直链玉米淀粉:澳大利亚Ingredion公司;柠檬酸:天津大学科威公司;氢氧化钠:天津市科密欧化学试剂有限公司;无水乙醇:天津市风船化学试剂科技有限公司;葡萄糖测定试剂盒:长春汇力生物技术有限公司。
1.2 主要仪器
G/54TW型立式压力蒸汽灭菌器、GZX-9146MBE型电热鼓风干燥箱:上海博迅实业有限公司;TGL-16A型医用离心机:长沙平凡仪器仪表有限公司;PL203型电子天平:梅特勒-托利多公司;SU-1510型扫描电子显微镜:日本日立公司;Vector22型傅里叶变换红外光谱:德国Bruker;AQ5000型热重分析仪:美国TA公司。
1.3 试验方法
1.3.1 预糊化淀粉的制备
称取高直链玉米淀粉75 g,加入蒸馏水500 mL(配成15%的淀粉悬液),放置于500 mL的锥形瓶中,然后在121℃高压灭菌锅中处理30 min使其糊化后再在室温下放置12 h,以此操作循环3次。将制备好的预处理淀粉悬液置于均质机中,搅匀,使其呈现糊状。然后将样品放于10 000 r/min的离心机中离心10 min,倒掉上清,向沉淀中加入60%的乙醇,再次离心倒掉上清,然后再向沉淀中加入无水乙醇,离心倒掉上清,留取沉淀物,在通风厨下自然风干,粉碎。
1.3.2 柠檬酸酯化淀粉的制备
称取等量的原淀粉和预糊化淀粉,再以淀粉:柠檬酸的质量比为5∶2的比例混合,加入适量的蒸馏水,用10 mol/L的NaOH调节pH至3.5,待其完全溶解后,在室温下放置12 h,然后在50℃烘干12 h。取出干燥的样品,分别于110、130、150℃热处理3 h,用无水乙醇洗涤3次,30℃下烘干过夜,研磨碎过筛(400 nm)。
1.3.3 取代度的测定
准确称取2g样品(W1)。加入2mL蒸馏水和50mL 1 mol/L的KOH溶液,在沸水浴中加热10 min,待其冷却至室温,再用5 mol/L醋酸缓冲液调节pH至8.5,然后加入25 mL pH=8.5的硼酸盐缓冲液和0.3 g指示剂(红紫氨酸和Na2SO4以体积比为1∶500的比例混合),加入蒸馏水定容至300 mL,最后用0.05 mol/LCuSO4溶液滴定至红色消失,记下所用溶液的体积V1(mL)。
空白试验:准确称取折算成绝干样的原淀粉约2 g(记为W2)。利用上述测定步骤,记录用去的0.05 mol/L CuSO4标准溶液的体积为V2(mL)。

式中:162为淀粉相对分子质量;A为样品中柠檬酸酰基质量分数,%;M为淀粉相对分子质量,175.1。
1.3.4 消化性测定
根据周中凯等采用的淀粉消化性方法[9],并加以改进。准确称量200 mg的样品于100 mL锥形瓶中;加入300 μL唾液淀粉酶溶液(300 μL α-淀粉酶液溶于25 mL pH 5.0的醋酸-醋酸钠缓冲溶液中。α-淀粉酶活力2 000 U/g),震荡5 min;加入15 mL胃蛋白酶(250 mg猪源胃蛋白酶溶于0.02 mol/mL的盐酸中,配成1 mg/mL质量浓度的溶液),放于水浴恒温震荡器(130 r/min)中37℃下反应30 min。在反应混合物中加入15 mL 0.02 mol/mL氢氧化钠溶液(将纯度96%的固体氢氧化钠0.208 3 g溶解于250 mL蒸馏水中);加入25 mL无酶醋酸钠缓冲溶液后,再加入10 mL复合酶溶液(淀粉酶600 μL,糖化酶100 μL用pH 5.0的醋酸-醋酸钠缓冲溶液定容于50 mL容量瓶)。在37℃下继续反应12 h,然后在不同时间吸取一定的反应液用葡萄糖氧化酶法测定不同样品在不同时间反应液中葡萄糖含量,再利用公式C样品=(A样品/A标准品)×C标准品,(式中:A样品为测定出样品管的吸光度值;A标准品为测定出标准管的吸光度值;C标准品为标准液浓度即5.5 mmol/L)计算出样品中葡萄糖浓度。
同时收集不同时间段反应液中的残渣,用95%的酒精清洗2次,用于淀粉形态分析。
1.3.5 观察淀粉颗粒形貌
利用扫描电子显微镜对淀粉样品颗粒的外貌形态进行观察。将不同样品以及不同消化时期的样品干燥粉碎后,均匀的洒在在带有双面胶的圆形面盘上,用Hitachi 1B-3离子涂布器喷金镀膜,然后置于扫描电子显微镜下观测[10]。每种淀粉的颗粒形态记录3次。
1.3.6 柠檬酸酯化淀粉结构分析
淀粉样品的傅里叶变换红外光谱分析借鉴Sevenou的试验方法[11]进行,并作适当修改。扫描光谱范围为3 600 cm-1~600 cm-1,分辨率为4 cm-1,傅里叶变换红外光谱为Varian7000FTIR,采用DTGS检测器,衰减全反射(ATR)附件为MIRacleTM晶片和数显高压钳。取1 mg样品在红外灯的照射下,置于玛瑙研钵中研磨,研磨后与150 mg左右干燥的溴化钾粉末充分混合,继续研磨后压片,取出样品薄片,放入样品架上,置于红外光谱仪内波长为4 000 cm-1~500 cm-1扫描,绘制红外光谱图,利用Varian Resolutions Pro软件进行基线修订并处理得到图谱。
1.3.7 热重分析
称取样品5 mg~7 mg,将空托盘放入热重分析仪去皮后加入样品,以10℃/min的速率升温,温度范围为20℃~600℃,测得TG曲线,再用Origin软件对其进行分析[12]。
2 结果与讨论
2.1 热处理温度对取代度的影响
酯化温度对不同淀粉底物产生不同的影响见图1。
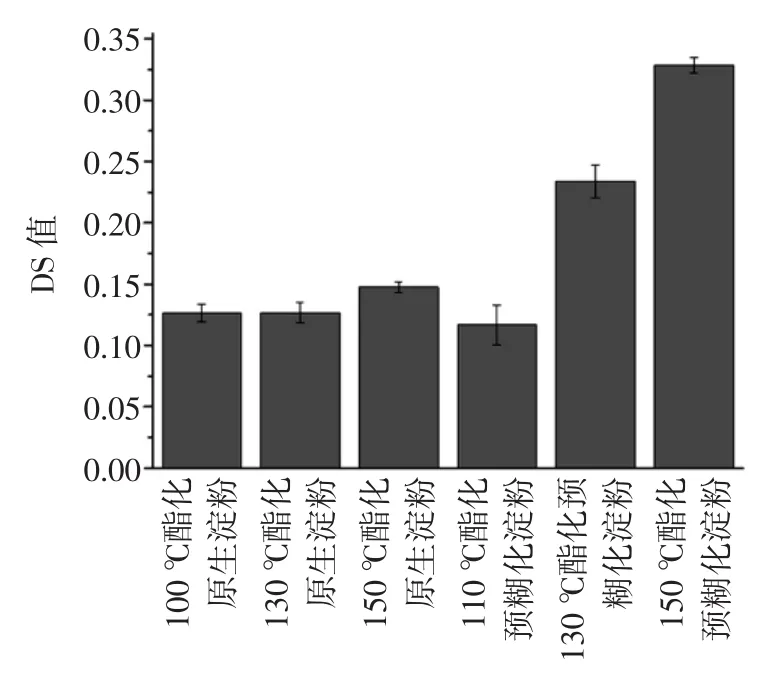
图1 不同温度制备的柠檬酸酯化淀粉取代度的测定Fig.1Determination of the degree of substitution of citric acid ester starch prepared by different temperature
由图1可见,从110℃升至130℃时,原淀粉的酯化取代度未发生变化,而对预糊化淀粉而言其酯化度呈现显著提高,说明预糊化处理提高了淀粉对酯化处理的敏感性。当温度进一步提升至150℃时,两种淀粉底物的酯化程度相比低温下均有明显的提升。这可能是由于,随着酯化温度的不断提高,柠檬酸分子内相邻的两个羧基会发生分子内的脱水,可以生成与淀粉发生反应的酸酐,导致分子内再次脱水,提高了反应的交联作用[13]。当温度达到150℃时,相比较原淀粉的DS值(0.150)而言,预糊化淀粉的DS值可高达0.328。考虑到在150℃处理下两种淀粉均可获得最大的取代度,因此在下面分析中均采用150℃处理的酯化淀粉。
2.2不同淀粉底物消化率分析
不同柠檬酸酯化淀粉消化性的测定见图2。

图2 不同柠檬酸酯化淀粉消化性的测定Fig.2Determination of the digestibility of starch with different citric acid
从图2可以看出,随着消化时间的推移,在前4个小时样品浓度均不断提高,消化性增加,并在10 h~ 12 h达到平稳期。图2显示,预糊化高直链淀粉的消化速率和消化程度远高于其对应的原淀粉,说明了预糊化过程对淀粉结构的影响,可能是在制备预糊化淀粉的过程中经过高温高压处理后,样品的晶体区域被转变为非晶体区域或片晶[14]。对原淀粉而言,柠檬酸酯化处理对其消化性质未见明显影响,而对于预糊化处理的高直链淀粉经酯化处理后,其消化率由4个样品中消化率最高(64.9%)迁移成消化率为最低(12.6%)。不同柠檬酸酯化淀粉的消化率见图3。可知,这种低消化率可能与其高取代度有关,柠檬酸酐的存在可能在分子构象上影响到消化酶与底物的有效结合,阻碍了淀粉酶的攻击[15],从而影响到其最终的消化率。
2.3 酯化和消化对淀粉形态的影响
2.3.1 预糊化和酯化过程对淀粉形态的影响
预糊化前后和酯化前后淀粉的扫描电镜图见图4。
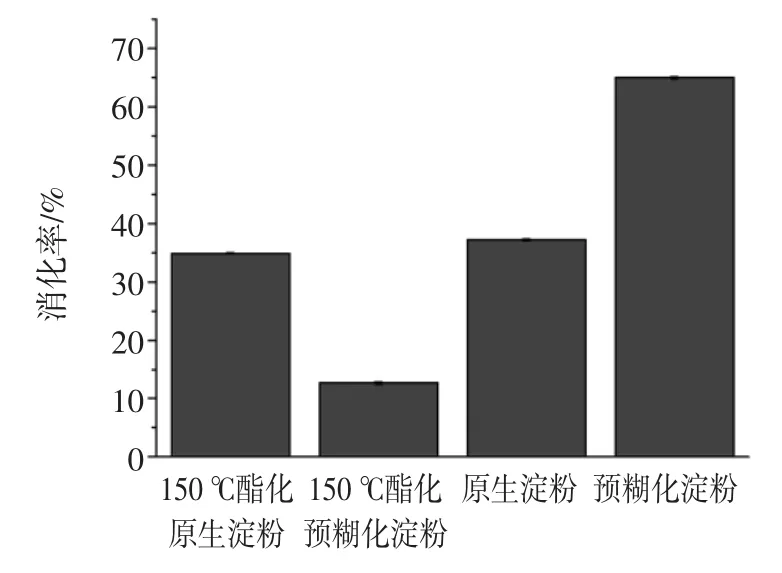
图3 不同柠檬酸酯化淀粉的消化率Fig.3Digestibility of starch by esterification of citric acid and citric acid
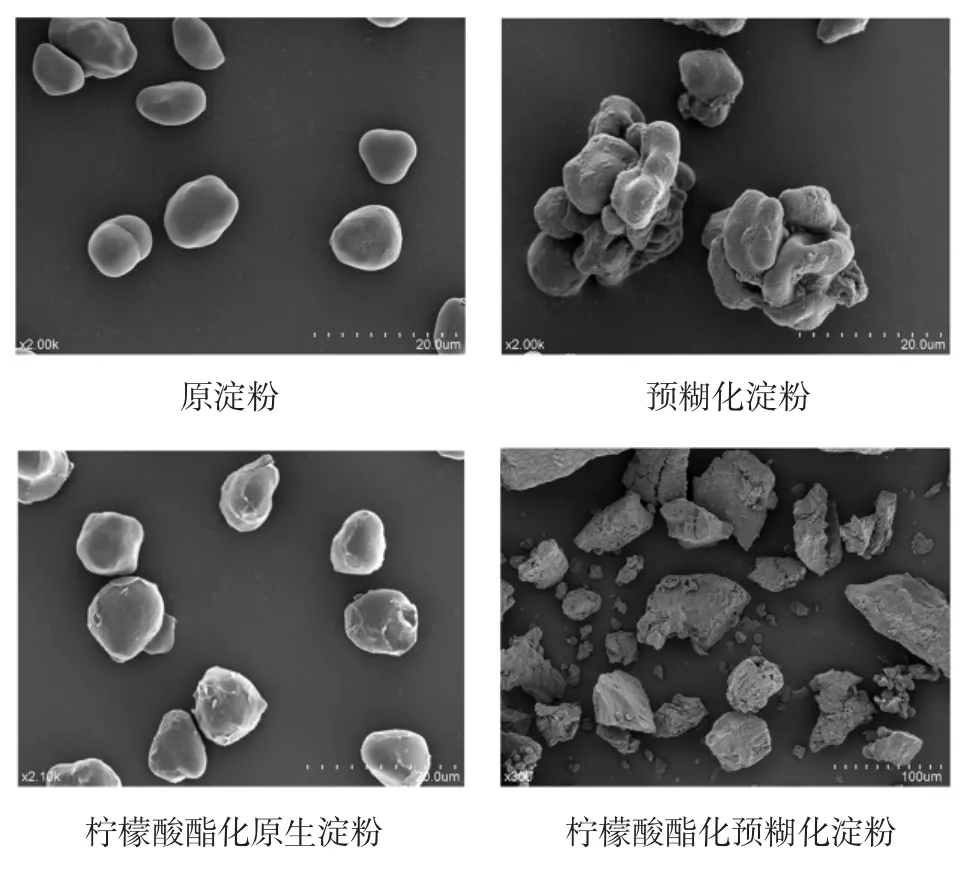
图4 预糊化前后和酯化前后淀粉的扫描电镜图Fig.4Scanning electron microscopy of starch before and after pre-and after esterification
从图4中可以看出,原淀粉呈非常规则的圆形,表面光滑。预糊化处理导致其形态成为无规则型,并且颗粒粘连在一起,进一步说明淀粉发生糊化行为[16]。显然酯化处理对淀粉形态的影响更为明显,导致原淀粉的形态发生了微小程度的变化,但对预糊化淀粉而言,酯化处理导致其外形发生了明显改变,呈现出不规则的棱形结构,可能是由于在样品制备过程中增加的柠檬酸造成了颗粒表面结构的变化,其表面呈现出明显的被侵蚀的痕迹,这说明了柠檬酸对淀粉表面具有附着作用,并且它们发生交联作用使其粘连在一起。
2.3.2 消化对淀粉形态的影响
无论是柠檬酸酯化的原生淀粉还是预糊化淀粉,与消化前相比淀粉其颗粒呈现出不同的形貌见图5。

图5 不同淀粉消化前后的扫描电镜图Fig.5Scanning electron microscope before and after digestion of different starch
如图5所示,消化后的淀粉表面均有明显的孔隙和凹陷,这是由于消化酶经过表面消化逐步向内部侵蚀作用造成的[17]。而消化导致淀粉颗粒表面孔隙和凹陷更加明显,这可能是由于预糊化以后的淀粉表面较为粗糙更有益于使柠檬酸在与淀粉的交联过程中附着作用,所以柠檬酸酯化预糊化淀粉的表面附着了更多的柠檬酸,在一定程度上可以阻碍消化酶对淀粉样品的作用,从而使消化酶在其表面的作用点变少,表面多孔的结构形态被降低[18],以至于降低了消化酶进入淀粉颗粒内部的可能性。
2.4 傅立叶变换红外光谱分析
不同淀粉样品的FTIR图见图6。


图6 不同淀粉样品的FTIR图Fig.6FTIR maps of different starch samples
如图6所示,预糊化淀粉与原淀粉的红外光谱图十分相似,只发生了细微的变化,说明高温高压处理仅仅是改变了淀粉样品的结构形态,对其内部结构的理化性质并未有显著影响。而经过柠檬酸酯化处理的淀粉红外光谱与原淀粉相比有了显著的变化,分别在2 338.08 cm-1、2 337.86 cm-1处有较明显的吸收峰,说明淀粉与柠檬酸发生了交联反应,并在酯化过程中产生了酯基。另外,柠檬酸酯化处理的预糊化淀粉与原生淀粉相比,在3 439.48 cm-1处的峰明显高于柠檬酸酯化原生淀粉在红外的吸收峰(3 423.70 cm-1),且在2 854.38 cm-1处出现一个新的吸收峰,可能淀粉中羟基更多地被柠檬酸根所取代。同时,该研究也表明酯化度愈高,其消化率愈低,抗消化性更强。
2.5 热重分析
不同样品热重分析见表1。
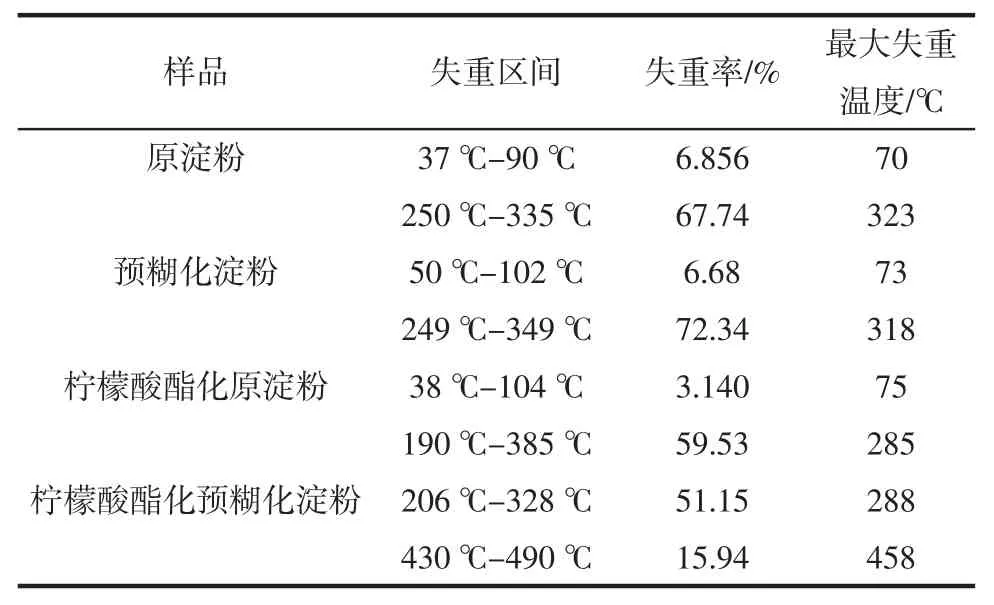
表1 不同样品热重分析Tabel 1Thermal gravimetric analysis of different samples
由表1可以得出,原淀粉有两段失重区域,在37℃~90℃为第一段失重,其失重率仅为6.856%,这主要是由于易挥发物质的蒸发所致,主要为水分的蒸发。第二阶段失重发生在250℃~335℃,这一区间的失重率为67.74%,可能是由于淀粉自身的热降解所致,在这一阶段C-C-H、C-O和C-C键发生断裂,主链也发生断裂[19]。预糊化淀粉与原淀粉类似,也有两段失重区域,自身热降解发生在249℃~349℃,这一区域的失重率为72.34%,比其对应的原淀粉略高,水分的蒸发区域发生在50℃~102℃,失重率为6.68%。柠檬酸酯化原淀粉虽然同样也有两段失重阶段,但是失重率和降解温度均低于原淀粉和预糊化淀粉,其主要失重温度在190℃~385℃,在该区域的失重率为59.53%,可能是淀粉自身分子链的断裂以及葡萄糖单元的热分解所致,水分蒸发的区域发生在38℃~104℃,失重率仅为3.140%。柠檬酸酯化预糊化淀粉也有两段失重区域,但与柠檬酸酯化原淀粉相比,第一阶段失重温度在206℃~328℃,这一区间的失重率达到51.15%,在430℃~490℃的失重率为15.94%。结果表明预糊化淀粉经过柠檬酸酯化以后其热分解温度升高,淀粉的热稳定性增强。
3 结论
通过本文初步研究了酯化温度对两种不同高直链淀粉酯化度的影响,结果表明预糊化处理显著提高,由原淀粉的DS(0.151)提高至DS(0.333),其消化率由原来的63.5%降低至12.9%,而本研究也发现柠檬酸酯化对高直链原淀粉的消化率并无显著影响。另外,预糊化导致的高酯化程度也采用了FTIR做了进一步证实。热重分析表明,预糊化处理导致淀粉失重率提升,但柠檬酸酯化将显著降低其失重率,说明其热稳定性明显提高,此研究内容为进一步提高淀粉中抗性淀粉含量及热稳定性提供了一定的指导作用。
[1]李焕霞,任志,王华,等.我国膳食纤维研究现状分析[J].中国食品添加剂,2007,25(6):161-164
[2]孙元琳,李文多.谷物膳食纤维制备及应用研究综述[J].郑州轻工业学院学报(自然科学版),2012,27(1):21-25
[3]薛山.新型膳食纤维——抗性淀粉在食品工业中的应用及前景[J].中国高新技术企业,2009,26(3):85-88
[4]陈光,高俊鹏,王刚,等.抗性淀粉的功能特性及应用研究现状[J].吉林农业大学学报,2005,27(5):578-581
[5]翟爱华,吕博华,张洪微.抗性淀粉的研究现状[J].农产品加工·学刊,2009(2):22-25
[6]Sevenous,Hillse,Farhatia et al.Organisation of theeternal regin of the starch granules as determind by infrared spectroscopy[J].IntJ Biol Macromol,2003,31(1/3):79-85
[7]姚蕊,张守文.抗性淀粉的研究发展现状与前景[J].粮食与食品工业,2006,13(1):30-33
[8]王恺,李书华.柠檬酸酯淀粉最佳制备条件的研究[J].食品与机械,2011(7):140-159
[9]周中凯,郑排云,陈晓姗.缓速消化小麦淀粉物化特征及其消化特性的研究[J].食品工业,2014,26(9):177-180
[10]杨蔚宁,谈应权,陈培荣,等.高直链玉米淀粉的特性及其醋酸酯化改性的研究[J].安徽农业大学学报,2009,36(1):63-67
[11]高群玉,李云云.甘薯抗性淀粉RS4的制备及理化性质的研究[D].广州:华南理工大学,2013:1-68
[12]L Bjorck,A Gunnarsson,K Ostergard.A study on native andchemically modified potato starch.Part II.Digestibility in the rat intestinal tract[J].Starch,1989,41:128-134
[13]Pham Van Hunga,Ngo Lam Viena,Nguyen Thi Lan Phib.Resistant starch improvement of rice starches under a combination of acid and heat-moisture treatments[J].Food Chemistry,2016,191:67-73
[14]Sang Ick Shin,Chang Joo Lee,Mi Jung Kim,et al.Structural characteristics of low-glycemic response rice starch produced by citric acid treatment[J].Carbohydrate Polymers,2009(5):588-595
[15]高俊鹏,陈光.抗性淀粉的制备工艺及理化性质的研究[D].吉林:吉林农业大学,2012:1-72
[16]L Bjorck,A Gunnarsson,K Ostergard.A study on native and chemically modified potato starch.Part II.Digestibility in the rat intestinal tract[J].Starch,1989,41:128-134
[17]于九皋,于密军.柠檬酸改性豌豆淀粉的研究[D].天津:天津大学, 2008:1-58
[18]周中凯,张岩,陈晓姗,等.波谱特性与淀粉消化行为的关系[J].粮食与饲料工业,2013,24(7):15-21
[19]Bingham S,Day N,Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition(EPIC):an observationa[J].Lancet,2003,361(3):1496-1501
Effect of Citric Acid Esterification on the Properties of the Raw Starch and Pre-paste Starch
ZHOU Zhong-kai,YANG Rui,SHEN Xiao-yu
(Tianjin University of Science&Technology,Tianjin 300457,China)
High amylose corn starch as raw material,through the heat treatment preparation of pregelatinized starch,and citric acid were esterified.Using in vitro model,Fourier transform infrared spectrometer(FTIR),scanning electron microscopy(SEM)and thermogravimetric analysis(TG)of two straight chain starch properties high difference method.The results showed that compared with the raw starch,pregelatinized starch more significantly improve the degree of esterification and reduced its digestibility.Comparison of two kinds of esterified starch,citric acid esterification pregelatinized starch will lead than raw starch citric acid esterification were lower the rate of digestion,the low digestibility was associated with high degree of substitution,its relevance was verified by absorption characteristics of Fourier transform infrared spectroscopy.At the same time,TG analysis showed that citric acid esterification of pregelatinized starch and its thermal decomposition at high temperature,Thermal stability was stronger.These structural characteristics may be related to its low digestibility.The further study of this study had a certain guiding significance for the further improvement of resistant starch content in starch.
high amylose corn starch;resistant starch;citric acid esterification;anti digestion
10.3969/j.issn.1005-6521.2017.09.002
2016-08-10
科技部农业科技成果转化(2014GB2A100527);国家自然科学基金(31471701)
周中凯(1964—),男(汉),教授,博士,研究方向:谷物科学与营养。
